AngioJet机械血栓清除术后血红蛋白尿的原因分析
2017-04-24韩新强王雪敏盛玉国王文明
韩新强,王雪敏,马 超,王 柱,盛玉国,陈 刚,赵 鹏,王文明*
(1.滨州医学院附属医院介入血管外科,2.消化内科,山东 滨州 256603)
AngioJet机械血栓清除术后血红蛋白尿的原因分析
韩新强1,王雪敏2,马 超1,王 柱1,盛玉国1,陈 刚1,赵 鹏1,王文明1*
(1.滨州医学院附属医院介入血管外科,2.消化内科,山东 滨州 256603)
目的 探讨采用AngioJet进行机械血栓清除术后出现血红蛋白尿的原因及影响因素。方法 回顾性分析接受AngioJet机械血栓清除术16例患者的临床资料,术后出现肉眼血红蛋白尿的患者为A组(n=9),余未出现血红蛋白尿的患者为B组(n=7),比较两组患者手术操作方式、术中抽吸时间、血栓负荷量的差异。结果 16例研究对象中9例出现血红蛋白尿,发生率为56.25%(9/16)。A组与B组手术方式(χ2=1.667,P=0.197)、术中抽吸时间[(320.11±108.80)s vs (265.29±31.46)s,t=0.741,P=0.457]、血栓负荷量(χ2=0.442,P=0.506)差异均无统计学意义。所有病例均无肾功能损害出现。结论 AngioJet机械血栓清除术后出现血红蛋白尿由多种因素所致,术中采用合理的抽吸方式、控制抽吸时间、围手术期积极对症处理,可降低血红蛋白尿的发生。
血栓;血红蛋白尿;机械血栓清除;血管内溶血
血红蛋白尿属血管内溶血,当红细胞被破坏时,可释放血红蛋白,如果游离血红蛋白量超过肾脏阈值时即可出现肉眼血红蛋白尿。AngioJet Ultra属机械血栓清除装置,可对红细胞产生机械性损伤,导致血管内溶血。本研究对我院采用AngioJet血栓清除系统进行血栓抽吸的患者术中,术后出现血红蛋白尿的相关因素进行分析,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2016年1月—2016年8月我院收治的16例急性下肢动静脉血栓患者资料,男10例,女6例,年龄27~75岁,平均(55.8±14.2)岁。病程1~5天,平均(2.4±1.3)天。其中下肢静脉血栓患者13例,发生于左下肢者12例,右下肢者1例。按髂静脉、股静脉各为一个独立部分,共17个部位;下肢动脉血栓患者3例,均发生于右下肢,按髂动脉、股动脉、腘动脉各为一个独立部分,共6个部位。所有患者术前均行下肢动静脉彩色多普勒超声和/或CTA明确诊断,并接受AngioJet机械血栓清除手术。
1.2方法
1.2.1开通闭塞段血管 动脉血栓患者局部麻醉后采用Seldinger技术穿刺健侧股动脉,置4F导管鞘,采用4F猪尾导管首先于腹主动脉末端造影,评价闭塞段动脉范围及其远端动脉代偿情况。其中1例髂动脉闭塞患者,行经健侧股动脉“翻山”超选患侧失败后,改行穿刺患侧股浅动脉,植入6F导管鞘,0.035 in“泥鳅”导丝与单弯导管配合开通闭塞段血管。余2例均经健侧股动脉“翻山”开通闭塞段血管,然后换用6F导管鞘。
静脉血栓患者局部麻醉后采用Seldinger技术穿刺健侧股静脉,置4F导管鞘,采用4F猪尾导管造影明确双侧肾静脉位置,植入国产“先健”滤器1枚,后经患侧足背静脉留置针行下肢静脉顺行造影明确血栓部位,其中中央型静脉血栓9例,混合型静脉血栓4例。其中4例换用6F“翻山鞘”,配合Cobra导管、0.035 in“泥鳅”导丝超选患侧髂股静脉,其余9例患者取俯卧位后穿刺腘静脉置6F导管鞘,0.035 in“泥鳅”导丝与单弯导管配合开通闭塞段血管。
1.2.2血栓内喷药溶栓+血栓抽吸 16例患者开通闭塞段血管后,经0.035 in 260 cm超滑加硬导丝引入6F AngioJetTMUltra血栓抽吸导管(美国Boston Scientific公司 6F SolentTMOmni)到达血栓处。其中1例动脉血栓患者及4例静脉血栓患者先使用尿激酶溶液(尿激酶25万U+100 ml生理盐水)进行血栓内喷射溶栓,15 min后启动AngioJet机械血栓清除装置进行血栓抽吸;其他患者直接予以血栓抽吸,灌注液体为生理盐水500 ml+普通肝素5 000 IU混合溶液。动脉血栓均为导管通过血栓后逆血流方向抽吸,静脉血栓抽吸有两种方式,4例为导管通过血栓后自血栓接触血流处开始抽吸,9例自血栓远心端开始抽吸至近心端血流处。抽吸术后即刻造影,如残余血栓较多,则行多次抽吸(图1、2)。
1.2.3对血栓抽吸后残存狭窄病变血管进行球囊扩张或植入支架 1例髂动脉闭塞患者及6例髂静脉狭窄患者均行球囊扩张经皮血管成形术(percutancous transluminal angioplasty, PTA)及血管内支架植入治疗。术后继续予以抗血小板聚集、抗凝、扩血管、溶栓等药物治疗。
1.2.4围术期处理 患者术前导尿,术前1 h开始补充生理盐水,血栓抽吸开始前30 min开始补充5%碳酸氢钠溶液。如术中肉眼血红蛋白尿较多,则术后增加水化补液量,视患者尿量增加碳酸氢钠溶液量碱化尿液,同时予以呋塞米利尿,记录尿量、尿色变化。术后当天复查血常规、血生化、尿常规,术后第2天再次复查,对比术前及术后24 h内血液中红细胞、血红蛋白、肌酐、尿素氮、血钾及尿中红细胞变化。
将患者分为两组,术中和术后出现肉眼血红蛋白尿者为A组,余未出现血红蛋白尿者为B组。

2 结果
16例患者均进行了血栓抽吸治疗,13例达血栓清除率Ⅲ级,3例达到血栓清除率Ⅱ级标准。抽吸时间134~480 s,平均(286.00±97.16)s。术后尿液引流量4 000~8 500 ml,平均(6 500.00±1 404.28)ml。12例患者术后尿常规提示尿潜血阳性,9例患者(A组)可见肉眼血红蛋白尿,发生率为56.25%(9/16)。
手术方式:A组动脉血栓1例,为导管通过血栓后逆血流方向抽吸;静脉血栓8例,其中4例自血栓接触血流处开始抽吸,4例自血栓远心端开始抽吸至近心端血流处。B组7例,动脉血栓2例,手术方式同A组;静脉血栓5例,均为自血栓远心端开始抽吸至近心端血流处。两组手术方式差异无统计学意义(χ2=1.667,P=0.197)。抽吸时间:A、B组抽吸时间相比差异无统计学意义[(320.11±108.80)s vs (265.29±31.46)s,t=0.741,P=0.457)。血栓负荷量:A组9例患者共累及血管14处,B组7例累及血管9处,差异无统计学意义(χ2=0.442,P=0.506;表1)。

表1 A、B两组血栓类型及累及部位(处)
患者术后24 h内尿液颜色变为正常。术前、术后血尿素氮、肌酐比较差异无统计学意义(P均>0.05),术前与术后24 h红细胞、血红蛋白、血钾、尿中红细胞变化比较差异有统计学意义(P均<0.05),见表2。术后观察3~10天均无少尿情况发生,对患者1个月内随访,期间无少尿、全身浮肿等现象发生。
3 讨论
血红蛋白由血红素和珠蛋白构成,仅存在于红细胞内,正常尿液中无血红蛋白,当血管内溶血使血浆中血红蛋白浓度升高超过结合珠蛋白所能结合的量时,即以游离血红蛋白的形式从肾小球滤出,形成血红蛋白尿排出体外[1]。血红蛋白尿属血管内溶血,当红细胞受到外力及渗透压变化等因素的影响时可出现红细胞膜的损害,发生溶血[2-3]。大量血红蛋白尿出现可能导致急性肾功能损害(acute kidney injury, AKI),尽管其机制尚不明确,但血红蛋白尿可在肾小管内形成各种管型阻塞肾小管管腔,导致肾小球滤过率减少,引起少尿。另外过多的血红蛋白可以导致近曲肾小管细胞的损害,进而出现AKI[4]。等渗生理盐水水化、5%碳酸氢钠碱化尿液、保证充足的尿量可避免由于溶血造成的急性肾小管坏死的发生,从而减少AKI的发生概率。
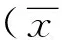
表2 患者手术前后实验室指标比较±s)
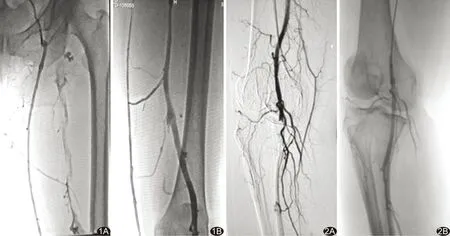
图1 患者男,53岁,左下肢肿胀3天 A.经左侧足背静脉造影示股浅静脉内大量新鲜血栓形成; B.应用AngioJet导管抽吸后造影可见股静脉内血栓消失,管腔内血流通畅 图2 患者男,68岁,右下肢疼痛1天 A.下肢动脉造影见腘动脉血栓形成; B.应用AngioJet导管抽吸后可见腘动脉内血栓消失,管腔内血流通畅,胫前动脉显影
AngioJet Ultra机械血栓清除系统的工作原理为流体力学伯努利原理,是流变学机械血栓抽吸设备,其可利用导管腔内高速流动的液体产生导管周围的低压区,将血栓负压下吸入导管内,并被高速水流击碎随之排至体外。部分导管内盐水呈水雾喷出并在导管远端被吸入,形成循环水流,从而扩大抽吸范围和增强抽吸效率;血栓抽吸前部分患者需要经导管喷注尿激酶溶液,血栓负荷量较大时导管需在血管内反复抽吸[5-6],以上过程均可对红细胞造成机械性损伤,产生血管内溶血[7-8]。
由于AngioJet应用于外周动静脉血栓治疗中的可借鉴经验不多,本中心初期治疗的病例中除2例动脉血栓未出现肉眼血红蛋白尿外,其余均出现肉眼血红蛋白尿。笔者发现如进行血栓抽吸部位的血流较多,患者术中很快出现血红蛋白尿,且随操作时间的延长,尿的颜色逐渐加深;如果血栓抽吸部位无血流或仅有少许血流通过时,即使延长操作时间,患者也未必出现血红蛋白尿。提示被抽吸血栓周围的血流、抽吸导管的开始位置可能与血红蛋白尿有关。因此通过改进操作方法,如下肢静脉血栓由腘静脉入路,使AngioJet导管在血栓内顺行抽吸前进至静脉血栓的起始端,最后处理近心端的血栓,大大减少了对血液中红细胞的机械性损伤。但通过对本组16例患者的资料分析,A、B两组血栓负荷量及手术方式差异无统计学意义,可能与样本资料少、血栓负荷量与手术方式相互影响等因素有关。
另外血栓抽吸时间也可能一定程度上影响血红蛋白尿的发生,本组为最大限度地清除血栓,抽吸时间均达到或接近产品说明所允许的最大时间值,两组抽吸时间相比差异无统计学意义。但有研究[4,7-8]认为对下肢深静脉大量血栓进行抽吸时,血红蛋白尿导致急性肾小管损害,且缩短抽吸时间可降低发生AKI的概率。Nazarian等[9]研究发现,应用机械血栓清除装置中出现血红蛋白尿的概率与操作时间呈指数相关,而不是线性相关,因此提示在有血流的血栓内,严格控制时间至关重要。
对于预防AKI的发生,围术期的处理至关重要,本研究16例患者均采取水化、碱化尿液,利尿等处理,无严重肾脏病患者出现。
针对以上现象,对于预防AngioJet术中、术后出现血红蛋白尿,有以下应对措施:①术中尽量减少血流通过血栓,如为中心型静脉血栓,先从静脉闭塞的远心端顺血流方向前进导管进行血栓抽吸,对于动脉血栓则可取逆血流方向进行操作。②术中尽量缩短操作时间,在保证血栓清除率的情况下,尽可能不超过产品说明所规定的时间,血栓完全闭塞血管的情况下,最多可抽吸480 s,血栓未完全闭塞血管、远端有血流的情况下,最多可抽吸240 s;但要根据术中造影判断是否存在陈旧性血栓。③围术期需大量水化,术前0.5~1.0 h至术后6.0~12.0 h每小时输液量为1.0~1.5 ml/kg体质量。静脉输注5%的碳酸氢钠碱化尿液,使患者尿液的pH值在6.5以上,但应根据患者尿量调节碳酸氢钠的用量[10-11]。④严格选择采用AngioJet设备患者的适应证,下肢静脉血栓患者病程14天以内,最佳时间窗为5天。急性动脉栓塞发病时间较短,多在几小时内就诊,基本不存在时间问题,但术后应控制栓子脱落的源头,预防再次栓塞。⑤术前充分了解患者各项实验室检查结果,及早发现原发病,并予以及早对症处理,可减少AKI的发生。
由于本研究病例数较少,结果缺乏统计学证据支持,需规范手术方式并增加样本量进一步研究。
总之,AngioJet机械血栓清除术后出现血红蛋白尿由多种因素所致,术中采用合理的抽吸方式、控制抽吸时间、围手术期积极对症处理,可降低血红蛋白尿的发生。
[1] 叶任高,陆再英.内科学.北京:人民卫生出版社,2006:561-563.
[2] 陈卫东.尿液检测的临床价值.中华全科医学,2014,12(2):169-170.
[3] Veerreddy P. Hemoglobinuria misidentified as hematuria: Review of discolored urine and paroxysmal nocturnal hemoglobinuria. Clin Med Insights Blood Disord, 2013,6:7-17.
[4] Dukkipati R, Yang EH, Adler S, et al. Acute kidney injury caused by intravascular hemolysis after mechanical thrombectomy. Nat Clin Pract Nephrol, 2009,5(2):112-116.
[5] 宋进华,何旭,楼文胜,等.急性髂股静脉血栓治疗中AngioJet机械性血栓清除装置初步应用结果.中华放射学杂志,2015,49(10):758-762.
[6] Garcia MJ, Lookstein R, Malhotra R, et al. Endovascular management of deep vein thrombosis with rheolytic thrombectomy: Final report of the prospective multicenter PEARL (peripheral use of AngioJet rheolytic thrombectomy with a variety of catheter lengths) registry. J Vasc Interv Radiol, 2015,26(6):777-785;quiz 786.
[7] Margheri M, Vittori G, Vecchio S, et al. Early and long-term clinical results of AngioJet rheolytic thrombectomy in patients with acute pulmonary embolism. Am J Cardiol, 2008,101(2): 252-258.
[8] Mair DC, Eastlund T, Rosen G, et al. Hemolysis during percutaneous mechanical thrombectomy can mimic a hemolytic transfusion reaction. Transfusion, 2005,45(8):1291-1294.
[9] Nazarian GK, Qian Z, Coleman CC, et al. Hemolytic effect of the amplatz thrombectomy device. J Vasc Interv Radiol, 1994,5(1):155-160.
[10] 唐勇,陈健,周卿,等.不同水化方案预防造影剂肾病临床研究.中华实用诊断与治疗杂志,2013,27(8):783-785.
[11] 张功霖,赵卫.对比剂肾病的预防及危险分层的研究进展.中国介入影像与治疗学,2012,9(12):889-892.
Causes of hemoglobinuria after AngioJet mechanical thrombectomy
HANXinqiang1,WANGXuemin2,MAChao1,WANGZhu1,SHENGYuguo1,CHENGang1,ZHAOPeng1,WANGWenming1*
(1.DepartmentofInterventionalMedicineandVascularSurgery, 2.DepartmentofGastroenterology,BinzhouMedicalUniversityHospital,Binzhou256603,China)
Objective To investigate the causes and factors of hemoglobinuria in patients with thrombosis after AngioJet mechanical thrombectomy. Methods The clinical data of 16 patients with thrombosis treated by AngioJet thrombectomy system were retrospectively analyzed. Nine patients with hemoglobinuria during the procedure were included in group A, while 7 patients without hemoglobinuria in group B. The type of surgical procedure, time of intraoperative aspiration and the thrombus volume were compared between both groups. Results Nine (9/16, 56.23%) of 16 patients were found hemoglobinuria during and after AngioJet mechanical thrombectomy. There were no statistically significant differences in surgical approaches (χ2=1.667,P=0.197), the time of intraoperative aspiration ([320.11±108.80]s vs [265.29±31.46〗s,t=0.741,P=0.457), the thrombus volume (χ2=0.442,P=0.506) between both groups. No renal function failure were noted directly relating to the use of the AngioJet thrombectomy device. Conclusion There are many factors influenced the occurrence of hemoglobinuria in the patients after AngioJet thrombectomy. It can be reduced by using reasonable type of intraoperative aspiration, controled time of aspiration and active perioperative symptomatic treatment.
Thrombosis; Hemoglobinuria; Mechanical thrombectomy; Intravascular hemolysis
韩新强(1982—),男,山东滨州人,硕士,主治医师。研究方向:血管疾病介入治疗。E-mail: hxq_0543@163.com
王文明,滨州医学院附属医院介入血管外科,256603。E-mail: sdxb_2008@126.com
2016-10-13
2017-01-24
R543.6; R816
A
1672-8475(2017)04-0218-05
10.13929/j.1672-8475.201610012
