AIDS患者巨噬细胞对白念珠菌的吞噬和灭活功能研究
2017-04-21王有为
崔 凡 穰 真 王有为 杨 戈
·论著·
AIDS患者巨噬细胞对白念珠菌的吞噬和灭活功能研究
崔 凡 穰 真 王有为 杨 戈
目的: 明确AIDS患者巨噬细胞对白念珠菌的吞噬和杀灭活性功能。方法: 提取AIDS患者和健康者的单核细胞,诱导分化为巨噬细胞。荧光显微镜和流式细胞仪测定巨噬细胞对白念珠菌的吞噬活性; CFU计数法分析巨噬细胞对白念珠菌的杀灭活性;测定巨噬细胞内亚硝酸盐含量,分析呼吸爆炸相关产物一氧化氮的生成; Western blot法测定巨噬细胞磷酸化酪氨酸激酶的表达。结果: AIDS患者的巨噬细胞对白念珠菌的吞噬、杀灭能力、一氧化氮及磷酸化Syk的蛋白均低于健康者。结论: AIDS患者巨噬细胞吞噬和杀灭白念珠菌活性降低。
获得性免疫缺陷综合征; 人巨噬细胞; 白念珠菌; 抗真菌感染免疫
获得性免疫缺陷综合征(AIDS)由人类免疫缺陷病毒(HIV)感染引起。HIV病毒通过衣壳包膜gp120蛋白识别CD4+T细胞,攻击并大量破坏这些细胞[1]。在人体免疫应答中,CD4+T细胞是介导细胞免疫和体液免疫的重要枢纽[2]。CD4+T细胞大量减少将导致机体发生各种机会性病原微生物感染(细菌、病毒、真菌等)以及恶性肿瘤[3]。继发系统性真菌感染在AIDS患者中相对比较普遍,在临床分离的病原真菌中,白念珠菌感染率最高[4]。HIV除了攻击CD4+T细胞,目前发现它还能进入巨噬细胞,在细胞内存在、繁殖并引起宿主持续性感染[5]。有研究证实单核细胞在体内分化为巨噬细胞后,对于HIV的易感性发生显著提高[6]。在宿主抗真菌感染免疫中,巨噬细胞介导宿主抗真菌感染天然免疫的识别启动,并在效应阶段对真菌有吞噬和杀灭作用,在抗真菌的固有免疫和获得性免疫中均处于核心地位[7]。HIV入侵并定植于巨噬细胞后,对于巨噬细胞抗真菌免疫活性是否存在影响,从而加重CD4+T细胞减少引起的细胞免疫缺陷,目前并不完全清楚。本研究我们对比了AIDS患者与健康者巨噬细胞吞噬和杀灭白念珠菌的活性,分析了HIV感染对于巨噬细胞免疫功能的影响。
1 材料与方法
1.1 研究对象及菌株
1.1.1 研究对象 本实验研究对象为在我院皮肤科门诊及四川省性病艾滋病确认实验室确诊进入艾滋病期的HIV感染者,共8例,均为男性,年龄21~45岁。所有AIDS患者均出现不同程度的系统感染症状(表1)。同时设立8名健康男性志愿者作为对照。
1.1.2 菌株 本实验所用菌株为白念珠菌野生型临床株SC5314,由Case Western Reserve University的Mahmoud Ghannoum教授馈赠。

表1 AIDS患者及健康对照者信息
注:AIDS指艾滋病患者,Healthy指健康对照者
1.2 单核细胞提取及巨噬细胞的诱导分化 本实验经四川省人民医院医学伦理委员会论证通过,[编号:伦审(研)2016年第22号]。所有供血者均签署知情同意书。取AIDS患者及健康对照者的静脉血置于Ficoll gradient-1077(美国Sigma-Aldrich)之上,1200 rpm离心20 min。小心吸取外周血多形核细胞(PBMC),用含1% FBS(胎牛血清)的HBSS离心洗涤后于含10% FBS的RPMI-1640(美国Hyclone)培养液中37℃,5% CO2孵育1 h。小心吸取并弃去上清,保留贴壁生长细胞。于培养皿中加入含0.5 mM EDTA及1% FBS的HBSS(美国Hyclone),孵育10 min。反复吹打,分离贴壁细胞;收获的细胞用HBSS洗涤2次,经单核细胞提取试剂盒(加拿大StemCell Technologies)中的“鸡尾酒”抗体孵育,穿过MACS磁力装置,通过阴性选择法分离得到纯化的单核细胞。将单核细胞重新悬浮于含10% FBS的RPMI-1640和500 U/mL GM-CSF(美国Pepro Tech)中培养,培养液和GM-CSF隔天更换,连续14 d诱导单核细胞在体外分化为巨噬细胞。所得细胞经过鼠抗人CD11b-FITC抗体(美国BD Pharmingen)孵育,在流式细胞仪下检测CD11b表达率,使用Winlist 6.0软件分析实验结果。
1.3 巨噬细胞对念珠菌临床株吞噬活性的测定 将白念珠菌悬液置于血细胞计数板上计数,通过稀释法,将浓度调节为1×106/mL。将1×106/mL的白念珠菌在暗处与0.05 μg/mL ConA - FITC(美国Sigma)共孵育10 min,1500 rpm离心5 min,沉淀用HBSS悬浮后离心洗涤2次,去除游离荧光素。标记后的白念珠菌用RPMI-1640培养液悬浮,调节密度至2×106/mL,与2×106/mL从AIDS患者分离并诱导的巨噬细胞等体积混合,反应体系10 mL,置于培养皿中,37℃,5% CO2培养箱共孵育2 h。同时设立白念珠菌与健康者巨噬细胞共培养组做对照。各实验组设三个复孔。共培养终止后加入10 μL Trypan blue染液以灭活未被吞噬的念珠菌表面的荧光。加入含1% FBS的HBSS,混匀后1500 rpm离心5 min,洗涤2次。取200 μL细胞悬液置于装备BW/Color Retiga EXi摄像机的自动倒置显微镜(美国Leica DMI 6000B)下观察。同时拍摄相差照片和荧光照片,并用Metamorph v.7.5.5.0软件处理结果。同时细胞悬液在流式细胞仪下定量分析各共培养组巨噬细胞的FITC荧光表达情况。
1.4 巨噬细胞对白念珠菌杀灭活性的测定 白念珠菌(1×104/mL)与AIDS患者的巨噬细胞(1×106/mL)在10 mL含10% FBS的RPMI-1640培养液37℃,5% CO2共培养6 h。同时设立白念珠菌单独培养组、白念珠菌与健康者巨噬细胞共培养组做对照。各实验组设三个复孔。共培养终止后将各培养组的白念珠菌和细胞混悬液均匀分布于SDA培养基表面,37℃培养2 d。对白念珠菌的菌落形成单位(CFU)进行计数。巨噬细胞对白念珠菌的杀灭率=(念珠菌单独培养CFU值-各共培养组CFU值)/念珠菌单独培养CFU值×100%。
1.5 巨噬细胞的呼吸爆炸相关产物(一氧化氮)测定 白念珠菌与AIDS患者的巨噬细胞在10 mL含10% FBS的HBSS中37℃,5% CO2共培养2 h,密度均为1×106/mL。同时设立白念珠菌与健康者巨噬细胞共培养组做对照。各实验组设三个复孔。收集各实验组培养液,离心后取细胞沉淀,加入100 μL细胞组织裂解液(中国碧云天)吹打均匀。14 000 rpm离心5 min,取上清液,参照使用说明,用总一氧化氮检测试剂盒(中国碧云天)测定总亚硝酸盐浓度。一氧化氮极不稳定,在细胞内很快代谢为亚硝酸盐。通过检测亚硝酸盐的摩尔浓度,就可以推算出总的一氧化氮的摩尔浓度。
1.6 Western blot法分析巨噬细胞磷酸化Syk的蛋白表达 白念珠菌与AIDS患者的巨噬细胞在10 mL含10% FBS的RPMI-1640培养液37℃,5% CO2共培养20 min,密度均为1×106/mL。同时设立白念珠菌与健康者巨噬细胞共培养组做对照。各实验组设三个复孔。收集各组细胞,加入200 μL Chaps蛋白抽提缓冲液(美国Cell Signaling Technology)反复冻融两次,4℃ 14 000 rpm离心10 min,吸取上清蛋白于-80℃保存。各组细胞蛋白于12% SDS-PAGE胶200V电泳60 min,转移至PVDF膜。5%脱脂奶粉封闭PVDF 1 h,加入兔抗人磷酸化脾脏酪氨酸激酶(spleen tyrosine kinase,Syk)抗体(英国Abcam),室温孵育2 h。洗膜后加入HRP结合的抗兔IgG抗体(美国Cell Signaling Technology)继续孵育1 h。洗膜后,PVDF与SuperSignal West Dura底物工作液(美国Thermo Scientific)反应5 min,继而在X光下成像。用Restore Western Blot Stripping Buffer(美国Thermo Scientific)洗脱与PVDF膜结合的抗体。加入鼠抗人β-actin单克隆抗体(美国Sigma-Aldrich)与PVDF膜共孵育2 h,继而加入HRP结合的抗鼠IgG抗体(美国Cell Signaling Technology)作用1 h,显色、成像。
1.7 统计学方法 应用SPSS 17.0软件进行数据统计分析。计量资料用双侧t检验表示,显著性水平取α=0.05。若伴随概率P<0.05,则差异具有统计学意义。
2 结果
2.1 单核细胞在体外分化为巨噬细胞 AIDS患者及健康者外周血单核细胞在GM-CSF的作用下,经过14 d的培养,细胞体积明显增大,贴壁生长(图1)。流式细胞仪检测CD11b表达水平为82.5%。CD11b是单核细胞转化为巨噬细胞过程中特异性的表面分子标记,证明大部分单核细胞被诱导分化为巨噬细胞。

1a:单核细胞(×200)在体外被诱导为巨噬细胞;1b:巨噬细胞(×400)过程中形态发生变化,体积明显增大,贴壁生长。
注:标尺长度为50 μM
图1 人外周血单核细胞在体外分化为巨噬细胞
2.2 AIDS患者巨噬细胞对白念珠菌的吞噬活性降低 经过2 h的共培养,荧光显微镜显示部分巨噬细胞内出现绿色荧光颗粒(图2),提示巨噬细胞可以通过吞噬作用摄取白念珠菌孢子。流式细胞仪定量分析各实验组巨噬细胞吞噬白念珠菌的活性,结果显示AIDS患者巨噬细胞对白念珠菌的吞噬率较健康者明显降低(11.37±1.8% vs 18.53±1.25%,P=0.005)。(图3)。
2.3 AIDS患者巨噬细胞对白念珠菌杀灭活性降低 经过6 h共培养,再通过平皿接种培养和CFU计数,与健康者巨噬细胞相比,AIDS患者巨噬细胞对白念珠菌的杀灭活性下降(46.67±4.5% vs 63.33±4.5%,P=0.01)(图4)。该结果提示AIDS患者巨噬细胞对白念珠菌的杀灭活性存在缺陷。
2.4 AIDS患者巨噬细胞的呼吸爆炸活性降低 经过2 h共培养,AIDS患者巨噬细胞产生亚硝酸盐的浓度较健康者显著下降(25.67±2.52 μmol/L vs 34.33±4.16 μmol/L,P=0.03)(图5)。由于呼吸爆炸产物一氧化氮溶于水后,生成等摩尔亚硝酸盐,亚硝酸盐的摩尔浓度就可以反映一氧化氮浓度。该结果证实AIDS患者巨噬细胞杀灭被吞噬真菌的呼吸爆炸活性较健康者减弱。
2.5 AIDS患者巨噬细胞的磷酸化Syk活化障碍 与白念珠菌共培养20 min后,健康者巨噬细胞的磷酸化Syk的蛋白表达显著增加。对比于健康者,AIDS患者巨噬细胞的磷酸化Syk表达活化并不明显(图6)。鉴于Syk在巨噬细胞呼吸爆炸中的作用,进一步提示AIDS患者巨噬细胞吞噬和杀灭白念珠菌功能障碍。

荧光标记的白念珠菌孢子被吞噬后,在巨噬细胞内发出绿色荧光(×400)
图2 荧光显微镜显示人巨噬细胞对白念珠菌的吞噬作用
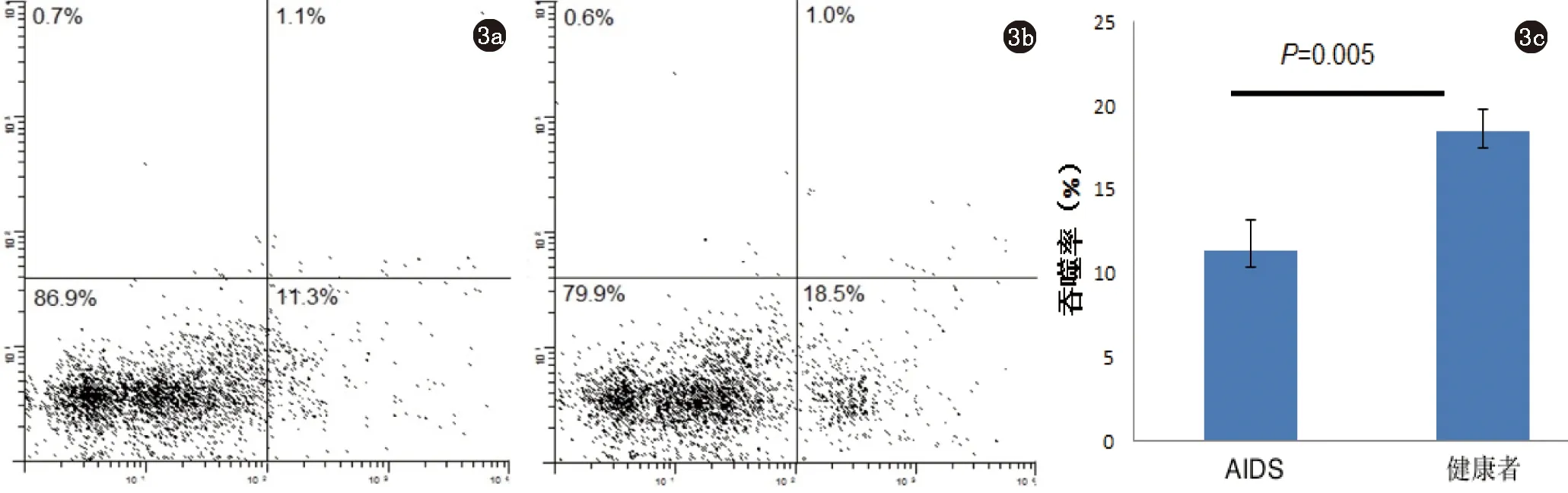
图3 a:AIDS患者巨噬细胞吞噬白念珠菌流式细胞图;b:健康者巨噬细胞吞噬白念珠菌流式细胞图;c:AIDS患者与健康者巨噬细胞对白念珠菌的吞噬率

图4 a:白念珠菌CFU计数,白念珠菌:白念珠菌单独培养;AIDS:AIDS患者巨噬细胞+白念珠菌;健康者:健康者巨噬细胞+白念珠菌;b:巨噬细胞对白念珠菌的杀灭率
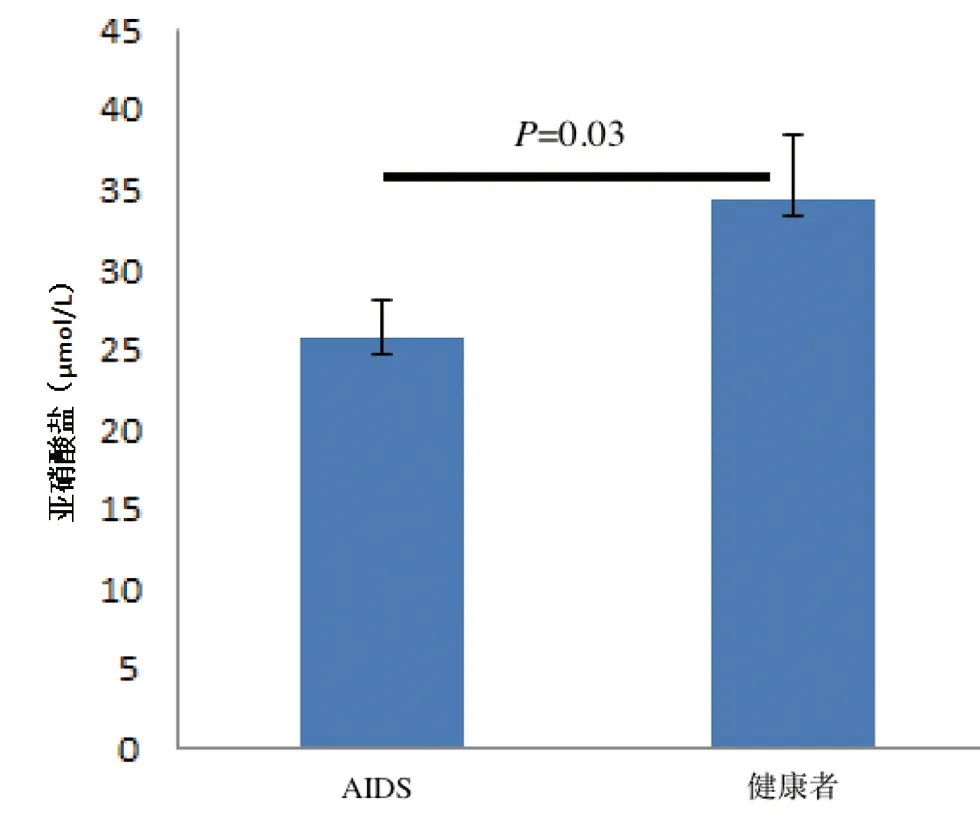
AIDS:AIDS患者巨噬细胞+白念珠菌,健康者:健康者巨噬细胞+白念珠菌。
图5 巨噬细胞呼吸爆炸产物测定
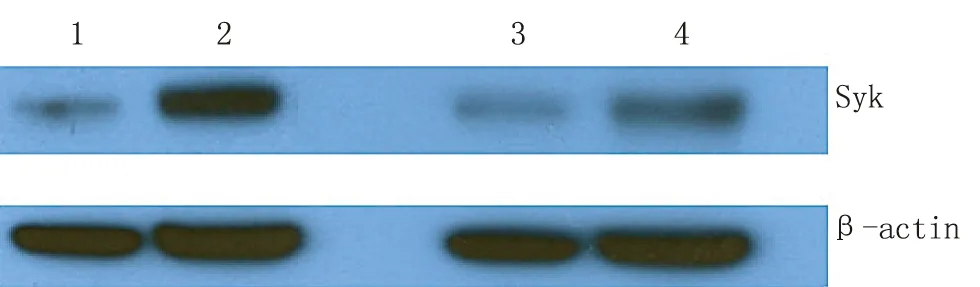
1、2道分别为健康者巨噬细胞与白念珠菌共培养0和20 min;3、4道分别为AIDS患者巨噬细胞与白念珠菌共培养0和20 min
图6 巨噬细胞的磷酸化Syk表达情况
3 讨论
HIV通过黏膜入侵人体后主要感染黏膜局部的CD4+T细胞,继而进入血流播散引起全身的CD4+T细胞受累。此外,HIV同时能够感染人单核巨噬细胞系[5]。在感染早期,巨噬细胞在感染细胞中所占比例微不足道。随着CD4+T细胞被大量破坏,单核巨噬细胞系便成为携带HIV的重要载体和病毒仓库,并引起宿主持续性感染[8,9]。有研究发现由单核细胞分化得到的巨噬细胞被HIV感染后,其免疫功能较正常细胞有变化,表现为部分细胞因子的分泌异常[10]。单核巨噬细胞系统介导的固有免疫和获得性免疫在宿主抗系统性或局部念珠菌感染中发挥核心作用[11]。它们一方面可以非特异性吞噬和杀灭真菌孢子,在抗真菌的固有免疫中发挥主导作用;另一方面可以分泌细胞因子诱导Th17和Th1活化,启动抗真菌感染的天然免疫。鉴于HIV感染不会引起巨噬细胞死亡,但是能影响其免疫功能。本实验我们进一步分析了HIV是否会影响巨噬细胞吞噬和杀灭白念珠菌的活性,从而干扰其在抗真菌感染免疫的效应阶段发挥作用。
真菌细胞壁富含甘露糖、β葡聚糖和几丁质等多糖成分。巨噬细胞表面的Dectin-1能够结合真菌细胞壁中的β-1, 3葡聚糖,从而介导巨噬细胞对真菌的识别、吞噬和杀灭作用[12]。我们首先分析了AIDS患者与健康者巨噬细胞吞噬和杀伤白念珠菌的活性。荧光显微镜清晰显示了巨噬细胞内吞噬的绿色荧光孢子。流式细胞仪进一步揭示AIDS患者巨噬细胞吞噬念珠菌孢子的能力较健康者下降。巨噬细胞对吞噬的真菌孢子有直接的杀伤作用。巨噬细胞与白念珠菌共培养后的CFU计数同样显示AIDS患者巨噬细胞杀伤真菌孢子能力降低。巨噬细胞吞噬真菌过程中,Dectin-1与β-1,3葡聚糖结合后氧消耗量增加,细胞膜上磷酸烟酰胺腺嘌呤二核苷酸(NADPH)氧化酶活化,产生一系列呼吸爆炸相关产物,如一氧化氮等,从而激活巨噬细胞的呼吸爆炸功能[13]。这些产物是巨噬细胞内杀灭被吞噬真菌的最主要物质,它的产量与杀灭真菌活性成正相关[14]。我们的研究发现,与健康者相比,AIDS患者巨噬细胞的呼吸爆炸相关产物一氧化氮合成减少,提示巨噬细胞杀灭白念珠菌活性降低与此相关。
巨噬细胞表面存在与天然免疫相关的模式识别受体Dectin-1,其胞内部分含有ITAM样模体。与Toll样受体配合,Dectin-1与真菌细胞壁中的β-1,3葡聚糖结合后,ITAM会被磷酸化[15],继而募集脾脏酪氨酸激酶(Syk)结合于其上[16]。同时Syk可以活化巨噬细胞的呼吸爆炸功能,杀灭被吞噬的真菌,其具体机制并不完全清楚[14]。本研究发现AIDS患者巨噬细胞与白念珠菌共培养时,Syk表达水平较健康者下降,提示AIDS患者巨噬细胞Syk活化缺陷,使得Syk依赖的信号传导途径功能障碍,从而导致巨噬细胞启动抗真菌的天然免疫功能以及其在适应性抗真菌免疫效应阶段吞噬杀灭活性受影响。HIV感染巨噬细胞引起Syk活化障碍的机制我们没有进一步分析。但是最近有研究显示HIV能够通过影响NF-κB通路,下调巨噬细胞酪氨酸激酶受体的表达和磷酸化[17],对我们的试验结果有一定提示意义。
本研究发现AIDS患者巨噬细胞对白念珠菌的吞噬、杀灭活性降低。该现象可能由Syk活化障碍引起巨噬细胞呼吸爆炸功能抑制导致。巨噬细胞抗真菌感染固有免疫和获得性免疫障碍将加重HIV感染导致宿主细胞免疫缺陷。这也提示我们在治疗HIV感染时,除了关注CD4+T细胞,巨噬细胞的功能和活性同样不可忽视[18]。
[1] Deng J, Mitsuki YY, Shen G, et al. HIV Envelope gp120 alters T cell receptor mobilization in the immunological synapse of uninfected CD4 T cells and augments T cell activation[J]. J Virol,2016,90(23):10513-10526.
[2] Ploquin MJ, Silvestri G, Müller-Trutwin M. Immune activation in HIV infection: what can the natural hosts of simian immunodeficiency virus teach us?[J]. Curr Opin HIV AIDS,2016,11(2):201-208.
[3] Ericsen AJ, Lauck M, Mohns MS, et al. Microbial translocation and inflammation occur in hyperacute immunodeficiency virus infection and compromise host control of virus replication[J]. PLoS Pathog,2016,12(12):e1006048.
[4] Liu F, Fan X, Auclair S, et al. Sequential dysfunction and progressive depletion of candida albicans-Specific CD4 T cell response in HIV-1 infection[J]. PLoS Pathog,2016,12(6):e1005663.
[5] Hassan J, Browne K, De Gascun C. HIV-1 in Monocytes and macrophages: An overlooked reservoir?[J]. Viral Immunol,2016,29(9):532-533.
[6] Aljawai Y, Richards MH, Seaton MS, et al. β-Catenin/TCF-4 signaling regulates susceptibility of macrophages and resistance of monocytes to HIV-1 productive infection[J]. Curr HIV Res,2014,12(3):164-173.
[7] Lee DH, Kim HW. Innate immunity induced by fungal β-glucans via dectin-1 signaling pathway[J]. Int J Med Mushrooms,2014,16(1):11-16.
[8] Smith PD, Meng G, Salazar-Gonzalez JF, et al. Macrophage HIV-1 infection and the gastrointestinal tract reservoir[J]. J Leukoc Biol,2003,74(5):642-649.
[9] Crowe SM. Macrophages and residual HIV infection[J]. Curr Opin HIV AIDS,2006,1(2):129-133.
[10] Galvão-Lima LJ, Espíndola MS, Soares LS, et al. Classical and alternative macrophages have impaired function during acute and chronic HIV-1 infection[J]. Braz J Infect Dis,2017,21(1):42-50.
[11] Liu YJ. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity[J]. Cell,2001,106(3):259-262.
[12] Kankkunen P, Teirilä L, Rintahaka J, el al. (1,3)-beta-glucans activate both dectin-1 and NLRP3 inflammasome in human macrophages[J]. J Immunol,2010,184(11):6335-6342.
[13] Lavigne LM, Albina JE, Reichner JS. Beta-glucan is a fungal determinant for adhesion-dependent human neutrophil functions[J]. J Immunol,2006,177(12):8667-8675.
[14] Bose N, Wurst LR, Chan AS, et al. Differential regulation of oxidative burst by distinct β-glucan-binding receptors and signaling pathways in human peripheral blood mononuclear cells[J]. Glycobiology,2014,24(4):379-391.
[15] Kimura Y, Chihara K, Honjoh C, et al. Dectin-1-mediated signaling leads to characteristic gene expressions and cytokine secretion via spleen tyrosine kinase (Syk) in rat mast cells[J]. J Biol Chem,2014,289(45):31565-31575.
[16] Cohen-Kedar S, Baram L, Elad H, et al. Human intestinal epithelial cells respond to β-glucans via dectin-1 and syk[J]. Eur J Immunol,2014,44(12):3729-3740.
[17] Feng T, Gan J, Qin A, et al. HIV-1 downregulates the expression and phosphorylation of receptor tyrosine kinase by targeting the NF-κB pathway[J]. Mol Med Rep,2016,14(3):1947-1952.
[18] Campbell JH, Hearps AC, Martin GE, et al. The importance of monocytes and macrophages in HIV pathogenesis, treatment, and cure[J]. AIDS,2014,28(15):2175-2187.
(收稿:2016-12-26 修回:2017-01-19)
2017年《中国麻风皮肤病杂志》征订、投稿启事
《中国麻风皮肤病杂志》是由中国科学技术协会主管、中国麻风防治协会和山东省皮肤病性病防治研究所主办的国家级学术期刊,为中国核心期刊及科技论文统计源期刊,是广大皮肤病、性病及麻风临床、防治、科研、教学工作者发表临床和研究报告的园地。本刊设有论著、短篇论著、综述、基层园地、中医中药、临床护理、病例报告、技术与方法、临床研究和人物等栏目。
邮局汇款:山东省济南市槐荫区经十路27397号,《中国麻风皮肤病杂志》编辑部收,邮编:250022
银行汇款:开户:《中国麻风皮肤病杂志》社 开户银行:交通银行济南经十路支行
银行帐号:371641004018010012978
投稿方式:请通过网上投稿系统投稿,网址:www.mfskin.net,请勿重复投稿。
本刊编辑部电话:0531-87515643,87298819 传真:0531-87515643
E-mail:skinmag@public.jn.sd.cn, mfskin@163.com
Phagocytosis and deactivation of macrophages toCandidaalbicansinin AIDS patients
CUIFan,RANGZhen,WANGYouwei,YANGGe.
InstituteofDermatology,SichuanAcademyofMedicalSciences&SichuanProvincialPeople'sHospital,Chengdu610031,ChinaCorrespondingauthor:CUIFan,E-mail:luckyfan2002@hotmail.com
Objective: To determine the phagocytosis and deactivation of macrophages toCandidaalbicansinin AIDS patients. Methods: The monocytes from AIDS patients and healthy controls were isolated, and then, were induced to macrophages in vitro. Phagocytosis and activity of macrophages toCandidaalbicanswas detected by fluorescence microscope and flow cytometry and eactivation activity was detected by CFU counting. The level of NO was assessed according to the content of nitrite inside macrophages. The level of phosphorylated spleen tyrosine kinase was measured by Western blot. Results: The phagocytosis and deactivation of macrophages toCandidaalbicansinand the levels of NO and phosphorylated spleen tyrosine kinase in AIDS patients were lower than those in healthy controls. Conclusion: The phagocytosis and deactivation of macrophages toCandidaalbicansinin AIDS patients were inhibited.
acquired immunodeficiency syndrome; human macrophages;Candidaalbicans; anti-fungal immunity
国家自然科学基金青年基金(编号:81101231) 四川省卫生和计划生育委员会科研课题(编号:150195)
四川省医学科学院&四川省人民医院,皮肤病性病研究所,四川成都,610031
崔凡,E-mail: luckyfan2002@hotmail.com
