非小细胞肺癌组织中USP22调控COX⁃2的研究
2017-04-21肖海波上海交通大学附属新华医院心胸外科上海200092
杨 健,肖海波 (上海交通大学附属新华医院心胸外科,上海200092)
·基础与转化医学·
非小细胞肺癌组织中USP22调控COX⁃2的研究
杨 健,肖海波 (上海交通大学附属新华医院心胸外科,上海200092)
组蛋白的泛素水解酶泛素特异性蛋白酶 22(USP22)是一种表观遗传修饰剂,在许多肿瘤中作为致癌基因而上调.USP22在非小细胞肺癌(NSCLC)中异常表达往往预示着患者生存率低下.人类USP22基因作为致癌基因,其调控底物研究较少,在癌症中作用机制尚不清楚.本研究发现环氧合酶⁃2(COX⁃2)作为USP22直接调控底物,其在细胞中的表达水平由USP22介导的去泛素化调控.USP22沉默下调COX⁃2表达水平,减少其半衰期,并通过泛素化状态的调控调节COX⁃2的稳定性与活力,从而抑制肺癌细胞增殖.结果表明USP22可能通过对COX⁃2的活性和稳定性的调节在癌症发生发展中起作用.
USP22;COX⁃2;NSCLC;去泛素化
0 引言
肺癌是癌症相关死亡的主要原因,世界上,每年有超过100万人死于肺癌[1],非小细胞肺癌(non⁃small cell lung cancer,NSCLC)约占肺癌的80%~90%[2].目前肺癌的治疗方法包括手术切除、铂类化疗、单一放疗或联合治疗.然而,肺癌治疗及预后较差,总的5年生存率约14%[3].尽管肺癌在诊断及治疗方面取得重大进展,但是其发病率和死亡率在世界范围内仍然不断上升[1].
USP22(ubiquitin⁃specific protease 22)是一种泛素水解酶,促进组蛋白H2A和H2B去泛素化,在转录调控中起重要作用[4].USP22与Myc的靶基因启动子区结合并启动这些基因转录,降低USP22表达将导致细胞停滞于G1期[5].USP22高表达与癌症远处转移和生存率低下有关[6],并且在 NSCLC、膀胱癌、宫颈癌等疾病中预示预后不良[4,7].USP22在肿瘤发生、进展中发挥重要作用,其表达对于预测恶性肿瘤的增殖、侵袭转移和对化疗药物的抵抗将会有很大作用,因此,它被认为是癌症的生物标记物与治疗靶点[8].
COX是花生四烯酸合成前列腺素(prostaglan⁃dins,PGs)和血栓素的关键酶,其存在两种不同亚型的同工酶,环氧合酶⁃1(cyclooxygenase⁃1,COX⁃1)和环氧合酶⁃2(cyclooxygenase⁃2,COX⁃2)[9].前列腺素E2(prostaglandinE2,PGE2)是主要的前列腺素类,通过G蛋白偶联受体发挥作用,与肿瘤生长、免疫抑制和血管生成等有关[10-11].COX⁃2在一些肿瘤中过度表达,并且在非小细胞肺癌中预示着生存率低下[12-13],其表达水平通过泛素/蛋白酶体途径所调控[14-16].然而,泛素介导的COX⁃2表达的具体机制尚不清楚.
本研究发现COX⁃2作为USP22直接调控底物,其在细胞中的表达水平由USP22介导的去泛素化所调控.结果表明USP22可能通过对COX⁃2的活性和稳定性的调节而在癌症发生发展中起作用.
1 材料和方法
1.1 目的质粒和蛋白质的制取pCMV6⁃XL5质粒载体上USP22基因的cDNA获自于OrigeneTechnolo⁃gies公司,以此为模板构建pcDNA3⁃USP22重组质粒.通过改变SiRNA序列每个密码子的第三个碱基,构建pcDNA3⁃USP22⁃R质粒,其抗USP22⁃SiRNA 1作用.使用QuikChange诱变试剂盒构建USP22基因的突变体USP22⁃C185A.pcDNA3载体上克隆有带Myc标签的COX⁃2、COX⁃1、USP1基因的C端及带有His标签的泛素的N端.
1.2 细胞培养人非小细胞肺癌细胞系A549和NCI⁃H460均保持在DMEM培养液中,培养液中添加10%的胎牛血清,1%谷氨酰胺和1%青霉素/链霉素.放在37℃,5%CO2培养箱中培养.
1.3 USPsiRNA文库筛选USP siRNA文库由Dharmacon公司提供,荧光染色siRNA作为对照组(序列为AACGUACGCGGAAUACUUCGA).A549细胞株在25 nM的siRNA终浓度下进行转染,持续3 d.
1.4 siRNA转染取3×105生长状态良好的A549和NCI⁃H460细胞培养于10 cm培养基上24 h.取50 μL的脂质体2000加入到1.5 mL的Opti⁃MEM,在室温下孵育5 min(溶液A).然后,取6 μL的siRNA加入1.5 mL的Opti⁃MEM(溶液B).将溶液A和溶液B混合并在室温下孵育20 min.然后在1 mL培养基中加入细胞与混合液,在37℃和5%CO2环境下孵育4 h.COX⁃2特异性siRNA由Origene提供.
1.5 USP22和USP1体外翻译USP22和USP1重组蛋白质生成,根据 Promega供应商的指示,使用TNT偶联转录/翻译系统.反应混合物中含有280 μL的兔网织红细胞裂解液、8 μL氨基酸混合物,16 μ LTNT反应缓冲液,8 μL T7聚合酶以及4 μg pcDNA3⁃USP22或pcDNA3⁃USP1.将混合物混合于400 μL培养基中,在30℃条件下孵育2 h.所获得的混合物进行免疫共沉淀处理.
1.6 COX⁃2体外泛素化使用Boston Biochem公司提供的泛素化试剂盒对含有His标签的COX重组体进行泛素化.泛素共轭体系由200 μg HeLa S⁃100,5 μM MG⁃132,4 μM泛素醛,600 μM泛素,和5 μL的能量再生溶液所组成.取1 μg His标记的COX⁃2与泛素共轭体系在37℃条件下进行培养,持续4 h.泛素化的COX⁃2根据制造商的指示用Ni⁃NTA树脂进行纯化.
1.7 免疫印迹对培养的细胞进行裂解,裂解缓冲液由20 μM缓冲液,pH7.5,150 μM NaCl,1%NP40,1 μM EDTA以及由罗氏公司提供的一种完整的蛋白酶抑制剂所组成.提取物在20 kHz条件下每5 s震荡3次,超声震荡处理的细胞在4℃、20 630 g条件下离心30 min,收集上清液.蛋白质浓度由Pierce生物技术公司提供的Pierce BCA蛋白浓度测定试剂盒进行测定.约30 μg蛋白用SDS⁃PADE电泳进行分离,转印到由Pierce生物技术公司提供的PVDF上.膜在室温下用5%脱脂奶粉进行封闭30 min,然后室温下孵育90 min.培养液中包含Novus生物有限公司提供的1∶500 COX⁃2抗体,Abcam公司提供的1∶500与USP22⁃C185A交叉反应性抗体(ab4812抗体),1∶500上游远端元素结合蛋白 1(far upstream element⁃binding protein 1,FBP1),1∶500 COX⁃1抗体,1∶1000 β⁃肌动蛋白以及 Proteintech公司提供1∶500 USP1抗体.用辣根过氧化物酶标记二抗并检测,使用增强的化学荧光系统进行信号检测(Santa Cruz生物公司提供sc⁃2408).
1.8 免疫沉淀反应在30 μL A/G琼脂糖凝胶蛋白质柱床体积上添加20 μg Myc抗体,30 μL USP22抗体,或者30 μL对照组抗体,置于200 μL磷酸盐缓冲液中(PBS),在室温下孵育60 min.凝胶用PBS洗涤3次,然后置于含0.5 mg细胞裂解液的RIPA缓冲液中,4℃孵育4 h.凝胶用RIPA缓冲液洗涤3次,悬浮于缓冲液中,然后进行免疫印迹分析.
1.9 PGE2酶免疫分析A549细胞加入12孔板,1.5×105/孔,分别加入1.5 nM控制组RNA与80 ng pcDNA3,1.5 nM USP22 SiRNA 1与80 ng pcDNA3,或者1.5 nM USP22 SiRNA 1与80 ng pcDNA3⁃COX⁃2,转染24 h.第二天重复转染,然后与1 μM的花生四烯酸(Sigma公司提供,货号10931)在DMEM液中37℃条件下培养15 min,ELISA法检测PGE2浓度.
1.10 细胞活性检测使用MTT法检测细胞活性.COX⁃2、USP22与对照组转染细胞接种到96孔板(1×103),并在100 μL培养基中培养72 h.然后每孔加入100 μL MTT试剂(碧云天,货号C0009),37℃下培养90 min.沉淀物用DMSO溶解,Thermo公司提供的iEMS微孔盘读取仪560 nm光谱分析.
1.11 数据分析使用SPSS19.0统计学软件进行数据分析,实验结果以±s表示,用多样本均数比较分析方差,P<0.05表示差异有统计学意义,Origin8.0计算分析COX⁃2的半衰期.
2 结果
2.1 USP22调节COX⁃2的表达COX⁃2是NSCLC生存状态的预测因子,其水平受泛素蛋白酶体系统调控.本试验中,USP siRNA转染A549和NCI⁃H460细胞,转染后72 h检测PGE2的浓度.由于USPs能够下调COX⁃2表达,作为NSCLC致癌基因和生存不良预测因子的 USP22,研究 COX⁃2与 USP22的关系.为验证siRNA的效果,四种USP22 siRNA和pcDNA3⁃USP22转染A549和NCI⁃H460细胞,对细胞裂解液进行免疫印迹分析.与 control siRNA相比,4种USP22 siRNA沉默USP22表达(图1A、D),然后检查 USP22沉默对 COX⁃2表达及 USP22底物FBP1[17]水平的影响.研究表明与 control siRNA相比,USP22沉默下调A549和NCI⁃H460细胞中COX⁃2和FBP1水平(图1B、E).为检测USP22对COX⁃2的特异性,用USP22 siRNA与编码耐USP22(USP22R)siRNA的质粒共转染A549细胞,免疫印迹分析结果表明,USP22R恢复USP22水平,USP22 siRNA下调COX⁃2表达(图1C、B).通过对A549细胞进行control siRNA和USP22 siRNA转染72 h,检测USP22基因沉默对COX⁃2稳定性的影响.免疫印迹分析显示USP22 siRNA显著降低COX⁃2在A549细胞中的半衰期,从2.50±0.57 h降至1.18±0.34 h(图1G、H,P<0.05).USP22异常表达上调COX⁃2水平,然而无催化活性的c185a USP22突变体表达无影响,证实USP22调节A549细胞中COX⁃2的稳定性(图1I).
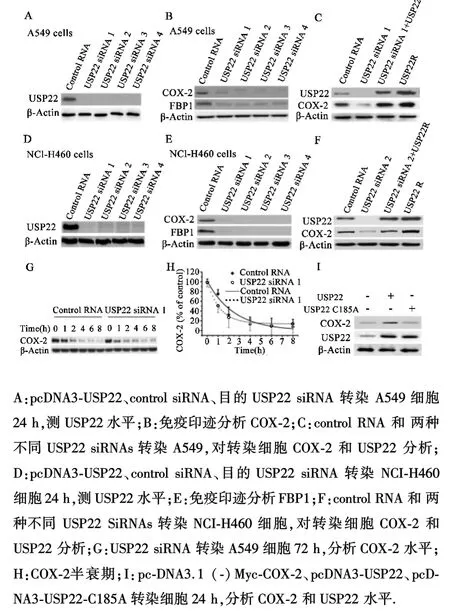
图1 USP22沉默对COX⁃2表达的影响
2.2 COX⁃2是USP22底物为检测USP22和COX⁃2之间潜在的相互作用,用表达USP22和Myc标记的COX⁃2载体对A549和NCI⁃H460细胞进行转染,细胞裂解液用抗Myc抗体和对照IgG抗体进行免疫沉淀.结果表明USP22与COX⁃2免疫共沉淀(图2A、D).细胞裂解液用抗⁃USP22抗体进行免疫沉淀,得到相似结果(图2B、E).为证实USP22与COX⁃2之间的直接作用,将重组USP22与His标记的COX⁃2或者 COX⁃1孵育,蛋白用亲和层析法进行分离.USP22与COX⁃2同步降低,但与COX⁃1变化不一致,表明USP22与COX⁃2之间直接作用(图2C).为检测COX⁃2是USP22底物,全长度His标记的COX⁃2泛素化与USP22或无催化活性的USP22 c185a突变体进行孵育,免疫印迹结果表明与USP22共孵育导致COX⁃2去泛素化,USP22 c185a突变体未出现去泛素化(图2F).为证实USP22对COX⁃2去泛素化特异性,使用一种去泛素化酶,USP1作为对照进行泛素化实验.含USP22组泛素化的COX⁃2水平降低,而在USP1或USP22 c185a组泛素化COX⁃2增加(图2G).另外,对细胞裂解液进行COX⁃2泛素化分析以及使用抗泛素抗体都得到相似结果(图2G、H).综上所述,结果表明 COX⁃2是 USP22底物,其稳定性受USP22介导的去泛素化调控.

图2 USP22与COX⁃2相互关系
2.3 USP22调节COX⁃2的活性和稳定性及其对细胞增殖的影响为进一步研究 USP22通过调节COX⁃2如何发挥其在肿瘤发生中的作用,本研究通过siRNA下调A549细胞中USP22和COX⁃2表达,观察其细胞活力.USP22 siRNA处理的细胞中,异常表达的COX⁃2可以恢复细胞内COX⁃2水平(图3A).用MTT法检测细胞活性,结果表明USP22和COX⁃2表达下调明显降低细胞的活力,分别为63%和47%,过度表达的COX⁃2能够恢复USP22 siRNA以及过表达COX⁃2质粒处理细胞的活力(图 3B).实验证明USP22通过COX⁃2水平的调节影响细胞活力.为明确USP22对COX⁃2的作用,研究了细胞中炎症因子PGE2水平.沉默USP22或COX⁃2明显减少PGE2的生成,然而过表达COX⁃2可以恢复被USP22抑制的PGE2水平.这表明USP22调节COX⁃2的表达和活性(图3C).
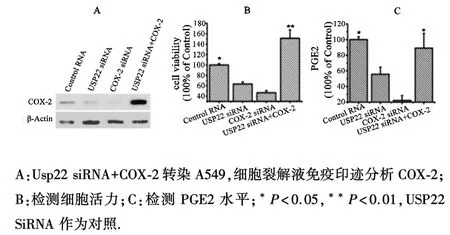
图3 沉默USP22抑制细胞增殖,COX⁃2增加PGE2水平
3 讨论
真核细胞中,蛋白质水平需要严格调控以保持平衡.泛素蛋白酶体系统是体内蛋白质清除机制之一,在体内发挥诸多作用,如阻止与癌症发生有关的分子信号通路传导[18].去泛素化酶(Deubiquitinating enzymes,DUBs)催化蛋白质去泛素化,然后分解为半胱氨酸蛋白酶和金属蛋白酶.USPs是一个家族成员最多、结构差异最大的去泛素化酶亚家族,至今被认识研究超过60多种[19].USPS包含三个保守的氨基酸残基,Cys、His和推测的第三个保守氨基酸残基Asp或Asn组成催化三联体,它们是由四面体瞬间结构形成的氧离子洞中间的水分子桥来稳定的.DUBs参与许多生物学过程,他们在人类恶性肿瘤中的作用研究较少[20].一些DUBs抑制剂已被研究,可望成为潜在抗癌剂.然而,由于USP抑制剂缺乏特异性,并且针对不同的USPs,特异性底物的识别对发展有效的靶向药物是必不可少,因此其研究应用受到限制[19].
USP22与各种恶性肿瘤,包括NSCLC的发生发展有关,然而,其在癌症中的作用机制仍不清楚.本试验中,发现COX⁃2作为USP22底物,USP22通过调节COX⁃2的活性和稳定性发挥其在肿瘤发生发展中的作用.
在本研究中,沉默USP22下调COX⁃2水平,并降低肺癌细胞A549半衰期.USP22通过泛素化状态调节COX⁃2稳定性和活性.COX⁃2表达的调节作为一种潜在的癌症治疗策略.
实验报道[12],长期使用针对COX酶的非甾体类抗炎药,可以减少肺癌的发病率,据此,COX⁃2表达的调节可以作为一种潜在的癌症治疗策略.选择性COX⁃2抑制剂塞来昔布已被批准用于治疗家族性腺瘤性息肉病.有学者[21]建议塞来昔布可以作为NSCLC化疗辅助用药.然而,COX⁃2表达上调以及PGE2增加具体作用仍不清楚,COX⁃2表达上调刺激细胞生长,但也导致细胞周期阻滞,PGE2在一些肿瘤中抑制细胞生长,但也通过激活EGFR增加细胞活力促进生长[22].COX⁃2是一种膜结合蛋白,存在于内质网(endoplasmic reticulum,ER)中,通过ER相关的降解系统,将COX⁃2从内质网转运到细胞质,然后被UPS调控降解[23].COP9信号转导体调控COX⁃2稳定性,其为一种调控蛋白质稳定性的多亚基复合物,影响其泛素化过程[24].通过泛素化过程对COX⁃2水平的调节以及COX⁃2和PGE2信号通路在肺癌患者中的重要性已被证实.研究结果表明USP22与COX⁃2水平存在相关关系,然而 USP22上调和COX⁃2在NSCLC之间的相互关系还需进一步研究.
USP22底物的识别在理解USP22在肿瘤发生发展的作用机制尤其重要,USP22去除组蛋白H2A和H2B泛素部分,并调节 c⁃myc基因的表达[5,25].USP22所介导的泛素化修饰组蛋白H2B过程,可以激活JAK⁃STAT诱导基因,这可能是USP22在癌症患者中潜在作用机制之一[26].FBP1为 USP22底物,USP22介导的FBP1去泛素化调节其对靶位点的募集和基因调控表达,这提示USP22可能通过转录调节发挥其在肿瘤中的间接作用[17].USP22与MDMX之间相互作用导致 p53依赖的细胞凋亡[27].尽管USP22致癌作用已有相关文献报道,其在一些恶性肿瘤也表达上调,但是USP22底物识别是有限的,其作用机制尚待阐明.目前研究显示,USP22介导的COX⁃2去泛素化调控细胞中COX⁃2和PGE2表达水平,其对肺癌细胞活力的影响提示潜在的致癌机理.USP22沉默对细胞增殖、侵袭和转移的影响,以及明确COX⁃2和PGE2轴在USP22所参与的肿瘤中起的作用,还需进一步研究.
[1]Reck M,Popat S,Reinmuth N,et al.Metastatic non⁃small⁃cell lung cancer(NSCLC):ESMO clinical practice guidelines for diagnosis,treatment and follow⁃up[J].Ann Oncol,2014,25(Suppl 3):27-39.
[2]Sun W,Yuan X,Tian Y,et al.Non⁃invasive approaches to monitorEGFR⁃TKI treatment in non⁃small⁃cell lung cancer[J].J Hematol Oncol,2015,8:95.
[3]Kanthala S,Pallerla S,Jois S.Current and future targeted therapies for non⁃small⁃cell lung cancers with aberrant EGF receptors[J].Future Oncol,2015,11(5):865-878.
[4]Ning J,Zhang J,Liu W,et al.Overexpression of ubiquitinspecific protease 22 predicts poor survival in patients with early⁃stage nons⁃mall cell lung cancer[J].Eur J Histochem,2012,56:e46.
[5]Zhang XY,Varthi M,Sykes SM,et al.The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell⁃cycle progression[J].Mol Cell,2008,29(1):102-111.
[6]Melo⁃Cardenas J,Zhang Y,Zhang DD,et al.Ubiquitin⁃specific peptidase 22 functions and its involvement in disease[J].Oncotarget,2016,7(28):44848-44856.
[7]Wang H,Li YP,Chen JH,et al.Prognostic significance of USP22 as an oncogene in papillary thyroid carcinoma[J].Tumour Biol,2013,34(3):1635-1639.
[8]Yang M,Liu YD,Wang YY,et al.Ubiquitin⁃specific protease 22:a novel molecular biomarker in cervical cancer prognosis and thera⁃peutics[J].Tumour Biol,2014,35(2):929-934.
[9]Luo W,Liu B,Zhou Y.The endothelial cyclooxygenase pathway:Insights from mouse arteries[J].Eur J Pharmacol,2016,780:148-158.
[10]Liu R,Xu KP,Tan GS.Cyclooxygenase⁃2 inhibitors in lung cancer treatment:Bench to bed[J].Eur J Pharmacol,2015,769:127-133.
[11]Greenhough A,Smartt HJM,Moore AE,et al.The COX⁃2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J].Carcinogenesis,2009,30(3):377-386.
[12]Zhou YY,Hu ZG,Zeng FJ,et al.Clinical profile of cyclooxygenase⁃2 inhibitors in treating non⁃small cell lung cancer:a meta⁃analysis of nine randomized clinical trials[J].PLoS One,2016,11(3):e0151939.
[13]Yokouchi H,Kanazawa K.Revisiting the role of COX⁃2 inhibitor for non⁃small cell lung cancer[J].Transl Lung Cancer Res,2015,4(5):660-664.
[14]Rockwell P,Yuan H,Magnusson R,et al.Proteasome inhibition in neuronal cells induces a proinflammatory response manifested by upregulation of cyclooxygenase⁃2,its accumulation as ubiquitin con⁃jugates,and production of the prostaglandin PGE(2)[J].Arch Bio⁃chem Biophys,2000,374(2):325-333.
[15]Dixon DA,Blanco FF,Bruno A,et al.Mechanistic aspects of COX⁃2 expression in colorectal neoplasia[J].Recent Results Cancer Res,2013,191:7-37.
[16]Voorhees PM,Dees EC,O'neil B,et al.The proteasome as a target for cancer therapy[J].Clin Cancer Res,2003,9(17):6316-6325.
[17]Atanassov BS,Dent SY.USP22 regulates cell proliferation by deubiquitinating the transcriptional regulator FBP1[J].EMBO Rep,2011,12(9):924-930.
[18]Liu J,Shaik S,Dai X,et al.Targeting the ubiquitin pathway for cancer treatment[J].Biochim Biophys Acta,2015,1855(1):50-60.
[19]Colland F.The therapeutic potential of deubiquitinating enzyme inhibitors[J].Biochem Soc Trans,2010,38(Pt 1):137-143.
[20]Fang Y,Fu D,Shen XZ.The potential role of ubiquitin c⁃terminal hydrolases in oncogenesis[J].Biochim Biophys Acta,2010,1806(1):1-6.
[21]Zhang H,Li Z,Wang K.Combining sorafenib with celecoxib syner⁃gistically inhibits tumor growth of non⁃small cell lung cancer cells in vitro and in vivo[J].Oncol Rep,2014,31(4):1954-1960.
[22]Lin YM,Kuo WW,Velmurugan BK,et al.Helioxanthin suppresses the cross talk of COX⁃2/PGE2 and EGFR/ERK pathway to inhibit Arecoline⁃induced Oral Cancer Cell(T28)proliferation and blocks tumor growth in xenografted nude mice[J].Environ Toxicol,2016,31(12):2045-2056.
[23]Mbonye UR,Wada M,Rieke CJ,et al.The 19⁃amino acid cassette of cyclooxygenase⁃2 mediates entry of the protein into the endoplas⁃mic reticulum⁃associated degradation system[J].J Biol Chem,2006,281(47):35770-35778.
[24]Neuss H,Huang X,Hetfeld BK,et al.The ubiquitin⁃and protea⁃some⁃dependent degradation of COX⁃2 is regulated by the COP9 signalosome and differentially influenced by coxibs[J].J Mol Med,2007,85(9):961-970.
[25]Zhao Y,Lang G,Ito S,et al.A TFTC/STAGA module mediates histone H2A and H2B deubiquitination,coactivates nuclear recep⁃tors,and counteracts heterochromatin silencing[J].Mol Cell,2008,29(1):92-101.
[26]Chipumuro E,Henriksen MA.The ubiquitin hydrolase USP22 contributes to 3'⁃end processing of JAK⁃STAT⁃inducible genes[J].FASEB J,2012,26(2):842-854.
[27]Ding F,Bao C,Tian Y,et al.USP22 promotes NSCLC tumorigenesis via MDMX up⁃regulation and subsequent p53 inhibition[J].Int J Mol Sci,2014,16(1):307-320.
USP22 regulation of cyclooxygenase⁃2 in non⁃small cell lung cancer
YANG Jian,XIAO Hai⁃Bo
Department of Cardiothrocic Surgery,Xinhua Hospital,Shanghai Jiaotong University,Shanghai 200092,China
Ubiquitin⁃specific protease 22(USP22)is an epige⁃netic modifier that is upregulated in many cancers as an oncogene.Abnormal expression of USP22 in non⁃small cell lung cancer(NSCLC)often indicates a poor survival rate.USP22 gene,as an oncogene,has little research on its regulatory substrate and its mechanism in cancer is unclear.In the study,we found that cyclooxygenase⁃2(COX⁃2)as a substrate for direct regulation of USP22,its expression in cells regulated by USP22 mediated ubiquitination.USP22 silencing down regulate the expression of COX⁃2,reduce its half⁃life,and regulate the stability and activity of COX⁃2 through the regulation of ubiquitination,thereby inhibi⁃ting the proliferation of lung cancer cells.The findings of this study suggest that USP22 may play a role in the development of cancer by regulating the activity and stability of COX⁃2.
USP22;COX⁃2;NSCLC;Deubiquitination
R734.2
A
2095⁃6894(2017)02⁃16⁃05
2016-12-21;接受日期:2017-01-05
国家自然科学基金(81572248)
杨 健.E⁃mail:15800551893@163.com
肖海波.副主任医师,副教授.E⁃mail:xnavor@163.com
