肿瘤细胞微环境对胶质瘤血管生成拟态形成的影响
2017-04-15凌耿强马东营何瑞星王悦娜叶伟
凌耿强,马东营,何瑞星,王悦娜,叶伟
肿瘤细胞微环境对胶质瘤血管生成拟态形成的影响
凌耿强,马东营,何瑞星,王悦娜,叶伟
目的探讨肿瘤细胞微环境改变对胶质瘤血管生成拟态(VM)形成的影响。
胶质瘤; 血管生成拟态; 肿瘤细胞微环境; 缺氧; 抗血管生成治疗
脑胶质瘤是颅内最常见的恶性肿瘤之一,其血供丰富,应用抗血管生成治疗对控制胶质瘤生长效果明显[1]。但是,近年发现胶质瘤对抗血管生成药物具有抗药性,其机制可能与血管生成拟态(vasculogenic mimicry,VM)相关[2]。VM 是一种不依赖于内皮细胞而形成的供血管道,已经被发现存在于多种恶性肿瘤中[3],并且有研究提示 VM 与胶质瘤患者的预后相关[4]。因此,VM 可能是胶质瘤治疗的新靶点之一[5]。
既往认为,VM 形成与否跟肿瘤细胞自身特性有关,不形成 VM 的肿瘤细胞对周围基质环境进行重塑的能力很弱,即使添加了一些与形成管道相关的细胞因子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、血小板源生长因子(platelet-derived growth factor,PDGF)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,也无法产生管道样结构[2]。最近有研究显示,原本无法形成 VM 的低度恶性肿瘤细胞在某些环境中(如大于 2% 的缺氧环境)也可以形成 VM 结构[6-7]。因此我们推测肿瘤细胞所处的微环境才是其能否形成 VM 的决定因素。微环境的改变与细胞外基质中 VM 相关的细胞因子(VEGF、bFGF、TGF-β、PDGF、TNF-α)浓度变化以及基质金属蛋白酶(MMP-2、MMP-9)活性水平相关。在本课题中,我们拟采用多种改变微环境的方法诱导低恶性度胶质瘤细胞 SHG44 形成VM 结构,并通过检测微环境中多种细胞因子的浓度变化和基质金属蛋白酶的活性水平探讨其可能机制。
1 材料与方法
1.1 材料
人脑胶质瘤细胞系 U251 购自上海博士德生物工程有限公司;人脑胶质瘤细胞系 SHG44 购自赛百慷(上海)生物技术股份有限公司;10% 胎牛血清、胰蛋白酶购自美国 Hyclone 公司;高糖DMEM 培养基购自美国 Gibco 公司;Matrigel 购自美国 Becton Dickson 公司;CoCl2购自美国Sigma 公司;VEGF、TGF-β、bFGF、PDGF、TNF-α酶联免疫吸附试验(ELISA)试剂盒购自上海史瑞可生物科技有限公司。
1.2 方法
1.2.1 常规细胞培养 所有的培养基中均添加100 U/ml 的青霉素和 100 μg/ml 的链霉素,临用前再添加 10% 胎牛血清,细胞置于 37 ℃、5% CO2的培养箱中,每 2~3 天传代一次。
1.2.2 细胞的三维培养及管道计数实验 参照 El Hallani 等[8]的方法并加以改进,把 200 μl Matrigel胶于 4 ℃ 过夜融化,并加入预冷的 24 孔板中,置于 37 ℃ 培养箱中 30 min 固化,细胞消化离心后重悬,不加血清,接种于 24 孔板中,每孔接种5×104个,37 ℃ 培养 24 h 后用倒置显微镜于×200 随机选取上、下、左、右、中 5 个视野,每个视野的管道总长度取平均值进行组间比较。
1.2.3 诱导 SHG44 细胞形成 VM
1.2.3.1 缺氧环境诱导 采用张熙等[7]的方法,将无血清培养的 SHG44 细胞种入预铺 Matrigel 的孔板后,每孔加入 CoCl2100 mmol/L。37 ℃ 培养24 h,观察各组 SHG44 细胞 VM 的形成情况。
1.2.3.2 U251 上清诱导 将 U251 进行无血清培养约 24 h,收集其上清并离心。将 U251 上清混合 SHG44 细胞后,均匀接种至预铺 Matrigel的孔板上,37 ℃ 培养 24 h 后观察。
1.2.3.3 接种过 U251 的 Matrigel 诱导 参照Seftor 等[9]的方法并加以改进,先将 U251 细胞种入预铺 Matrigel 的孔板中,置于 37 ℃ 培养箱中培养 24 h 后,U251 细胞形成 VM。依次用 20 mmol/L的 NH4OH、蒸馏水、PBS、常规培养基冲洗并浸泡 1 h,将 U251 细胞完全除去。然后将无血清培养的 SHG44 细胞接种至上述孔板中,37 ℃ 培养24 h 后观察。
1.2.4 ELISA 检测细胞因子浓度 各组细胞种到Matrigel 上 24 h 后,上层培养基离心取上清,按照试剂盒说明书进行 VEGF、TGF-β、bFGF、PDGF、TNF-α 的 ELISA 检测。每组设 2 个复孔。
1.2.5 明胶酶谱检测 MMP-2、MMP-9 活性水平 取对数生长期细胞至无血清培养基中培养24 h,收集上清离心,进行 SDS-PAGE 电泳,洗脱、漂洗后孵育,然后染色及脱色,显示 MMP-2(72 kD)和 MMP-9(92 kD)为位于蓝色背景上的透亮带,用凝胶图像分析系统分析读取条带光密度值(OD),记录数据。实验重复 2 次。
1.3 统计学处理
2 结果
2.1 用不同的方法诱导 SHG44 细胞形成 VM 并比较组间管道长度差异
三维培养时,SHG44 细胞并不形成 VM。部分细胞呈球形并聚集成大小不等的细胞集落,部分细胞呈梭形散在分布。管道计数实验(图 1)可见缺氧组形成 VM 的能力最强为(2479.67 ± 286.09)μm,U251 上清组次之为(2166.73 ± 171.80)μm,接种过 U251 的 Matrigel 组能力最弱为(1406.00 ± 155.37)μm。
2.2 ELISA 检测
不同处理组的 SHG44 细胞培养上清中VEGF、TGF-β、bFGF、PDGF、TNF-α 的浓度采用 ELISA 测定。结果显示,对照组、缺氧组、U251上清组、预处理 Matrigel 组的 VEGF 浓度分别为(115.40 ± 8.99)、(362.19 ± 25.69)、(306.02 ± 11.30)、(261.90 ± 18.57)pg/ml,TGF-β 浓度分别为(1309.87 ± 32.69)、(5699.63 ± 38.67)、(5311.67 ± 34.20)、(5036.37 ± 22.30)pg/ml,bFGF 浓度分别为(785.07 ± 18.16)、(4214.26 ± 188.70)、(4068.63 ± 164.82)、(4172.73 ± 145.66)pg/ml,PDGF 浓度分别为(49.44 ± 5.12)、(157.83 ± 1.67)、(124.19 ± 0.85)、(92.03 ± 5.59)pg/ml,TNF-α 浓度分别为(3.26 ± 0.16)、(8.27 ± 0.25)、(8.04 ± 0.16)、(7.89 ± 0.43)pg/ml。各实验组 VEGF、TGF-β、bFGF、PDGF、TNF-α 浓度与未处理组相比均有显著升高(P < 0.05),但缺氧组、U251 上清组、预处理Matrigel 组有明确递减趋势的因子为 VEGF、TGF-β、PDGF,并且经过 Spearman 相关分析发现VEGF、TGF-β、PDGF 与 VM 形成能力具有相关性(P < 0.05),而 bFGF(P=0.893)和 TNF-α(P=0.258)与 VM 形成无明显相关性。
2.3 明胶酶谱检测
明胶酶谱检测结果(图 2)显示,缺氧组MMP-2 和 MMP-9 活性均显著高于对照组(P <0.05)。U251 上清组的 MMP-2 与对照组相比显著增高(P < 0.05),但较缺氧组下降(P < 0.05),而MMP-9(P=0.855)与对照组无显著差异。U251 预处理的 Matrigel 组的 MMP-2(P=0.669)及MMP-9(P=0.068)与对照组均无显著差异。Spearman 相关分析显示,MMP-2 与 VM 形成能力相关性显著(P < 0.05),而 MMP-9 无相关性(P=0.195)。

图1 不同方法诱导 SHG44 细胞形成 VM 及管道形成实验(A:各组细胞三维培养形态;B:实验组组间比较柱状图;*P< 0.05)Figure 1 SHG44 VM formation was induced by different methods and tube formation assays (A:Three dimentional culture of each group of cells; B:Histogram between experimental groups;*P < 0.05)
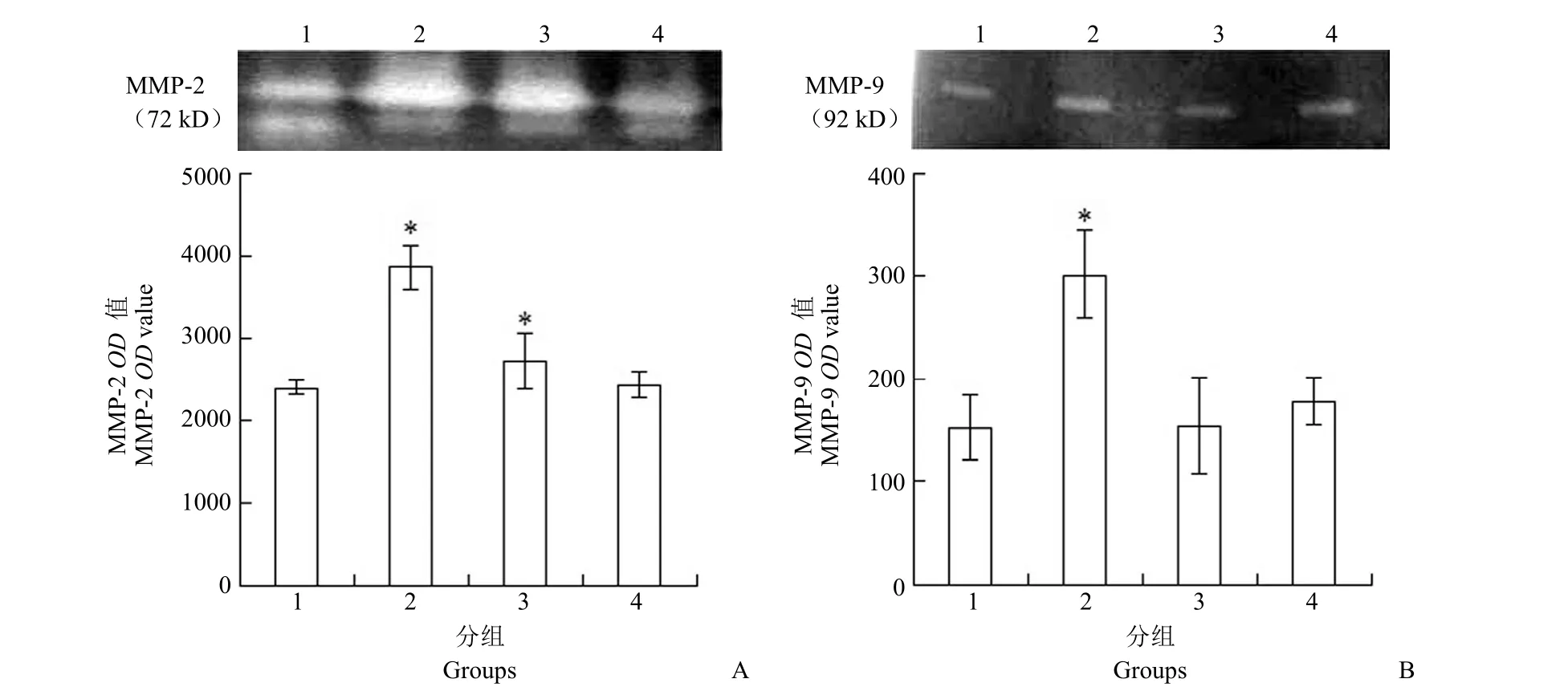
图2 MMP-2(A)及 MMP-9(B)活性测定(与对照组相比,P < 0.05)Figure 2 Activity of MMP-2 (A) and MMP-9 (B) in each group (*P < 0.05 compared with control group)
3 讨论
肿瘤微环境指肿瘤在生长过程中,肿瘤细胞及细胞外间质相互作用形成的特殊环境[10]。有研究指出,肿瘤细胞在缺氧环境下其增殖、侵袭及迁移的能力明显增加[11-12]。VM 往往出现在高侵袭性及高恶性度的肿瘤中,一些研究已经表明缺氧的微环境可以诱导肿瘤细胞形成 VM。U251 细胞做为一种VM 阳性细胞已为许多研究证实[13-14]。U251 细胞系来源于人脑胶质母细胞瘤 IV 级,生长迅速,恶性度高,因此容易形成一个相对缺氧的微环境。本次实验中,我们用 U251 上清及 U251 预处理Matrigel 等多种方法均成功诱导 SHG44 细胞形成 VM。同时,我们根据张熙等[7]的报道在 SHG44培养基中加入 CoCl2,制造化学缺氧环境,也成功诱导其形成 VM。这表明能否形成 VM 可能与肿瘤细胞自身的性质关系并不大,肿瘤所处的微环境才是 VM 形成的关键因素。在一定的条件下,肿瘤细胞会根据微环境改变自身的形态及行为。
另外,我们还检测了 SHG44 肿瘤细胞在形成VM 过程中 VEGF、bFGF、TGF-β、PDGF及 TNF-α的表达变化。这些因子已证实在内皮细胞依赖的血管形成的过程中起着重要作用。据报道,这些因子在具有不同 VM 形成能力的细胞中表达量也有明显差异,与细胞形成 VM 的能力相关[15]。本实验结果显示,以上因子在各处理组的表达量与对照组相比均有明显增高,但尤其以 VEGF、TGF-β 和PDGF 这三种因子与 VM 形成能力具有相关性。同时,我们通过明胶酶谱检测还发现,应用 CoCl2制造缺氧环境时,MMP-2 和 MMP-9 的活性明显增高,表明 MMP-2 和 MMP-9 是微环境改变的重要指标。但是,仅 MMP-2 活性与 VM 形成能力具有相关性,表明 MMP-2 及 MMP-9 可能是VM 形成的充分条件之一而非必要条件。由此我们推测,缺氧微环境中 VEGF、TGF-β 和 PDGF 三因子浓度及 MMP-2 活性在诱导低恶性度肿瘤细胞形成 VM 的过程中起重要作用,但其机制目前尚不完全清楚,需要进一步探索。结合既往文献,我们推测缺氧诱导因子(HIF)可能是微环境中诱导 VM 形成的关键因素[16]。
根据本实验的结果,我们认为在治疗肿瘤时一旦采取仅仅针对血管内皮细胞的血管抑制治疗,由于血供减少,肿瘤细胞必然会处于缺氧环境。但是,肿瘤细胞为了满足自身的营养需要,就可能形成VM,重新向肿瘤细胞提供营养。这不但不能杀死肿瘤,还会导致肿瘤侵袭性和恶性度增加,导致病程急剧进展[17]。因此,进一步了解肿瘤细胞所处的微环境对肿瘤细胞供血的改变有助于我们更好地应用抗血管生成疗法,并且提示我们通过改变肿瘤细胞的缺氧微环境才能在早期彻底切断肿瘤供血,达到抑制肿瘤生长甚至“饿死”肿瘤的效果。
[1]Nandhu MS,Hu B,Cole SE,et al.Novel paracrine modulation of Notch-DLL4 signaling by fibulin-3 promotes angiogenesis in high-grade gliomas.Cancer Res,2014,74(19):5435-5448.
[2]Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry.Am J Pathol,1999,155(3):739-752.
[3]Paulis YW,Soetekouw PM,Verheul HM,et al.Signalling pathways in vasculogenic mimicry.Biochim Biophys Acta,2010,1806(1):18-28.
[4]Wang SY,Ke YQ,Lu GH,et al.Vasculogenic mimicry is a prognostic factor for postoperative survival in patients with glioblastoma.J Neurooncol,2013,112(3):339-345.
[5]Yue WY,Chen ZP.New treatment target for glioma.Bull Chin Cancer,2006,15(3):155-157.(in Chinese)岳伟英,陈忠平.胶质瘤治疗的新靶点.中国肿瘤,2006,15(3):155-157.
[6]Liu WB,Xu GL,Jia WD,et al.Hypoxia promotes vasculogenic mimicry formation in hepatocellular carcinoma.World Chin J Digestology,2010,18(31):3294-3300.(in Chinese)刘文斌,许戈良,荚卫东,等.缺氧对肝癌血管生成拟态的影响及其机制.世界华人消化杂志,2010,18(31):3294-3300.
[7]Zhang X,Guo SW,Wei CY.Formation and mechanism of vasculogenic mimicry induced by hypoxia in human astrocytoma SHG44cells.Chin J Neurosurge Dis Res,2011,10(3):218-221.(in Chinese)张熙,郭世文,尉春艳.缺氧诱导 SHG44细胞拟态血管形成及相关机制.中华神经外科疾病研究杂志,2011,10(3):218-221.
[8]El Hallani S,Boisselier B,Peglion F,et al.A new alternative mechanism in glioblastoma vascularization:tubular vasculogenic mimicry.Brain,2010,133(Pt 4):973-982.
[9]Seftor EA,Meltzer PS,Kirschmann DA,et al.The epigenetic reprogramming of poorly aggressive melanoma cells by a metastatic microenvironment.J Cell Mol Med,2006,10(1):174-196.
[10]Gao M,Wu JM,Lu Y.Micro-environment and malignant transformation of tumor.Carcinogenesis Teratogenesis Mutagenesis,2008,20(5):412-414,417.(in Chinese)郜明,吴家明,陆茵.肿瘤微环境与肿瘤的恶变.癌变·畸变·突变,2008,20(5):412-414,417.
[11]Postovit LM,Seftor EA,Seftor RE,et al.Influence of the microenvironment on melanoma cell fate determination and phenotype.Cancer Res,2006,66(16):7833-7836.
[12]Brahimi-Horn MC,Chiche J,Pouysségur J.Hypoxia and cancer.J Mol Med,2007,85(12):1301-1307.
[13]Ling G,Wang S,Song Z,et al.Transforming growth factor-β is required for vasculogenic mimicry formation in glioma cell line U251MG.Cancer Biol Ther,2011,12(11):978-988.
[14]Wu N,Zhao X,Liu M,et al.Role of microRNA-26b in glioma development and its mediated regulation on EphA2.PLoS One,2011,6(1):e16264.
[15]Chen Y,Jing Z,Luo C,et al.Vasculogenic mimicry-potential target for glioblastoma therapy:an in vitro and in vivo study.Med Oncol,2012,29(1):324-331.
[16]Li S,Meng W,Guan Z,et al.The hypoxia-related signaling pathways of vasculogenic mimicry in tumor treatment.Biomed Pharmacother,2016,80:127-135.
[17]Qu B,Guo L,Ma J,et al.Antiangiogenesis therapy might have the unintended effect of promoting tumor metastasis by increasing an alternative circulatory system.Med Hypotheses,2010,74(2):360-361.
Influence of tumor microenvironment on vasculogenic mimicry formation in glioma
LING Geng-qiang,MA Dong-ying,HE Rui-xing,WANG Yue-na,YE Wei
ObjectiveTo study the influence of tumor microenvironment on vasculogenic mimicry (VM) formation in glioma.MethodsWe induced VM formation in glioma cell line SHG44 by three ways,including creating a chemical hypoxic environment,adding U251 cell culture supernatant and preteating Matrigel with U251.Then,we detected the expression of VEGF,TGF-β,bFGF,PDGF and TNF-α in the supernatant of each culture.The MMP activities were also tested.ResultsVM network formed by SHG44 was successfully induced in all the groups.The capability of VM formation was different among the three groups,with the best result seen in the hypoxic group.In the other two groups,the group with U251 supernatant was better than the Matrigel pretreatment by U251 group.Expression of VEGF,TGF-β and PDGF in each group were correlated with capability of VM formation.MMP-2 activity was also correlated with capability of VM formation.ConclusionVM formed by glioma cells might be induced by multi-factor in the hypoxic tumor microenvironment.Expression of VEGF,TGF-β,PDGF and MMP-2 were correlated with VM formation in glioma.
Glioma; Vasculogenic mimicry; Tumor microenvironment; Hypoxia; Antiangiogenic therapy
LING Geng-qiang,Email:lgq1013@sina.com
黑龙江省教育厅科学技术研究项目(12541412)
150081 哈尔滨医科大学附属第二医院神经外科
凌耿强,Email:lgq1013@sina.com
2016-12-03
10.3969/j.issn.1673-713X.2017.02.006
方法通过制造化学缺氧环境、添加 U251 上清和用 U251细胞预处理 Matrigel 等 3 种方法诱导胶质瘤细胞 SHG44形成 VM,并检测上述几种培养基上清中的血管内皮生长因子(VEGF)、转化生长因子-β(TGF-β)、成纤维细胞生长因子(bFGF)、血小板源生长因子(PDGF)及肿瘤坏死因子-α(TNF-α)的表达与对照组 SHG44 细胞的差异,同时比较组间基质金属蛋白酶(MMP)活性水平。
结果几种方法均能诱导 SHG44 细胞形成 VM 结构,其中缺氧组 VM 形成能力最强,添加 U251 上清组次之,U251 细胞预处理 Matrigel 组最弱,且几个处理组上清中的 VEGF、TGF-β 和 PDGF 浓度与各组 VM 形成能力相关,MMP-2 活性也与 VM 形成能力相关。
结论胶质瘤 VM 形成很可能是微环境改变后多种因素作用的结果,其中 VEGF、TGF-β、PDGF、MMP-2 与 VM形成关系具有相关性。
Author Affiliation:Department of Neurosurgery,Second Affiliated Hospital of Harbin Medical University,Harbin 150081,China
