一种长期培养人神经干细胞的新方法
2017-04-15陈世明章瑾宣丹英毛钟鸣陈鹏翾
陈世明,章瑾,宣丹英,毛钟鸣,陈鹏翾
一种长期培养人神经干细胞的新方法
陈世明,章瑾,宣丹英,毛钟鸣,陈鹏翾
神经干细胞(neural stem cells,NSCs)具有自我更新能力和多向分化潜能。神经干细胞的移植对治疗神经系统的损伤和神经退行性疾病都有直接或间接的作用[1-3],临床研究和应用对神经干细胞的需求日益迫切。但由于技术原因,神经干细胞在体外的培养存在易分化和易死亡的技术难题。目前,神经干细胞的获取途径主要是从多个胚胎或流产胎儿中分离并进行有限的培养扩增,但胚胎或胎儿源的贫乏及各胚胎或流产胎儿之间的差异性使得神经干细胞来源混杂,无法达到标准化,成为神经干细胞临床化的重要限制因素。本实验从流产胎儿中分离出神经干细胞,并在体外长期规模化培养、扩增,为神经干细胞的研究提供稳定的、用之不竭的细胞来源,为临床神经干细胞移植奠定基础。
1 材料和方法
1.1 材料
DMEM/F12(1∶1)培养基购自美国 Hyclone 公司;重组人表皮细胞生长因子(rhEGF)、重组人碱性成纤维细胞生长因子(rhbFGF)、B27 添加剂、N2 Supplement、TP-EDTA均购自美国 Gibco 公司;肝素钠和胰酶抑制剂购自美国Sigma 公司;庆大霉素购自上海现代哈森(商丘)药业有限公司;其他实验材料有巢蛋白、多聚赖氨酸、维生素 E、腐胺、亚硒酸钠、人转铁蛋白、黄体酮、L-谷氨酰胺、维生素 C 葡萄糖苷。
1.2 方法
1.2.1 培养基配制 取 1000 ml DMEM/F-2(1∶1)培养基,加入 5.9 g 4-羟乙基哌嗪乙磺酸(HEPES)搅拌均匀,制成基础培养液,使溶液 pH 值控制在 7.0~7.1,分别加入 200 μg 肝素钠、30 μg 维生素 E、25 mg 重组人胰岛素、1.6 mg 腐胺、6 μg 亚硒酸钠、5.5 mg 人转铁蛋白、7 μg 黄体酮、300 mg L-谷氨酰胺、20 μg rhEGF、20 μg rhbFGF、50 mg 维生素 C 葡萄糖苷、40 000 IU 庆大霉素,混匀。
1.2.2 神经干细胞的分离 取孕 16周的人流胎儿脑组织,在无菌条件下分离出海马组织,D-Hank’s液清洗,眼科剪剪成小组织块,加入 0.25% 的 TP-EDTA 消化 10 min,胰酶抑制剂终止其消化。用 100 目不锈钢细胞过滤筛过滤,去除大组织块,离心收集沉淀细胞。将沉淀细胞重悬于神经干细胞培养基,制成单细胞悬液。
1.2.3 神经干细胞原代培养 经过细胞计数后以(1~2)×106/ml 接种到 T75 细胞培养瓶中。将细胞培养瓶置于5% CO2、37 ℃ 培养箱中进行培养。每天观察细胞生长状态,3~4 d 半量更换神经干细胞培养基一次。
1.2.4 神经干细胞传代培养 神经干细胞在培养基中连续培养 20~30 d,神经干细胞球直径为 500~1000 μm 时,把含有干细胞球的培养基用 200 ml 注射器吸出,经干细胞球切割器(不锈钢筛网)切割,将每个大的神经干细胞球切割成 3~8 小块(直径 30~200 μm),将小块干细胞球放入新的培养瓶中,并加入一半新配置的培养液,按 1∶2 或者 1∶4 比例分瓶传代培养。按这种方法可以连续扩增培养人神经干细胞 2 年以上。
1.2.5 神经干细胞球的鉴定 取连续培养 30 个月的神经干细胞球悬液滴于经多聚赖氨酸包被的盖玻片上,置 37 ℃培养箱中培养 24 h,使细胞黏附于载玻片上。室温下 4% 多聚甲醛和 0.3% 戊二醛固定 15 min。DPBS 缓冲液漂洗3 次后,用含 5% 正常山羊血清的 DPBS(含 0.1% TritonX-100)在 37 ℃ 温育 30 min 进行封闭。吸去封闭液,加抗人巢蛋白单克隆抗体,37 ℃ 温育 3 h 后,用含 0.1% TritonX-100 的 DPBS 漂洗 3 次,各 10 min。加偶联Rodamine 的第二抗体,37 ℃ 温育 45 min。吸去第二抗体反应液,用 DPBS 漂洗 3 次,用封片液封片,荧光显微镜下观察结果并记录照相。
1.2.6 神经球细胞爬片的制备和分化鉴定 取培养 30 个月的神经干细胞球,直接吹打或用 0.25% TP-EDTA 溶液消化制成单细胞悬液。细胞计数后以 5×104/片密度种于经100 mg/ml 多聚赖氨酸包被的玻璃盖玻片上,在 DMEM/F12培养基中添加 2% 胎牛血清,B27 添加剂(1∶50 稀释),撤除生长因子(EGF、bFGF)进行分化培养。8 d 后进行免疫荧光细胞化学染色。荧光显微镜下观察并记录照相。
2 结果
2.1 原代活细胞形态学观察
初分离的单细胞在倒置显微镜下观察,大多为单个圆形亮球状,没有细胞突起,折光性好。培养 2~3 d 后,形成多个细胞组成的细胞团,形状不规则,大小不一。10 d 以后,可见数十甚至上百个细胞组成的细胞球,形态成圆形或者椭圆形(图 1A),且数量越来越多,体积越来越大。100 倍镜下放大观察,可见细胞团周边细胞较亮,中间区域细胞密度高,透光性差(图 1B)。
2.2 细胞切割传代前后形态学观察
连续培养 15~20 d 后,神经干细胞球为 500~1000 μm(图 2),传代时,本实验采用自制的干细胞球切割器,将大的神经干细胞球切割成大小不一的 3~8 小块(图 2A1 ~A4)。将小块干细胞球放入新的培养瓶中培养 5~7 d 后,小细胞团块呈不规则形状(图 2B1~B4)。继续培养至 15 d左右,细胞团块逐渐增大,成为圆形或者椭圆形的神经球(图 2C1~C4)。
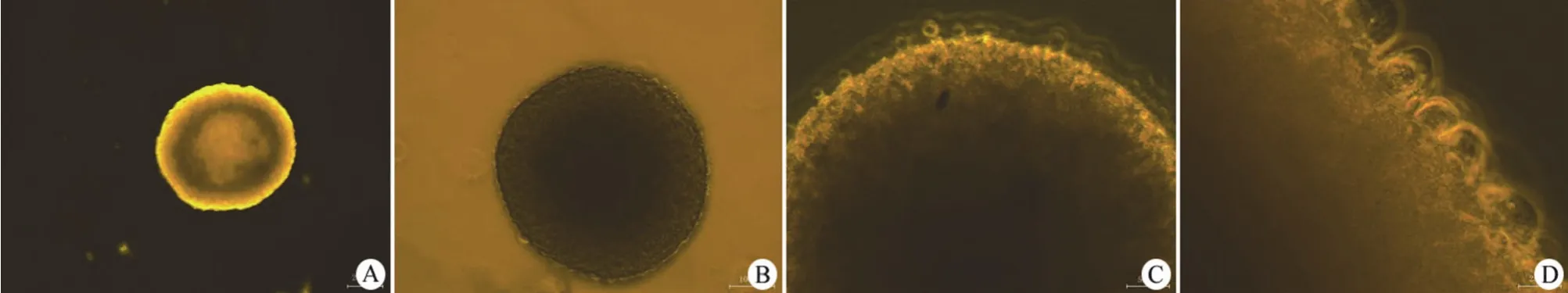
图1 倒置显微镜下观察人神经干细胞球(A:×40;B:×100;C:×200;D:×400)
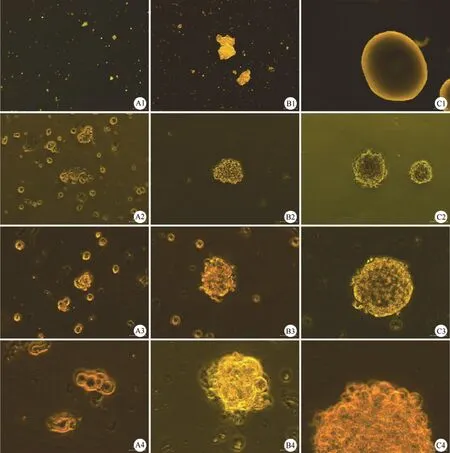
图2 切割传代后神经干细胞体外培养不同时期的形态变化[A1:切割后 1 d 细胞团块(×40);A2:切割后 1 d 细胞团块(×100);A3:切割后 1 d 细胞团块(×200);A4:切割后 1 d 细胞团块(×400);B1:切割后 7 d 细胞团块(×40);B2:切割后 7 d 细胞团块(×100);B3:切割后 7 d 细胞团块(×200);B4:切割后 7 d 细胞团块(×400);C1:切割后15 d 细胞团块(×40);C2:切割后 15 d 细胞团块(×100);C3:切割后 15 d 细胞团块(×200);C4:切割后 15 d 细胞团块(×400)]
2.3 神经干细胞的免疫荧光染色鉴定
经 24 个月培养的神经干细胞黏附于盖玻片上。经巢蛋白免疫荧光染色后,均呈阳性表达(图 3)。
2.4 神经干细胞分化为神经元细胞的免疫荧光鉴定
诱导分化第 8 天进行 β 微管蛋白染色,结果呈阳性(图 4)。
2.5 神经干细胞分化为星型胶质细胞的免疫荧光鉴定
培养 30 个月的人神经干细胞经诱导分化后第 8 天进行 GFAP 染色,结果呈阳性(图 5)。
2.6 神经干细胞分化为少突胶质细胞的免疫荧光鉴定
培养 30 个月的人神经干细胞经诱导分化后第 8 天进行 O4 染色,结果均呈阳性(图 6)。

图3 神经干细胞巢蛋白免疫荧光染色[A:12 个月(×100);B:24 个月(×100);C:30 个月(×100);D:30 个月(×400)]
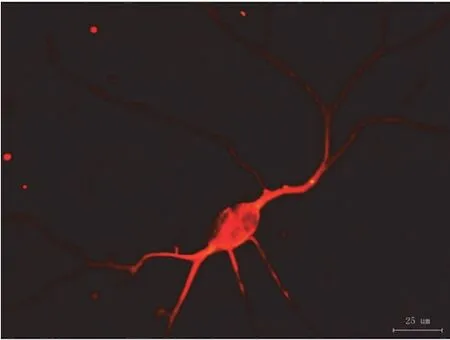
图4 诱导分化 8 d 后形成的神经元结构的免疫荧光染色鉴定(×400)
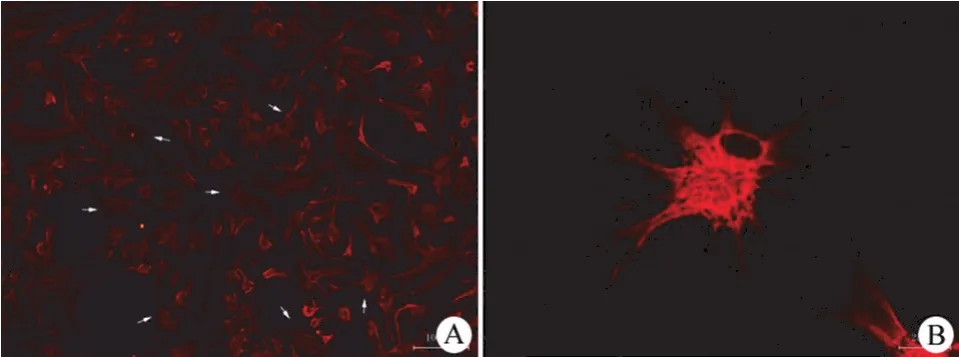
图5 诱导分化 8 d 后形成的星型胶质细胞(箭头所示)的免疫荧光染色鉴定(A:×100;B:×400)

图6 诱导分化 8 d 后形成的少突胶质细胞(箭头所示)的免疫荧光染色鉴定(A:×100;B:×400)
3 讨论
神经干细胞的研究和应用是以成功的神经干细胞体外培养为基础的,获得高纯度、高产量的神经干细胞是其临床工程化的关键[4]。传统的贴壁培养法[5]利用多聚赖氨酸等分子进行瓶底包被,使神经干细胞在瓶底进行扩增培养。但在培养过程中,因外界微环境的不稳定,贴壁的神经干细胞会趋向分化,无法长期稳定培养。传统悬浮培养法[6]中,神经球在其增大过程中会导致营养物质、抑制分化因子和代谢废物无法顺利传输,导致中心神经细胞坏死或分化,故通过将大的神经球分离成小神经球以促使其继续生长,达到扩增的目的。在分离大神经球时,传统方法采用胰酶消化或机械吹打,易造成细胞损伤或分离不彻底[7]。本实验中,采用自制干细胞球切割器分离细胞球,既能够避免胰酶消化带来的损伤,也能使分离的小细胞球大小更为一致,尤其对神经干细胞的临床工程化具有重大作用。
与传统培养基相比,本实验培养基中添加了肝素、庆大霉素、维生素 E、维生素 C 葡萄糖苷、亚硒酸钠和黄体酮等成分,在调节干细胞生长增殖和抑制其分化方面,发挥重要作用[8-9]。肝素能与许多生长因子结合形成稳定复合物,既可保持生长因子的活性,防止其因外界微环境的变化而失活或降解[10-11],同时也可减缓生长因子的释放,促进细胞增殖[12]。维生素 E 对神经元损伤有保护作用,除了通过抗氧化机制发挥作用外,还可以通过调节相关酶活性机制及调控相关基因表达发挥作用。维生素 C 葡萄糖苷是维生素 C的衍生物,不但能有效保护维生素 C 的活性,还拥有更好的溶解性、耐热性和稳定性。维生素 C 和维生素 E 配合使用,能产生更好的抗氧化效果,更有效地保护细胞中的DNA、蛋白质、膜脂质不被自由基损伤[13]。胰岛素能促进细胞摄取葡萄糖和氨基酸,从而促进细胞分裂、生长。腐胺能够刺激和诱导神经干细胞生长和增殖。亚硒酸钠能促进和参与神经干细胞代谢。人转铁蛋白可结合铁离子,使神经干细胞合理利用铁离子,并减少其对细胞的毒性,从而维持细胞正常状态。黄体酮具有促进神经干细胞生长和调节作用。HEPES 可维持细胞液中酸碱平衡。本实验中,通过对培养、传代方法的改进和对培养基配方的调整,使人神经干细胞能够在体外长期培养扩增,并保持增殖和分化能力。
巢蛋白是一种中间丝类型的蛋白,在神经干细胞早期阶段,由神经上皮干细胞表达[14-15],随着神经前体细胞向神经元和胶质细胞分化而终止表达。本实验中,对分离、培养后的细胞在体外进行巢蛋白免疫组织化学染色,其结果均为神经干细胞,且在体外分离、传代培养后,仍具有增殖能力。神经干细胞具有分化为神经元细胞、星型胶质细胞、少突胶质细胞的能力[16]。β 微管蛋白是神经元细胞的结构蛋白,是神经干细胞分化过程中神经元的特有标志物。GFAP 是一种单独存在的 III 型中间丝蛋白,在活化的星型胶质细胞中大量特异性表达。O4 是神经干细胞分化为少突胶质细胞过程中的一种特定标记物。本实验中,人神经干细胞经分化后,特异性检测均表达阳性,且分化后细胞形态与正常神经元细胞和星型胶质细胞无明显差异。β 微管蛋白 III 阳性说明所鉴定的细胞已分化为神经元,GFAP 阳性说明所鉴定的细胞已分化为星型胶质细胞,O4 阳性说明所鉴定的细胞已分化为少突胶质细胞。该结果表明,神经干细胞具有分化为神经元细胞和星型胶质细胞的能力。在该研究中,神经干细胞的培养时间较其他研究更长,但分化能力并未减弱,从侧面反应出该培养方法能够良好地维持神经干细胞的稳定性。
神经干细胞的体外长期连续培养技术是神经干细胞研究及应用的重要基础。神经干细胞培养法的优化,有利于获得大量的标准一致的高质量神经干细胞,为进一步应用于神经系统的损伤修复和神经退行性疾病的治疗打下基础。
[1]Lee JM,Bae JS,Jin HK.Intracerebellar transplantation of neural stem cells into mice with neurodegeneration improves neuronal networks with functional synaptic transmission.J Vet Med Sci,2010,72(8):999-1009.
[2]Sharma R,McMillan CR,Niles LP.Neural stem cell transplantation and melatonin treatment in a 6-hydroxydopamine model of Parkinson’s disease.J Pineal Res,2007,43(3):245-254.
[3]Bantubungi K,Blum D,Cuvelier L,et al.Stem cell factor and mesenchymal and neural stem cell transplantation in a rat model of Huntington’s disease.Mol Cell Neurosci,2008,37(3):454-470.
[4]Reubinoff BE,Itsykson P,Turetsky T,et al.Neural progenitors from human embryonic stem cells.Nat Biotechnol,2001,19(12):1134-1140.
[5]Ehtesham M,Kabos P,Kabosova A,et al.The use of interleukin 12-secreting neural stem cells for the treatment of intracranial glioma.Cancer Res,2002,62(20):5657-5663.
[6]Reynolds BA,Weiss S.Clonal and population analyses demonstrate that all EGF-responsive mammal jan embryonic CNS precursor is a stem cell.Dev Biol,1996,175(1):1-13.
[7]Chen SM.Reproductive and developmental toxicity experiments// Zhang JT.Modern pharmacology experimental methods (part 2),Beijing:Beijing medical university and Pecking Union Medical College Joint Press,1998:1932-1979.(in Chinese)陈世明.生殖和发育毒性实验//张均田.现代药理学实验方法(下册).北京:北京医科大学、中国协和医科大学联合出版社,1998:1932-1979.
[8]Chen SM.Application of cell biology in pharmacology//Du GH.Experimental pharmacology.Beijing:Pecking Union Medical College Press,2004:88-117.(in Chinese)陈世明.细胞生物学方法在药理学中的应用//杜冠华.实验药理学.北京:中国协和医科大学出版社,2004:88-117.
[9]Chen SM,Zhang JT.Establishment of isolation and long-term culture of human embryonic brain neural stem cell (NSC) and discovery of a natural product (NP1) with the effects of promoting NSE cell proliferation//XIVth world congress of pharmacology-the new century of pharmacology.San Francisco,CA:American Society for Pharmacology and Experimetal Therapetutics,2002:A128.
[10]Noti C,Seeberger PH.Chemical approaches to define the structure-activity relationship of heparin-like glycosaminoglycans.Chem Biol,2005,12(7):731-756.
[11]Yoon JJ,Chung HJ,Park TG.Photo-crosslinkable and biodegradable pluronic/heparin hydrogels for local and sustained delivery of angiogenic growth factor.J Biomed Mater Res A,2007,83(3):597-605.
[12]Ezaki Y,Nishihara E,Shibata Y,et al.Vitamin E prevents the neuronal cell death by repressing cyclooxygenase-2 activity.Neuroreport,2005,16(11):1163-1167.
[13]Mellodew K,Suhr R,Uwanogho DA,et al.Nestin expression is lost in a neural stem cell line through a mechanism involving the proteasome and Notch signaling.Brain Res Dev Brain Res,2004,151(1-2):13-23.
[14]Zheng ZH.Isolation,culture and identification of neural stem cells// Stem cell principle,technique and clinical.Zhao CH.Beijing:Chemical Industry Press,2006:402-421.(in Chinese)郑志竑.神经干细胞分离、培养与鉴定//赵春华.干细胞原理、技术与临床.北京:化学工业出版社,2006:402-421.
[15]Chen SM.Neural stem cells//Zhang JT,Zhang QZ.Techniques and methods of neural pharmacology.Beijing:People's Medical Publishing House,2005:156-160.(in Chinese)陈世明.神经干细胞//张均田,张庆柱.神经药理学研究技术与方法.北京:人民卫生出版社,2005:156-160.
[16]Mckay R.Stem cells in the central nervous system.Science,1997,276 (5309):66-71.
310018 杭州,浙江奥瑞健生物技术有限公司
陈世明,Email:1279050771@qq.com
2016-12-30
10.3969/j.issn.1673-713X.2017.02.017
