黄芩苷抗丙型肝炎病毒的活性研究
2017-04-15李健蕊陈金花李虎董飚马雪梅彭宗根
李健蕊,陈金花,李虎,董飚,马雪梅,彭宗根
黄芩苷抗丙型肝炎病毒的活性研究
李健蕊,陈金花,李虎,董飚,马雪梅,彭宗根
目的研究黄芩苷抗丙型肝炎病毒(HCV)的活性。
肝炎病毒属; 黄芩苷; 蛋白酶抑制药; 药物协同作用
丙型肝炎病毒(hepatitis C virus,HCV)属于黄病毒科丙型肝炎病毒属[1],是引起病毒性肝炎的主要病原体之一,呈全球性流行。近年来,国外多个靶向 HCV 复制酶的直接抗病毒药物(DAA)已经相继进入临床应用,大幅度地提高了患者的治愈率[2],但由于 HCV RNA 聚合酶没有校正功能,HCV 快速复制易导致耐药突变,使治疗无效或反弹[3-5],因此研发新的抗 HCV 药物刻不容缓。我们在寻找抗 HCV 药物的过程中,发现天然产物黄芩苷(baicalin)具有抗 HCV 蛋白酶的活性。黄芩苷具有广泛的药理作用,除抗炎、抗癌、抗氧化及解热作用外,还具有抗呼吸道合胞病毒、新城疫病毒、流感病毒、登革热病毒、人类免疫缺陷病毒、乙型肝炎病毒等病毒的作用[6-11],但未见黄芩苷有抗HCV 活性的报道。本文利用本实验室建立的一系列抗 HCV 药物研发模型分析了黄芩苷的抗 HCV活性。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 人肝细胞系 Huh7.5 细胞为美国 Vertex 制药公司惠赠;感染性 HCV 病毒株为 J6/JFH-1/JC,本实验室将含有重组全长 HCV cDNA 的 pFL-J6/JFH/JC1 质粒(美国 Vertex 制药公司惠赠)经 Xba I 酶切纯化,得到 HCV cDNA,经 T7 转录试剂盒体外转录得到 HCV RNA,转染正常 Huh7.5 细胞,收集上清获得具有感染性的病毒液[12]。感染性 HCV 突变株 A156T、D168V 和S282T 为 J6/JFH-1/JC 的定点突变株,按照野生型方法制备具有感染性的 HCV 突变病毒。
1.1.2 药物、抗体及底物 黄芩苷和黄芩素(baicalein)购自中国食品药品检定研究院;特拉匹韦(telaprevir)、西咪匹韦(simeprevir)和索非布韦(sofosbuvir)三种原料药物均购自MedChemExpress 公司。小鼠抗 β-actin 单克隆抗体购自北京中杉金桥生物技术公司;HCV Core 蛋白单克隆抗体(抗体号 ab2740)、HCV NS3 蛋白单克隆抗体(抗体号 ab13830)购自英国 Abcam 公司。抗小鼠 IgG HRP-linked 购自美国 Cell Signaling公司;HCV Protease 底物 FRET Substrate(RET S1)购自美国 AnaSpec 公司;HCV Helicase 底物(Cy5 top strand:5'-/CY5/CCTACGCCACCAGCTCCGTA GG/BHQ/-3' 和 HairpinCy5 bottom strand:5' CCTA CGGAGCTGGTGGCGTAGG(T)203')由生工生物工程(上海)股份有限公司合成。
1.1.3 主要试剂 DMEM、胎牛血清、Penicillin-Streptomycin 双抗、PBS 和 0.05%-EDTA胰酶均购自美国 Gibco 公司;实时荧光定量试剂盒 AgPath-ID one-step RT-PCR kit 购自美国Invitrogen 公司;CytoBusterTM细胞蛋白提取液购自美国 Novagen 公司;30% 丙烯酰胺溶液购自美国 Bio-Red 公司;PVDF 膜和辣根过氧化物酶(HRP)化学发光底物购自美国 Millipore 公司;1.5 mol/L Tris-Cl(pH 8.8)和 1 mol/L Tris-Cl(pH6.8)购自北京普利莱基因技术有限公司。
1.2 方法
1.2.1 化合物抑制 HCV-NS3/4A 蛋白酶活性的测定 采用荧光共振能量转移(FRET)法[13],以特拉匹韦作为阳性对照药,检测化合物抑制 HCV NS3/4A 蛋白酶活性,并用 Reed-Muench 法计算化合物抑制蛋白酶活性的半数抑制浓度(IC50)。
1.2.2 化合物抑制解旋酶活性的测定 应用FRET 法检测 HCV NS3 解旋酶活性[14]。96 孔荧光酶标反应板中反应体积为 200 μl,缓冲液 pH值为 7.0,底物终浓度为 5 nmol/L,酶终浓度为5 μg/ml,ATP 的终浓度为 2.5 mmol/L。在 22 ℃开始反应,荧光检测仪测定反应前后的荧光信号(ex=620,em=665),计算化合物对解旋酶的抑制率。抑制率(%)=(酶对照荧光强度 – 加药荧光强度)/(酶对照荧光强度 – 空白对照荧光强度)×100%。
1.2.3 化合物对细胞的毒性试验 用 MTT 染色法检测化合物对细胞的毒性[15]。Huh7.5 细胞以 3×104个/cm2的密度种入 96 孔板培养。药物处理细胞 72 h 后,每孔加入 10 μl 浓度为 5 μg/ml 的MTT 溶液,4 h 后,每孔加 100 μl DMSO,室温振荡孵育 10 min,测定 570 nm 处的吸光值。用Reed-Muench 法计算化合物的半数细胞毒性浓度(CC50)。
1.2.4 化合物在细胞培养内抗 HCV 活性的检测 Huh7.5 细胞以 3×104个/cm2的密度接种到6 或 96 孔板中。培养 24 h 后,感染野生型或A156T、D168V 和 S282T 耐药突变 HCV,用45 IU/细胞的病毒感染量,同时加药物处理。培养72 h后,用 RNeasy mini kit 提取细胞总 RNA,用细胞蛋白提取液提取细胞总蛋白。细胞内 HCV RNA 水平用 qRT-PCR 法检测[16]。细胞内 HCV Core 及 NS3 蛋白的表达水平用 Western blot 检测[17]。结果中蛋白条带信号密度值用 Gelpro 32 软件扫描分析,并以对照组中目的蛋白/内参蛋白的比值为 1.00 作标准化处理。
1.2.5 黄芩苷与已知抗 HCV 药物联用抗 HCV作用 Huh7.5 细胞以 3×104个/cm2的密度接种到 6 孔板中。24 h 后分别给予单剂量的黄芩苷、索非布韦、西咪匹韦、黄芩苷与索非布韦联用或黄芩苷与西咪匹韦联用,并同时用 HCV 病毒上清液感染 Huh7.5 细胞。感染 72 h 后提取总蛋白,用Western blot 法检测 HCV Core 蛋白。用金正均 q值法[18]判断药物联用后的作用性质。q=Ea+b /(Ea+Eb–Ea×Eb),Ea 为 A 药单独给药时药效,Eb为 B 药单独给药时药效,Ea+b 为两药联用时药效,q=1为相加作用,q > 1为协同作用,q < 1为拮抗作用。
1.3 统计学处理
2 结果
2.1 黄芩苷抑制 HCV NS3/4A 蛋白酶的活性
FRET 法测定结果(图 1)显示,黄芩苷在无细胞培养系统中抑制 HCV NS3/4A 蛋白酶的IC50值为(74.43 ± 1.16)μmol/L,阳性药特拉匹韦抑制 HCV NS3/4A 蛋白酶的 IC50值为(0.13 ± 0.13)μmol/L。黄芩素是黄芩苷的苷元,其对 HCV NS3/4A 蛋白酶也具有抑制作用[IC50值为(24.13 ± 3.75)μmol/L]。
2.2 黄芩苷对 HCV NS3 解旋酶无抑制活性
FRET 法分析黄芩苷对 HCV NS3 解旋酶的抑制作用显示,黄芩苷对 HCV NS3 解旋酶没有抑制活性(表 1)。
2.3 黄芩苷在细胞培养内具有抗 HCV 感染活性
由于黄芩苷在体外无细胞反应系统中有特异性抑制 HCV NS3/4A 蛋白酶的活性,本实验进一步分析其在 Huh7.5 细胞培养内抗野生型 HCV感染的活性。结果见图 2A,黄芩苷对 Huh7.5 细胞的 CC50为(781.667 ± 144.140)μmol/L,EC50为(31.306 ± 9.559)μmol/L,并呈明显的剂量依赖关系,选择指数(SI)为 25。阳性药特拉匹韦也具有较强的抗 HCV 作用(图 2B)。随后,我们在蛋白水平上对黄芩苷的抗 HCV 活性进行了验证。结果如图 3 所示,黄芩苷给药处理 72 h 后,细胞内HCV Core 和 NS3 蛋白均显著降低,且随给药浓度增加其抑制活性增强,说明黄芩苷确有抗 HCV的作用。

图1 化合物抑制 HCV NS3/4A 蛋白酶活性(A:黄芩素;B:黄芩苷;C:阳性对照特拉匹韦)Figure 1 Compounds inhibited HCV NS3/4A serine protease activity detected with FRET assay (A:Baicalein; B:Baicalin; C:Positive compound telaprevir)

表1 黄芩苷对 HCV NS3 解旋酶的抑制活性Table 1 Baicalin did not inhibit HCV NS3 helicase activity detected with FRET
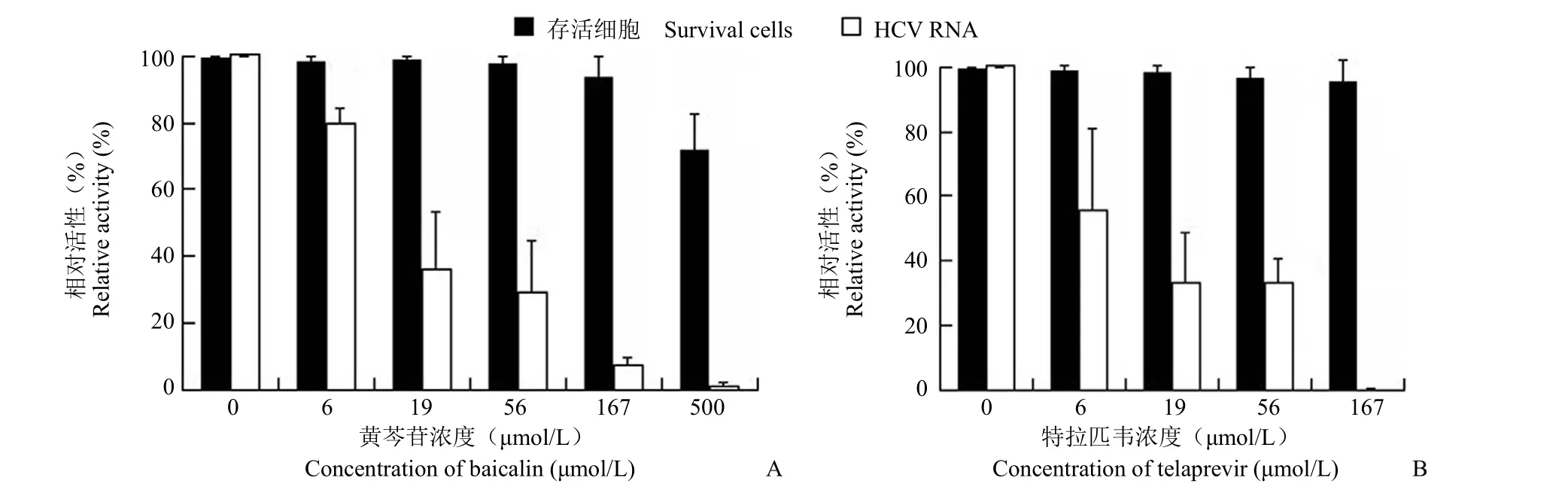
图2 黄芩苷(A)和特拉匹韦(B)在 Huh7.5 细胞内抗 HCV 感染的活性Figure 2 Baicalin (A) and telaprevir (B) inhibited HCV replication at RNA level in Huh7.5 cells with no cytotoxicity
2.4 黄芩苷在细胞培养内对 HCV 耐药突变株的抑制活性
D168V 和 A156T 是临床上报道最多的针对NS3/4A 蛋白酶抑制剂的耐药突变株,分别对西咪匹韦和特拉匹韦耐药,S282T 突变则是针对多聚酶抑制剂索非布韦的耐药突变株[19]。为分析黄芩苷在细胞培养内对 HCV 耐药突变株的抑制活性,分别用野生型(WT)HCV 和耐药突变型 HCV 感染Huh7.5 细胞,同时用阳性药和黄芩苷处理细胞72 h 后,结果见表 2。
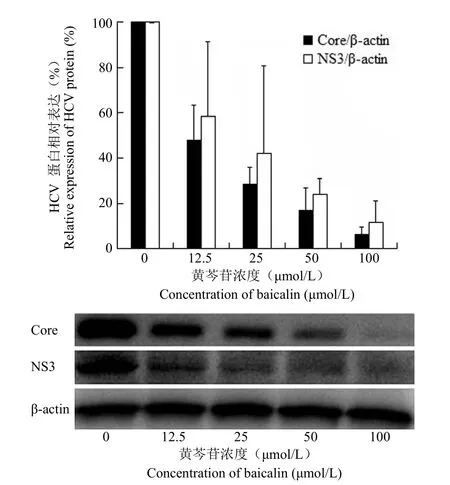
图3 黄芩苷在 Huh7.5 细胞内抗 HCV 感染的活性Figure 3 Baicalin inhibited HCV replication at protein level in Huh7.5 cells
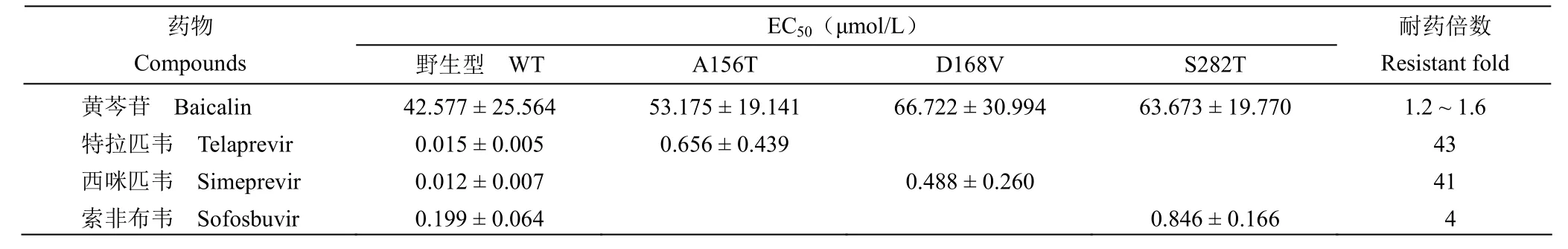
表2 药物在 Huh7.5 细胞培养内对野生型和突变型 HCV 的抑制作用Table 2 Compounds inhibited HCV replication against WT and mutant type HCV in Huh7.5 cells
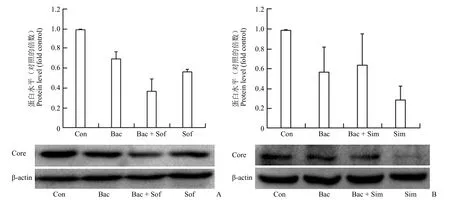
图4 黄芩苷在 Huh7.5 细胞培养内与索非布韦(A)或西咪匹韦(B)联合抗 HCV 的作用(Con:溶剂对照组;Bac:25 μmol/L 黄芩苷;Sof:0.05 μmol/L 索非布韦;Sim:0.01 μmol/L 西咪匹韦)Figure 4 Baicalin inhibited HCV replication with sofosbuvir (A) or simeprevir (B) in Huh7.5 cells (Con:Control; Bac:25 μmol/L baicalin; Sof:0.05 μmol/L sofosbuvir; Sim:0.01 μmol/L simperivir)
特拉匹韦对 A156T 突变株 HCV 的抑制作用明显弱于对野生型 HCV 的抑制作用,耐药倍数高达 43 倍,说明 A156T 突变株对特拉匹韦耐药。而黄芩苷对野生型和 A156T 突变型 HCV 抑制作用无显著性差异,提示黄芩苷对 A156T 耐药突变病毒具有高耐药屏障。
西咪匹韦对野生型和 D168V 突变型 HCV的抑制作用具有明显差异,其耐药倍数为 41 倍,说明 D168V 突变型 HCV 对西咪匹韦耐药。而黄芩苷对野生型和 D168V 突变型 HCV 的抑制作用则无明显差异,提示黄芩苷对 D168V 突变型HCV 耐药突变病毒具有高耐药屏障。
索非布韦对野生型和 S282T 突变型 HCV 的抑制作用具有明显差异,但其耐药倍数仅为 4 倍,说明索非布韦也具有高耐药屏障的特性[20]。黄芩苷对野生型和 S282T 突变型 HCV 的抑制作用也没有明显差异,提示黄芩苷对 S282T 突变型 HCV具有高耐药屏障。
2.5 药物联用的抗 HCV 作用
为了进一步探讨黄芩苷抗病毒的优势,我们选择有不同作用机制的上市药物索非布韦和西咪匹韦联用观察其联合抗 HCV 的作用。结果显示,25 μmol/L 黄芩苷与 0.05 μmol/L 索非布韦联合用药时,两者具有协同抗病毒作用(图4A,q=1.05),但 25 μmol/L 黄芩苷与 0.01 μmol/L 索非布韦联合用药时,两者具有拮抗作用(图 4B,q=0.43)。
3 讨论
黄芩苷属于黄酮类化合物,是中草药中常见的天然化合物,功能多效,不良反应少,具有抗多种病毒的活性[6-11],是一种广谱抗病毒候选物。我们首先发现黄芩苷具有抗 HCV 的作用。机制研究结果显示,黄芩苷抗 HCV 的作用是通过抑制 HCV NS3/4A 蛋白酶活性发挥,而对 HCV NS3 解旋酶则没有抑制活性。
现有 NS3/4A 蛋白酶抑制剂根据其作用特点可分为两类:一类是基于 NS3/4A 蛋白酶的底物设计的,其抑制原理是利用不易被切割的底物类似物来竞争 NS3/4A 蛋白酶反应中心;另一类是基于NS3/4A 蛋白酶的酶切产物而设计,其抑制原理是NS3/4A 蛋白酶产生的酶切 N 末端产物可占据NS3/4A 蛋白酶的活性位点,这两类均为拟肽类大分子抑制剂[21-24]。黄芩苷是小分子黄酮类化合物,与现有多肽类蛋白酶抑制剂结构差异很大,虽然其活性尚不如现有 DAA 药物的活性,但可作为先导化合物,为今后的结构改造和优化提供可能。
由于 HCV RNA 聚合酶没有校正功能,HCV快速复制易导致耐药突变。这些突变的出现,使治疗无效或反弹。我们的结果显示,黄芩苷对这些耐药突变位点均具有抑制作用,其活性与其抑制野生型的相当,显示了黄芩苷具有高耐药屏障的优势。这可能是其与现有 DAA 药物的结构类型不同的缘故,这为产生耐药的患者提供了一种选择。
由于黄芩苷结构的独特性,有望与其他 DAA药物联用产生协同作用。但我们的结果显示,黄芩苷只与有不同作用机制的索非布韦有协同抗 HCV的作用,与有相同作用机制的西咪匹韦联用则显示出了拮抗作用,提示黄芩苷在蛋白酶上的作用位点与现有蛋白酶抑制剂的作用位点有重叠,或由于黄芩苷与蛋白酶结合后导致构象改变从而影响了西咪匹韦的活性,也或由于其他因素如代谢等问题影响了它们之间的联合抗 HCV 的作用,其机制有待深入研究。
[1]Simmonds P.The origin of hepatitis C virus.Curr Top Microbiol Immunol,2013,369:1-15.
[2]Sulkowski MS,Gardiner DF,Rodriguez-Torres M,et al.Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection.N Engl J Med,2014,370(3):211-221.
[3]Sarrazin C.The importance of resistance to direct antiviral drugs in HCV infection in clinical practice.J Hepatol,2016,64:486-504.
[4]Donaldson EF,Harrington PR,O'Rear JJ,et al.Clinical evidence and bioinformatics characterization of potential hepatitis C virus resistance pathways for sofosbuvir.Hepatology,2015,61(1):56-65.
[5]Patiño-Galindo JÁ,Salvatierra K,González-Candelas F,et al.Comprehensive screening for naturally occurring hepatitis c virus resistance to direct-acting antivirals in the NS3,NS5A,and NS5B genes in worldwide isolates of viral genotypes 1 to 6.Antimicrob Agents Chemother,2016,60(4):2402-2416.
[6]Cheng K,Wu Z,Gao B,et al.Analysis of influence of baicalin joint resveratrol retention enema on the TNF-α,SIgA,IL-2,IFN-γ of rats with respiratory syncytial virus infection.Cell Biochem Biophys,2014,70(2):1305-1309.
[7]Jia Y,Xu R,Hu Y,et al.Anti-NDV activity of baicalin from a traditional Chinese medicine in vitro.J Vet Med Sci,2016,78(5):819-824.
[8]Chu M,Xu L,Zhang MB,et al.Role of baicalin in anti-influenza virus A as a potent inducer of IFN-gamma.Biomed Res Int,2015,2015:263630.
[9]Moghaddam E,Teoh BT,Sam SS,et al.Baicalin,a metabolite of baicalein with antiviral activity against dengue virus.Sci Rep,2014,4:5452.
[10]Wang Q,Wang YT,Pu SP,et al.Zinc coupling potentiates anti-HIV-1 activity of baicalin.Biochem Biophys Res Commun,2004,324(2):605-610.
[11]Cheng Y,Ping J,Xu HD,et al.Synergistic effect of a novel oxymatrine-baicalin combination against hepatitis B virus replication,alpha smooth muscle actin expression and type I collagen synthesis in vitro.World J Gastroenterol,2006,12(32):5153-5159.
[12]Cheng JJ,Li JR,Huang MH,et al.CD36 is a co-receptor for hepatitis C virus E1 protein attachment.Sci Rep,2016,6:21808.
[13]Li JR,Wu YB,Si SY,et al.Establishment and application of high throughput screening model for hepatitis C virus NS3-4A protease inhibitors in vitro.Acta Acad Med Sinicae,2011,33(1):98-101.(in Chinese)李健蕊,武燕彬,司书毅,等.丙型肝炎病毒蛋白酶抑制剂高通量筛选模型的建立及应用.中国医学科学院学报,2011,33(1):98-101.
[14]Belon CA,Frick DN.Monitoring helicase activity with molecular beacons.Biotechniques,2008,45(4):433-442.
[15]Tolosa L,Donato MT,Gómez-Lechón MJ.General cytotoxicity assessment by means of the MTT assay.Methods Mol Biol,2015,1250:333-348.
[16]Zhu YP,Peng ZG,Wu ZY,et al.Host APOBEC3G protein inhibits HCV replication through direct binding at NS3.PLoS One,2015,10:e0121608.
[17]Jiang CC,Cheng JJ,Huang MH,et al.Impact factors on results ofsemi-quantitative western blot in pharmacological research.Chin Pharm J,2015,50(9):758-762.(in Chinese)姜晨晨,程军军,黄梦昊,等.蛋白免疫印迹半定量分析在药理学研究中的影响因素.中国药学杂志,2015,50(9):758-762.
[18]Guo JY,Huo RH,Jiang TL.Evaluation of the method of combination therapy.Pharmacol Clin Chin Mater Med,2005,21(3):60-64.(in Chinese)郭建友,霍如海,姜廷良.衡量联合用药作用研究方法评价.中药药理与临床,2005,21(3):60-64.
[19]Hedskog C,Dvory-Sobol H,Gontcharova V,et al.Evolution of the HCV viral population from a patient with S282T detected at relapse after sofosbuvir monotherapy.J Viral Hepat,2015,22(11):871-881.
[20]Summers BB,Beavers JW,Klibanov OM.Sofosbuvir,a novel nucleotide analogue inhibitor used for the treatment of hepatitis C virus.J Pharm Pharmacol,2014,66(12):1653-1666.
[21]Romano KP,Ali A,Aydin C,et al.The molecular basis of drug resistance against hepatitis C virus NS3/4A protease inhibitors.PLoS Pathog,2012,8(7):e1002832.
[22]Chen KX,Njoroge FG.A review of HCV protease inhibitors.Curr Opin Investig Drugs,2009,10(8):821-837.
[23]Cheng KC,Gupta S,Wang H,et al.Current drug discovery strategies for treatment of hepatitis C virus infection.J Pharm Pharmacol,2011,63(7):883-892.
[24]Lin TI,Lenz O,Fanning G,et al.In vitro activity and preclinical profile of TMC435350,a potent hepatitis C virus protease inhibitor.Antimicrob Agents Chemother,2009,53(4):1377-1385.
The inhibitory activity of baicalin and its mechanism against hepatitis C virus in vitro
LI Jian-rui,CHEN Jin-hua,LI Hu,DONG Biao,MA Xue-mei,PENG Zong-gen
ObjectiveTo evaluate the inhibitory activity of baicalin against hepatitis C virus (HCV) in vitro.MethodsThe effect of compounds against HCV NS3/4A protease and NS3 helicase was detected with fluorescence resonance energy transfer assay in cell free system.The anti-HCV activity on wild and mutant type HCV replication was evaluated in HCV-infected Huh7.5 cells at RNA and protein levels.ResultsBaicalin showed inhibitory activity on HCV NS3/4A protease with no effect on HCV NS3 helicase.In Huh7.5 cells,baicalin inhibited wild type of HCV replication with half maximum effective concentration (EC50) of (31.306 ± 9.559) μmol/L,and inhibited A156T,D168V and S282T drug-resistance mutant HCV replication with EC50of (53.175 ± 19.141) μmol/L,(66.722 ± 30.994) μmol/L,and (63.673 ± 19.770) μmol/L,respectively.Baicalin also showed synergistic effect against HCV with polymerase inhibitor sofosbuvir,but showed antagonistic action with protease inhibitor telaprevir.ConclusionBaicalin shows anti-HCV effect with the action mechanism of inhibiting HCV protease and it is effective for common drug-resistant mutant HCV and exerts synergistic antiviral effect with polymerase inhibitor.
Hepacivirus; BAICALIN; Protease inhibitor; Drug synergism
PENG Zong-gen,Email:pumcpzg@126.com
国家自然科学基金优秀青年科学基金(81322050);教育部新世纪优秀人才支持计划(NCET-12-0072);中国医学科学院北京协和医学院协和学者特聘教授项目(2016)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所病毒室(李健蕊、陈金花、李虎、董飚、彭宗根);100124 北京工业大学生命科学与生物工程学院(马雪梅)
彭宗根,Email:pumcpzg@126.com
2017-02-07
10.3969/j.issn.1673-713X.2017.02.002
方法在体外无细胞系统中应用荧光共振能量转移法检测黄芩苷对 HCV NS3/4A 蛋白酶和 NS3 解旋酶的抑制活性;在 Huh7.5 细胞培养内分析其对野生型及临床常见耐药型 HCV 感染的抑制作用,并考察与目前临床应用的抗病毒药物联合抗 HCV 的活性。
结果黄芩苷具有抑制 HCV NS3/4A 蛋白酶活性,但对NS3 解旋酶无抑制作用。细胞培养内抗 HCV 活性测定显示,黄芩苷抑制野生型 HCV 复制的半数抑制浓度(EC50)为(31.306 ± 9.559)μmol/L,抑制蛋白酶抑制剂常见耐药突变 A156T 和 D168V 突变 HCV 复制的 EC50分别为(53.175 ± 19.141)μmol/L 和(66.722 ± 30.994)μmol/L,抑制多聚酶抑制剂常见耐药突变 S282T 突变 HCV 复制的 EC50为(63.673 ± 19.770)μmol/L。黄芩苷与多聚酶抑制剂索非布韦联用还具有协同抗病毒效果,但与具有相同作用机制的西咪匹韦联用有拮抗作用。
结论黄芩苷具有抗 HCV 作用,其机制为抑制 HCV 蛋白酶,对蛋白酶抑制剂常见耐药突变病毒有效,与多聚酶抑制剂联用有协同抗病毒作用。
Author Affiliations:Department of Antiviral Research,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100050,China (LI Jian-rui,CHEN Jin-hua,LI Hu,DONG Biao,PENG Zong-gen); College of Life Science and Bioengineering,Beijing University of Technology,Beijing 100124,China (MA Xue-mei)
