黄牡丹种子浸提液对白菜种子萌发及幼苗抗氧化酶活性的影响
2017-04-13邓岚张翔宇曾秀丽张珊珊王文华赵凡刘光立
邓岚,张翔宇,曾秀丽,张珊珊,王文华,赵凡,刘光立*
(1.西藏自治区农牧科学院蔬菜研究所,西藏拉萨850032;2.四川农业大学风景园林学院,成都温江611130)
黄牡丹种子浸提液对白菜种子萌发及幼苗抗氧化酶活性的影响
邓岚1,张翔宇2,曾秀丽1,张珊珊1,王文华1,赵凡1,刘光立2*
(1.西藏自治区农牧科学院蔬菜研究所,西藏拉萨850032;2.四川农业大学风景园林学院,成都温江611130)
研究黄牡丹种子浸提液对白菜(Brassica pekinensis)种子萌发、幼苗生长及几种主要抗氧化酶活性的影响,初步探讨黄牡丹种子休眠的原因。以野生黄牡丹(Paeonia delavay Franch.var.lutea)种子为实验材料,提取种皮、胚乳水浸提物。黄牡丹种皮、胚乳中均含有抑制白菜种子萌发及幼苗生长的物质,且对白菜种子萌发及幼苗生长的抑制作用随着该物质浓度的增加而更为显著;相比种皮浸提液,相同浓度条件下的胚乳浸提液对白菜种子萌发及幼苗生长的抑制作用更加明显。几种主要抗氧化酶中,胚乳浸提液能够直接抑制白菜幼苗POD和CAT酶活性,间接影响SOD酶活性。黄牡丹种子浸提物可能通过影响白菜种子抗氧化酶活性从而影响其幼苗的正常生长,黄牡丹种子内存在抑制物质,从而影响黄牡丹种子的休眠。
黄牡丹;白菜;抗氧化酶;休眠;抑制作用
黄牡丹(Paeonia delavay Franch.var.lutea)为芍药科(Paeoniaceae)芍药属(Paeonia)的亚灌木,是我国西南地区特有的野生牡丹,也是国家三级保护植物,属于濒危种[1]。该种的分布区域狭窄,主要分布于云南中部、西南部海拔为2500~3500 m的山地林缘,以及西藏东南部和四川西南部[2]。特有的黄色系花为丰富牡丹的花色提供了难得的基因资源,同时也是芍药属中珍贵的育种材料。通过实验,证明黄牡丹种子休眠的原因是否是因为存在内源物,为进一步研究黄牡丹休眠与萌发特性的研究提供依据,进而为黄牡丹的引种驯化提供基本理论依据。黄牡丹以多种形式的营养繁殖为主,种子繁殖为辅,即为兼性营养繁殖[3]。黄牡丹种群的个体数量小,局限性较大,一般只有几十株至上百株。现今,因为半隐蔽性环境遭受严重破坏,黄牡丹的生态位变窄甚至消失,使其濒危[4]。此外,成熟黄牡丹种子的虫食率高达80%以上,受虫害非常严重[5]。关于黄牡丹的研究,目前主要集中在系统分类、染色体、孢粉学等有限的邻域,对黄牡丹种子生理学的研究罕见。关于黄牡丹种子休眠与萌发的研究,均是研究黄牡丹生境情况,缺乏对其休眠或萌发的原因做进一步的研究。种皮障碍、种胚发育状况和内源萌发抑制物为植物种子休眠的3种主要原因[6]。在紫斑牡丹(P.rockii)的研究实验中发现,其种子所含有的特殊化学物质影响种子的后熟和发芽,抑制胚根和子叶的生长[7]。根据白菜发芽率是否受到抑制,白菜幼苗抗逆性的强弱,证明大花黄牡丹是否存在内源抑制物,判断内源抑制物主要存在的位置,以期为进一步研究黄牡丹休眠与萌发特性提供依据。
1 材料与方法
1.1 材料
供试黄牡丹种子采摘自西藏东南部林芝地区,于2015年9月初,果实黄熟时期晴天采集,采后阴干脱粒,种子去除杂质后在低温避光储存备用。市售的白菜(Brassica pekinensis)种子作为生物活性测定的材料。
1.2 种子浸提液的制备
选取外形饱满有光泽的黄牡丹种子,人工剥离种皮和胚乳,在40℃条件下烘干至恒重。粉碎后各称取10.0 g的种皮和胚乳分别放入100 mL三角瓶中,加入约80 mL去离子水,将3层保鲜薄膜封口的混合液置于20℃无光培养箱内浸提24 h,收集的浸提液在4000 r·min-1离心10 min,过滤得到上清液,将上清液定容至100 mL,即为0.1 g·mL-1的粗提液,置于4℃条件下保存备用。
1.3 种子内源抑制物质活性测定
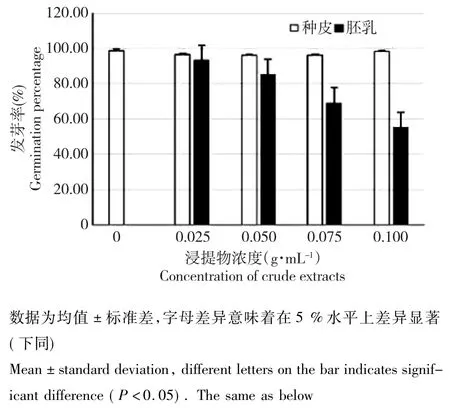
图1 黄牡丹种子浸提液对白菜种子发芽率的影响Fig.1 Effects of crude extracts of Paeonia decomposita seeds on germination rate of Brassica pekinensis
将上述粗提液用去离子水配制成浓度依次为0、0.025、0.050、0.075和0.100 g·mL-1的培养液。将不同浓度的培养液各吸取7 mL,分别加入9 cm培养皿内,每个培养皿均铺有2层滤纸。每皿放置50粒白菜种子,每个浓度设5组平行实验,置25℃光照培养箱内,以胚根突破种皮为发芽标志,观察白菜种子萌发及幼根生长情况[8]。分别于24 h统计发芽率,48 h测定胚根长度,72 h测定下胚轴长度。
1.4 白菜幼苗保护酶活性的测定
用去离子水将胚乳粗提液配制成浓度依次为0、0.01、0.02、0.04和0.08 g·mL-1的培养液。按1.3中的方法将白菜种子在不同浓度的培养液中培养,分别在24、48和72 h参照参考文献[9]方法分别测定白菜幼苗的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性。
数据的统计分析采用Excel软件和SPSS 13数据处理系统。
2 结果与分析
2.1 黄牡丹种子浸提液对白菜种子萌发和幼苗生长的影响
添加种皮浸提液后,各处理的白菜种子发芽率均略微降低,但差异不显著;添加胚乳浸提液后,白菜种子的发芽率均显著降低,并且随着胚乳浸提液浓度的增加,白菜种子发芽率受抑制效果更加明显。相同浓度条件下,胚乳浸提液对白菜种子萌发的抑制作用高于种皮浸提液(图1)。
随着黄牡丹种皮和胚乳浸提物浓度的增加,白菜幼苗胚根长度均呈下降趋势;相同浓度条件下的胚乳浸提液对白菜幼苗胚根伸长的抑制作用显著高于种皮浸提液(图2)。
添加黄牡丹种皮浸提液后,白菜幼苗的下胚轴长度随浸提物浓度的升高总体呈下降趋势;添加胚乳浸提液后,白菜幼苗的下胚轴长度随浸提物浓度的升高而降低;在相同浓度条件下,种皮提取物对白菜幼苗生长的影响显著低于胚乳浸提物。当胚乳浸提物浓度为0.075和0.100 g·mL-1时,部分白菜幼苗根部褐化,不能正常生长(图3)。
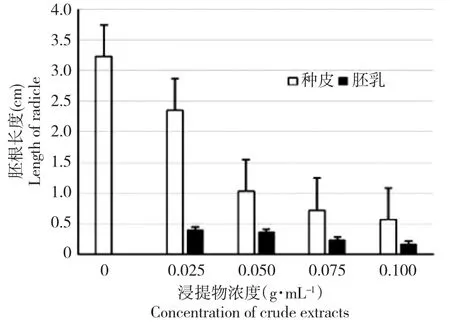
图2 黄牡丹种子浸提液对白菜幼苗胚根生长的影响Fig.2 Effectsof crudeextractsof Paeonia decomposita seedson radicle of Brassica pekinensis
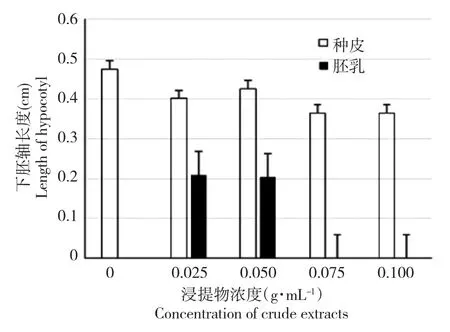
图3 黄牡丹种子浸提液对白菜幼苗下胚轴生长的影响Fig.3 Effects of crude extracts of Paeonia decomposita seeds on hypocotyls of Brassica pekinensis
2.2 黄牡丹胚乳浸提液对白菜幼苗几种抗氧化酶活性的影响
如图4所示,添加黄牡丹胚乳浸提液的白菜幼苗SOD活性与对照相比,除浓度0.01 g·mL-1处理外,随着时间的延长,呈现出先升高后降低的趋势。同时随着浸提物浓度的升高,SOD活性也呈现出先升高后降低的趋势,在浸提物浓度0.04 g·mL-1时达到最高,而在0.08 g·mL-1时又有所下降。
白菜幼苗POD、CAT活性表现出与SOD活性不同的变化趋势(图5~6)。在不同的测定时间内,随着浸提物浓度的升高,CAT活性与POD活性均显著降低,并在0.08 g·mL-1时酶活性降至最低。尽管不同测定时间CAT、POD活性也有变化,但1、2和3 d测定的2种酶变化趋势基本是一致的。
3 讨论
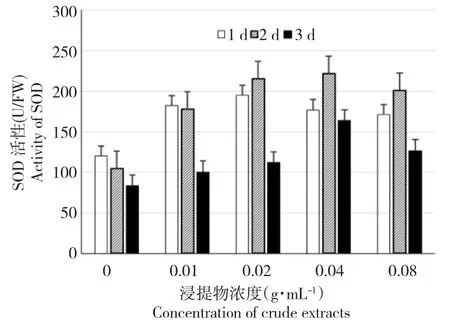
图4 黄牡丹种子浸提液对白菜幼苗中SOD活性的影响Fig.4 Effects of crude extracts of Paeonia decomposita seeds on activities of superoxide dismutaseof Brassica pekinensis
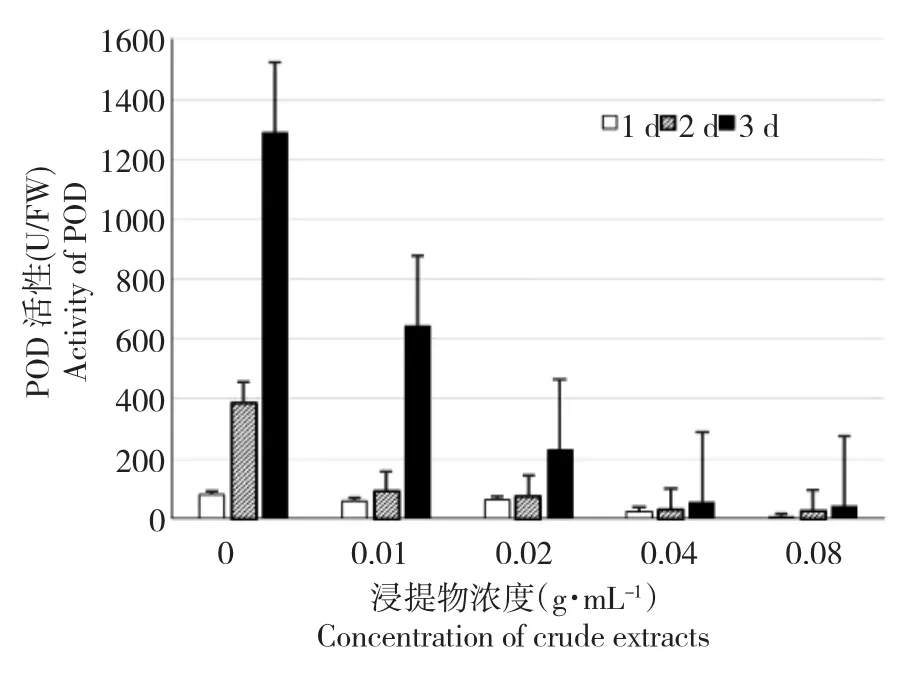
图5 黄牡丹种子浸提液对白菜幼苗中POD活性的影响Fig.5 Effects of crude extracts of Paeonia decomposita seeds on activities of peroxidase of Brassica pekinensis
逆境因子造成植物体内活性氧代谢失调,进而伤害植物。高等作物化感作用的实验表明[10],多酚类化合物通过抑制受体植物SOD和CAT酶活性,使受体植物体内活性氧增多,进而使其膜脂过氧化,破坏膜的结构。在连续种植4年的栽培牡丹凤丹(P.ostii T.)的根际中,发现以阿魏酸、肉桂酸、香草醛、香豆素和丹皮酚为主的酚酸类物质[11-12]。因此,与宋会兴等关于四川牡丹种子的研究结果[13]类似,可以推测,影响受体白菜幼苗中抗氧化酶中SOD、POD、CAT活性的是黄牡丹种子胚乳浸提液中含有多酚类化合物。
本实验中,随胚乳浸提物浓度的增加,白菜幼苗的POD活性和CAT活性降低,且不同时间测定的2种酶变化趋势基本一致。表明胚乳浸提物能够直接抑制白菜幼苗CAT和POD酶活性,使植物的抗逆性,尤其是防止植物细胞衰老的能力降低,这与Roshchina等[10]的研究结果是一致的。随胚乳浸提物浓度的增加,SOD活性总体表现为先升高后降低的趋势,表明胚乳浸提物间接抑制白菜幼苗SOD酶活性,这与宋会兴等[13]的研究结果是一致的,测SOD酶活性的时间不同,使得SOD酶活性的转折点不同,但整体趋势一致。可能由于胚乳浸提物抑制了白菜幼苗中CAT和POD酶活性,导致受体植物体内活性氧增多,植物的应激机制使得SOD酶活性增加[14]。但随着受体植物的受害逐渐加重,SOD酶活性又降低[15-17]。
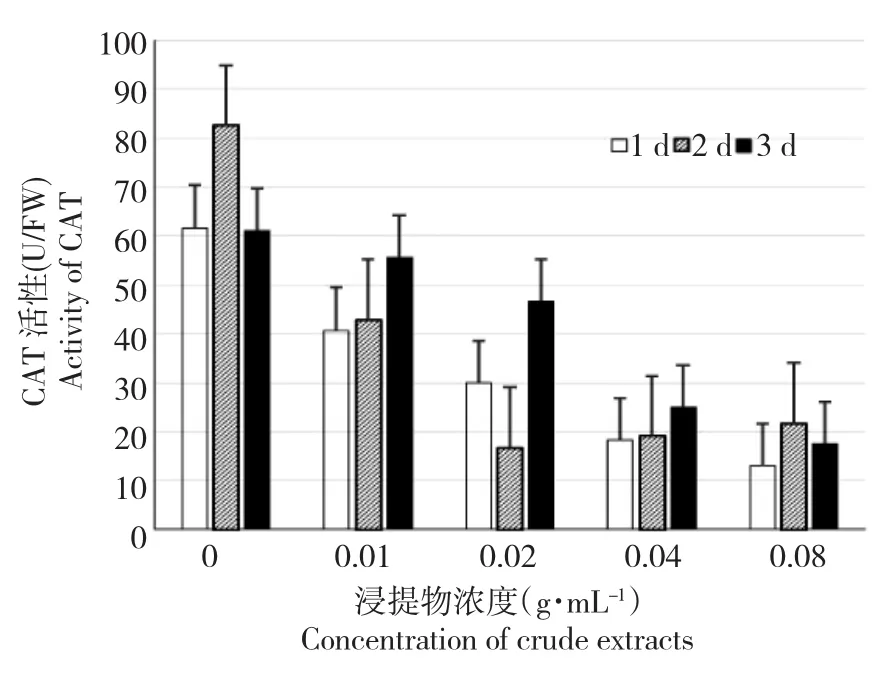
图6 黄牡丹种子浸提液对白菜幼苗中CAT活性的影响Fig.6 Effects of crude extracts of Paeonia decomposita seeds on activities of catelaseof Brassica pekinensis
4 结论
长期的系统演化过程,牡丹组植物种子大多具有的休眠萌发特性包括上胚轴及下胚轴休眠,且上胚轴休眠更为突出[18-19]。本研究结果表明,黄牡丹种子内存在的抑制种子萌发及幼苗生长的物质可以影响幼苗CAT、POD、SOD酶活性的物质,即内源抑制物。且这种物质主要存在于种子胚乳中。这可能也是黄牡丹种子休眠的重要原因。但未对于物质的性质及黄牡丹种子萌发的抑制详细机理进一步研究。
[1]王莲英,袁涛.牡丹花[J].北京:中国建筑工业出版社,2002.
[2]李嘉珏.中国牡丹与芍药[M].北京:中国林业出版社,1999.
[3]成仿云,李嘉珏,陈德忠.中国野生牡丹自然繁衍特性研究[J].园艺学报,1997,24(2):180-184.
[4]王志芳,王雁,岳桦.珍稀资源-黄牡丹[J].中国城市林业,2007,5(2):59-60.
[5]Hong D Y,Pan K Y,Yu H.Taxonomy of the Paeonia delavayi complex(Paeoniaceae)[J].Ann Missouri Bot Gard,1998,85:554-564.
[6]卡恩.种子休眠和萌发的生理生化[M].北京:北京农业出版社,1989:37-40.
[7]周仁超,姚崇怀,潘俊,等.紫斑牡丹种子休眠和萌发特性初步研究[J].湖北农业科学,2002(1):59-60.
[8]吴啸业.红豆杉种子抑制物质的初步研究[J].植物生理学通讯(4),1985:23-26.
[9]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社:2003:68,31,55,127.
[10]Roshchina V V,Roshchina V D.The excretory function of higher plant[M].New York:Springerling,1993:213-215.
[11]覃逸明,聂刘旺,黄雨清,等.凤丹自毒物质的检测及其作用机制[J].生态学报,2009,29(3):1153-1161.
[12]杨勇,刘光立,宋会兴,等.四川牡丹胚乳浸提液对油菜种子萌发与幼苗生长的影响[J].西南农业学报,2013,26(1):89-92.
[13]宋会兴,刘光立,高素萍,等.四川牡丹种子浸提液内源抑制物活性初探[J].园艺学报,2012,39(2):376-380.
[14]Politycka B.Peroxidase activity and lipid peroxidation in roots of cucumber seedlings influenced by derivativesof cinnamic and benzoic acids[J].Acta Physiologiae Plantarum,1996,18:365-370.
[15]Shalata A,Tal M.The effects of salt stress on lipid peroxidation and antioxidants in the leaf of the cultivated tomato and itswild salttolerant relative Lycopersicon pennellii[J].Plant Physiology,1998,104:169-174.
[16]Deltoro V I,Gimeno C,CalatayudA,et al.Effects of SO2fumigations on photosynthetic CO2gas exchange,chlorophyll a fluorescence emission and antioxidant enzymes in lichens Evernia prunastri and Ramalina farinacea[J].Plant Physiology,1999,105:648-654.
[17]Scandalios L G.Oxygen stress and superoxide dismutase[J].Plant Physiology,1993,101:7-12.
[18]刘心民,程逸远,张雾,等.牡丹种子萌发特性与播种繁殖技术研究进展[J].河南林业科技,2005,12(4):38-40.
[19]曾端香,尹伟伦,赵孝庆,等.牡丹繁殖技术[J].北京林业大学学报,2000,22(3):90-95.
(责任编辑 李山云)
Effects of Crude Extracts of Paeonia delavay Seeds on Germ ination and Activities of Antioxidant Enzyme of Brassica pekinensis
DENG Lan1,ZHANG Xiang-yu2,ZENG Xiu-li1,ZHANG Shan-shan1,WANGWen-hua1,ZHAO Fan1,LIU Guang-li2*
(1.Institute of Vegetables,Tibet Academy of Agricultural and Animal Husbandry Sciences,Tibet Lhasa 850032,China;2.School of Landscape Architecture,Sichuan Agricultural University,Sichuan Chengdu 611130,China)
To understand the cause of seed dormancy of Paeonia delavay Franch.var.lutea,the effectsofwater crude extractsof the seed coat and endosperm of P.delavay on the seed germination,seedling growth and antioxidant enzymes of Brassica pekinensis were examined in this paper.With wild P.delavay seed as the experimentalmaterial,the experiment extracted water crude extracts of the seed coat and endosperm.The results showed that the seed,especially the endosperm tissue of P.delavay contained substances that strongly suppressed seed germination.The crude extract of endosperm of P.delavay,which significantly reduced the activities of peroxidase and catalase,and indirectly affected the activity of superoxide dismutase,showed amore significant inhibition than that of seed coatat the same dose.Itwas concluded that the presence of inhibitory substances is one of important causes of seed dormancy in P.delavay.
Paeonia delavay;Franch.var.lutea;Brassica pekinensis;Antioxidant enzyme;Dormancy;Inhibiting effect
S685.11
A
1001-4829(2017)2-0305-04
10.16213/j.cnki.scjas.2017.2.011
2016-04-05
西藏自治区自然科学基金“西藏牡丹种子萌发最适条件的研究”(13-15)
邓岚(1973-),女,江西南昌人,主要从事牡丹、桃、蓝莓育种工作,E-mail:denglan1110@163.com,Tel: 13549096082,*为通讯作者:刘光立,E-mail:liuguangli@sicau.edu.cn。
