软钾镁矾和氯化钾转化硫酸钾结晶粒度研究*
2017-04-11胡天琦张志宏王健康马艳芳赵冬梅张永明
胡天琦,张志宏,王健康,马艳芳,赵冬梅,王 婧,张永明
(1.中国科学院青海盐湖研究所,青海西宁810008;2.中国科学院大学)
研究与开发
软钾镁矾和氯化钾转化硫酸钾结晶粒度研究*
胡天琦1,2,张志宏1,王健康1,2,马艳芳1,赵冬梅1,王 婧1,张永明1
(1.中国科学院青海盐湖研究所,青海西宁810008;2.中国科学院大学)
以前期实验结论为指导,结合相图、溶解结晶理论设计实验方案,探究了温度、加料方式、晶种、过饱和度对软钾镁矾(K2SO4·MgSO4·6H2O)和氯化钾转化硫酸钾结晶粒度的影响。实验结果表明:在25~55℃范围内,随着温度升高,硫酸钾晶体平均粒径增大;分时变温,在55℃转化60min,然后在25℃降温60min,可以使反应较为快速地达到平衡,减少溶解转化的时间,同时提高了硫酸钾的收率,改善了硫酸钾晶体的粒度分布;改变加料方式,先加入氯化钾,30min后加入软钾镁矾,在25℃条件下转化结晶120min,所得硫酸钾晶体的平均粒径比混合加料方式增大约1.9倍;选择特定时间添加晶种和缓慢加入原料,所得硫酸钾晶体的平均粒径显著增大。此研究结果对实际生产中的工艺优化、产品控制具有一定的指导意义。
硫酸钾;结晶;粒径分布
硫酸钾(K2SO4)是一种重要的无氯钾肥,同时也是重要的化工原料[1-4]。中国钾资源储量较少,探明储量约占世界储量的2.2%[5]。其中以卤水状态赋存的盐湖钾盐资源储量占中国储量的92%[6]。利用盐湖卤水和地下卤水生产K2SO4的方法,大多以软钾镁矾(K2SO4·MgSO4·6H2O,Pic)和氯化钾(KCl)为原料经转化制得K2SO4[7-11]。直接从溶液中结晶出颗粒状硫酸钾而无需机械成形和干燥是当前研究的热点之一[12]。采用重结晶或造粒的方法生产K2SO4能耗大,不经济。目前,实际生产出的硫酸钾产品粒度小、分布不均匀,导致产品质量差、纯度不高,对其纯化分离和使用均产生不利影响。因此对K2SO4·MgSO4· 6H2O和KCl转化K2SO4结晶粒度进行研究很有意义。笔者以K2SO4·MgSO4·6H2O和KCl转化制备K2SO4晶体的实验结论为指导[13],考察了温度、加料方式、晶种、过饱和度等因素对K2SO4结晶粒度的影响。
1 实验部分
1.1 实验试剂及仪器
试剂:七水硫酸镁、硫酸钾、氯化钾,均为分析纯。
仪器:X′PertPro全自动X射线衍射仪(XRD);JSM-5610LV/INCA低真空扫描电镜(SEM);MS-2000激光粒度仪;IKA EUROSTAR 40 digital数显恒速搅拌装置;PCD-C5000系列(上海双舜实业发展有限公司)恒温恒速搅拌装置;D-3400(德国赛多利斯集团)快速分离装置。
1.2 实验方法
选取自制的粒度为850~1 700μm的K2SO4· MgSO4·6H2O和粒度为850~17 00μm的重结晶KCl作为实验原料,以K+,Mg2+∥Cl-,SO42--H2O四元水盐交互体系相图为理论依据计算物料比例。
1)探究系列温度条件对 K2SO4结晶粒度的影响。2)根据KCl溶解速率均大于K2SO4·MgSO4·6H2O溶解速率,改变加料方式,考察加料方式对K2SO4结晶的影响。3)通过前期实验结论,根据K2SO4结晶时间确定加入晶种的时间,考察添加晶种对K2SO4结晶粒度的影响。4)通过前期实验结论[13],K+、Mg2+、Cl-、SO42-在反应刚开始的时间段浓度波动很大,为尽量减少爆发成核,采取控制过饱和度的方法:①以母液为基底,数显蠕动泵缓慢加入H2O;②进料器缓慢加入K2SO4·MgSO4·6H2O和KCl;③以母液为基底,进料器缓慢加入K2SO4·MgSO4·6H2O和KCl,同时数显蠕动泵缓慢加入H2O。考察以上3种控制过饱和度的方式对K2SO4结晶粒度的影响。
1.3 分析与表征
采用化学分析法对液相钾、镁、氯、硫酸根含量进行测定[14]:K+,四苯硼钠-季铵盐返滴定法;Mg2+,铬黑T指示剂EDTA络合滴定法;Cl-,硝酸汞络合容量滴定法;SO42-,硫酸钡重量法。采用XRD仪对配制的K2SO4·MgSO4·6H2O固样进行鉴定;采用SEM对K2SO4晶体进行观测;运用MS-2000激光粒度分析仪对K2SO4晶体做粒度分析。
2 结果与讨论
2.1 反应温度对K2SO4结晶粒度的影响
溶液温度的变化会导致溶液黏度、粒子运动能、溶剂结构、溶质溶解度等发生变化。从前期实验结论可知,温度对K2SO4·MgSO4·6H2O溶解度和溶解速率有较大的影响,并且对K2SO4结晶速率和结晶量也有影响。此外,随着温度的变化,反应级数以及溶解结晶速率常数也均有改变,过饱和度也会随之改变[13]。
参考实际生产温度,研究不同温度条件下K2SO4· MgSO4·6H2O和KCl转化成K2SO4的结晶粒度。称取K2SO4·MgSO4·6H2O和KCl,使其充分混合。于密闭容器中称取转化结晶所需蒸馏水置于恒温水浴中恒温30min,启动搅拌装置,设置搅拌转速为360 r/min,一次性快速加入混合均匀的原料。控制转化结晶温度为25、40、55℃,120min后快速分离,获得的K2SO4置于恒温25℃的母液(母液的质量远大于固体质量)中分散做粒度分析,取平行样进行SEM观察。
运用激光粒度分析仪对不同温度下转化结晶的K2SO4进行粒度分析 (见图1);运用SEM对K2SO4进行观察(见图2)。由图1和图2可知:随着温度升高,K2SO4晶体的平均粒径(D50)增大,转化结晶温度分别为25、40、55℃时,K2SO4晶体D50分别为44.017、58.328、68.713μm。

图1 不同反应温度所得硫酸钾晶体粒度分布

图2 不同反应温度所得硫酸钾晶体SEM照片
2.2 分时改变温度对K2SO4结晶粒度的影响
称取K2SO4·MgSO4·6H2O和KCl,使其充分混合。于密闭容器中称取转化结晶所需蒸馏水置于恒温水浴中恒温30min,启动搅拌装置,设置搅拌转速为360 r/min,一次性快速加入混合均匀的原料。控制溶解转化温度分别为25、40、55℃,60min后迅速把反应器置于25℃恒温水浴中降温,60min后对转化的K2SO4晶体做粒度分析,采取母液分散送样方式检测。分时改变温度所得K2SO4晶体粒度分析结果见图3。由图3可知:25℃恒温转化结晶120min,K2SO4晶体D50为44.017μm;40℃恒温转化60min后 25℃恒温水浴降温 60 min,K2SO4晶体 D50为70.473μm;55℃恒温转化60min后25℃恒温水浴降温60min,K2SO4晶体D50为82.789μm。55℃分时变温所得K2SO4晶体D50是25℃恒温所得K2SO4晶体D50的1.9倍。

图3 分时改变温度所得硫酸钾晶体粒度分布
通过对比发现,40℃分时变温转化结晶所得K2SO4晶体 D50(70.473μm)大于40℃恒温转化结晶所得K2SO4晶体D50(58.328μm),D50增大1.2倍。55℃分时变温转化结晶所得K2SO4晶体D50(82.789μm)大于 55℃恒温转化结晶所得 K2SO4晶体 D50(68.713μm),D50增大1.2倍。
由前期实验结论可知,在40~55℃溶解转化60 min后,K2SO4·MgSO4·6H2O的溶解速率约为0.02 mol/(kg·min),K2SO4的 结 晶 速 率 约 为0.02mol/(kg·min),溶解和结晶速率近似为0。通过分时降温晶体粒径增大,说明降温促使了母液中K2SO4结晶,降温过程中硫酸钾晶体在原来晶体基础上继续生长。K2SO4·MgSO4·6H2O和KCl于55℃恒温转化60 min后置于25℃恒温水浴中降温60min,可以使反应较为快速地达到平衡,减少溶解转化的时间,同时提高了硫酸钾的收率,也使K2SO4晶体的平均粒径较大,适用于实际工业生产。
2.3 加料方式对K2SO4结晶粒度的影响
前期实验研究发现,转化结晶K2SO4过程中KCl的溶解速率大于K2SO4·MgSO4·6H2O的溶解速率[13],因此考察不同的加料方式对K2SO4结晶的影响。
于密闭容器中称取所需蒸馏水置于恒温水浴中在25℃恒温30min,设置搅拌转速为360 r/min。按比例称取K2SO4·MgSO4·6H2O和KCl。一次性快速加入KCl,30min后加入K2SO4·MgSO4·6H2O,溶解转化120min后,取转化的K2SO4做粒度分析,平行测定2次。同时做对比实验,一次性快速加入K2SO4· MgSO4·6H2O,30min后加入KCl,溶解转化120min后,取转化的K2SO4做粒度分析。
图4为不同加料方式转化结晶K2SO4的粒度分析结果。由图4可知:改变加料方式使K2SO4晶体的粒径变大。先加入KCl后加入K2SO4·MgSO4·6H2O,K2SO4晶体D50为82.256μm,约为加入混合原料所得K2SO4晶体粒径(44.017μm)的1.9倍。对比样所得K2SO4晶体D50为60.719μm,其粒径小于先加入KCl后加入K2SO4·MgSO4·6H2O所得K2SO4晶体D50(82.256μm)。这是由于KCl溶解速率大于K2SO4· MgSO4·6H2O溶解速率。同时改变加料方式后降低了硫酸钾结晶的过饱和度。
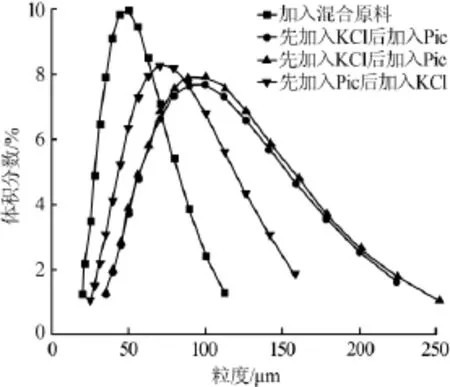
图4 不同加料方式制得硫酸钾晶体粒度分布
2.4 添加晶种对K2SO4结晶粒度的影响
由前期实验可知,K2SO4结晶是一个很迅速的过程,在投料完毕后的30 s已经有K2SO4生成[13],提前添加晶种才能起到较好的作用。实验发现,在投料完毕后的10 s没有发现K2SO4结晶,如果在投料完毕10 s之前加入晶种会造成晶种溶解。综合考虑,在投料完毕18 s左右投入晶种,考察添加晶种对K2SO4结晶粒度的影响。
取所需H2O于25℃恒温水浴中密闭恒温30min。按比例称取K2SO4·MgSO4·6H2O和KCl,使其充分混合,一次性加入反应器中。启动数显搅拌装置,设置转速为360 r/min。称取晶种质量为产品质量的7%,D50为44.017μm,待投料完毕18 s左右添加晶种,待其溶解转化120min后对固相做粒度分布测试,结果见图5。由图5可知,添加晶种后K2SO4晶体D50为64.11μm,为未添加晶种所得晶体粒径的1.5倍。
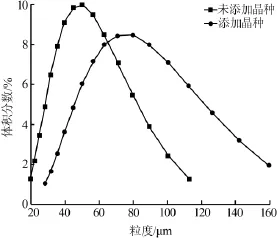
图5 添加晶种所得硫酸钾晶体粒度分布
2.5 控制过饱和度对K2SO4结晶粒度的影响
过饱和度的大小直接影响晶核的形成过程和晶体生长的快慢,而这两个过程的快慢直接影响转化结晶产品的粒度和粒度分布,因此过饱和度是结晶问题的一个极其重要的因素。
前期实验表明,此体系各离子浓度在K2SO4结晶初期变化很大[13],过饱和度较大。据此,改变体系过饱和度,考察其对K2SO4结晶粒度的影响。控制体系过饱和度的方式:1)以母液为基底,数显蠕动泵缓慢加入H2O;2)进料器缓慢加入K2SO4·MgSO4·6H2O和KCl;3)以母液为基底,进料器缓慢加入K2SO4· MgSO4·6H2O和KCl,同时数显蠕动泵缓慢加入H2O。
1)母液制备。通过对配制母液的离子含量进行化学分析(见表1),换算耶涅克值,在相图中标注配制母液组成的位置,发现配制的母液点与理论母液点(Q)非常接近,见图6。认为配制的母液是合适的,将其恒温25℃密封保存。

表1 配制母液组成 10-3mol/g
2)缓慢加水控制过饱和度。称取投入反应物质量之和的母液于反应器中,于25℃恒温水浴密闭恒温30min。称取K2SO4·MgSO4·6H2O和KCl,使其充分混合,一次性加入有母液的反应器中。取蒸馏水于25℃恒温水浴恒温1 h,启动蠕动泵,32.36min加水完毕,搅拌转速为360 r/min。待溶解转化120min后对固相做粒度分布测试,结果见图7。同时,不改变其他条件,仅延长溶解转化时间,360min后对固相做粒度分布测试。由图7可知,以母液为反应基底,一次性投入K2SO4·MgSO4·6H2O和KCl,缓慢加H2O,K2SO4晶体D50为56.780μm。在不改变其他条件情况下,仅增加溶解转化时间,360min后所得K2SO4晶体D50为53.547μm。
3)缓慢加反应物控制过饱和度。称取适量H2O于25℃恒温水浴密闭恒温30min。按比例称取K2SO4·MgSO4·6H2O和KCl,使其充分混合;螺旋进料器进料,32min加料完毕,密封、控制温度和搅拌转速(360 r/min)。待溶解转化120min后对K2SO4晶体做粒度分布测试,结果见图7。由图7可知,缓慢加反应物制备K2SO4晶体D50为71.849μm。
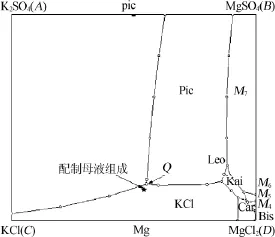
图6 25℃K+,Mg2+∥Cl-,SO42--H2O四元水盐交互体系相图

图7 不同条件下控制过饱和度所得硫酸钾晶体粒径对比
4)固、液缓慢进料控制过饱和度。称取投入反应物质量之和的母液于反应器中,于25℃恒温水浴密闭恒温30min。按比例称取K2SO4·MgSO4·6H2O和KCl,使其充分混合。螺旋进料器进料,32min加料完毕,搅拌转速为360 r/min。取蒸馏水于25℃恒温水浴恒温1 h,在固体进料的同时启动数显蠕动泵加H2O,32.36min加水完毕。固、液进料完毕后密封反应器,反应结晶120min后,对K2SO4晶体做粒度分布测试,结果见图7。由图7看出,固、液缓慢进料制得K2SO4晶体D50为58.077μm。
缓慢加入反应物所得晶体的平均粒径约为固、液同时进料所得晶体平均粒径的1.2倍,约为缓慢加H2O所得晶体平均粒径的1.3倍。三种改变过饱和度的方法中,采用缓慢加入反应物的效果较为明显。
3 结论
以前期实验结论为指导,结合溶解结晶理论设计实验方案,考察其对结晶粒度分布的影响,得出以下结论。1)在25~55℃范围内,随着温度升高K2SO4晶体D50增大,25、40、55℃条件下K2SO4晶体D50分别为44.017、58.328、68.713μm;2)在55℃转化60min,然后在25℃降温60min,可使反应较为快速地达到平衡,减少溶解转化的时间,同时提高了K2SO4收率,也改善了K2SO4晶体的粒度分布,说明分时降温促使母液中K2SO4结晶,在降温过程中硫酸钾晶体在原来晶体基础上继续生长,适用于实际工业生产。3)先加入KCl后加入软钾镁矾的加料方式,可使 K2SO4晶体 D50是混合加料方式所得晶体D50的 1.9倍,不仅方法简单而且效果非常显著。4)选择特定时间添加晶种,K2SO4晶体粒径增大到原来的1.5倍。5)缓慢加入反应物所得K2SO4晶体D50是固、液同时进料所得晶体D50的1.2倍,是缓慢加H2O所得晶体D50的1.3倍,三种改变过饱和度的方法中,采用缓慢加入反应物的方法效果较为明显。
[1] 郑绵平,齐文.我国盐湖资源及其开发利用[J].矿产保护与利用,2006(5):45-50.
[2] 宋彭生,李武,孙柏,等.盐湖资源开发利用进展[J].无机化学学报,2011,27(5):801-815.
[3] 郑喜玉,张明刚,徐昶,等.中国盐湖志[M].北京:科学出版社,2002.
[4] 郑绵平,袁鹤然,张永生,等.中国钾盐区域分布与找钾远景[J].地质学报,2010,84(11):1523-1553.
[5] 乜贞,卜令忠,刘建华,等.我国盐湖钾盐资源现状及提钾工艺技术进展[J].地球学报,2010,31(6):869-874.
[6] 郑绵平,张震,张永生,等.我国钾盐找矿规律新认识和进展[J].地球学报,2012,33(3):280-294.
[7] Dave RH,Ghosh PK.Efficient recovery ofpotassium chloride from liquideffluentgenerated duringpreparationofschoenite from kainite mixed saltand its reuse in production of potassium sulfate[J].Ind. Eng.Chem.Res.,2006,45(5):1551-1556.
[8] MarulloG,VeronicaG.Process for producing potassium sulfate from kainite through the intermediate formation of schoenite and langbeinite[P].US,3207576.1965-09-21.
[9] Rathore SS,Chaudhary DR,Vaisya LK,etal.Schoeniteand potassium sulphate:Indigenous potassic fertilizer for rainfed groundnut(Arachishypogaea L.)[J].Indian Journalof TraditionalKnowledge,2014,13(1):222-226.
[10] Hancer M,Miller JD.The flotation chemistry ofpotassium double salts:Schoenite,kainite,and carnallite[J].Miner.Eng.,2000,13(14/ 15):1483-1493.
[11] 曹忠民,夏树屏,洪显兰.软钾镁矾溶解动力学研究[J].盐湖研究,1994,2(1):57-62.
[12] 张宁,程芳琴,李达.反应结晶法制取颗粒硫酸钾的研究进展[J].无机盐工业,2008,40(5):5-8.
[13] 胡天琦,张志宏,董欧阳,等.25℃K2SO4·MgSO4·6H2O与KCl转化结晶K2SO4动力学与机理研究[J].人工晶体学报,2016,45(2):309-315.
[14] 中国科学院青海盐湖研究所分析室.卤水和盐的分析方法[M]. 2版.北京:科学出版社,1988.
Crystalsizeof K2SO4crystallizing from K2SO4·M gSO4·6H2O and KCl
Hu Tianqi1,2,Zhang Zhihong1,Wang Jiankang1,2,Ma Yanfang1,Zhao Dongmei1,Wang Jing1,Zhang Yongming1
(1.Qinghai Institute ofSalt Lakes,Chinese Academy ofSciences,Xining 810008,China;2.University ofChinese Academy of Sciences)
Guided by the preliminary experimentconclusion,an experimentplanwas designed with combinationsofphase diagram theory and dissolving crystallization theory,to investigate the effects of temperature,feedingway,seed crystal,and degree of supersaturation on the granule size of K2SO4,which crystallized from K2SO4·MgSO4·6H2O and KCl.Results showed that the average particle size(D50)increased with the increase of the temperature at the range of25~55℃.Changing the temperature ateach stage,crystal transforming at55℃for 60min and then cooling at25℃for 60min,itwould actualize fastbalancing,reduce dissolving time,improve the yield and the crystalsize distribution of K2SO4.Ifadding KCl firstat the beginning of the reaction,and then adding K2SO4·MgSO4·6H2O after30min,the D50increased by 1.9 times than the previous crystals prepared bymixing addingway.Adding seed crystalata specific period and adding rawmaterials in a slow way,the D50increased observably.These results can provide the basis for process improvementand product control in actual production process.
crystallization;potassium sulfate;crystalsize distribution
TQ131.13
A
1006-4990(2017)03-0014-05
2016-09-23
胡天琦(1989— ),男,硕士研究生,研究方向为无机化工。
张志宏,研究员。
高新技术研究与发展计划(2012-G-212A);青海省科技支撑项目(2013-G-139A)。
联系方式:zhangzh@isl.ac.cn
