盐酸多奈哌齐对淀粉样蛋白致痴呆树鼩的治疗作用
2017-04-08角建林李进涛王利梅郑永仁
角建林 郑 红 李进涛 王利梅 吴 超 曾 河 郑永仁
(昆明医科大学实验动物学部,云南 昆明 650500)
盐酸多奈哌齐对淀粉样蛋白致痴呆树鼩的治疗作用
角建林 郑 红 李进涛 王利梅 吴 超 曾 河 郑永仁1
(昆明医科大学实验动物学部,云南 昆明 650500)
目的 探讨盐酸多奈哌齐对树鼩侧脑室内注射β-淀粉样蛋白(Aβ)后星形胶质细胞及成熟神经细胞的影响。方法 采用GFAP和NeuN免疫组织化学方法检测各组树鼩大脑皮质和海马CA1、CA3、DG区星形胶质细胞和成熟神经元的表达。结果 模型组树鼩额叶皮质和海马区GFAP阳性星形胶质细胞数明显高于对照组(P<0.01);治疗组海马(P<0.01)和皮质(P<0.05)GFAP阳性细胞数明显低于模型组。模型组树鼩额叶皮质和海马区NeuN阳性成熟神经元数明显少于对照组(P<0.01);治疗组树鼩海马CA1、CA3区(P<0.05)和额叶皮质(P<0.01)NeuN阳性成熟神经元明显多于模型组。结论 盐酸多奈哌齐能抑制Aβ1~40引起的树鼩星形胶质细胞的活化,减轻Aβ对成熟神经元的损伤。
盐酸多奈哌齐;β-淀粉样蛋白;星形胶质细胞;成熟神经元;树鼩
约1/9的65岁以上老年人有阿尔茨海默病(AD)〔1〕。AD是复杂的异质性疾病,多种因素可能参与致病,如遗传因素、神经递质、免疫因素和环境因素等。盐酸多奈哌齐为胆碱酯酶抑制剂,多年临床研究证实对AD疗效显著。对其机制的进一步研究,可完善盐酸多奈哌齐抗AD应用的理论依据,也可为AD治疗药物的研究提供新思路。
1 材料与方法
1.1 动物和分组 18月龄雄性成年滇缅树鼩15只。来自昆明医科大学实验动物学部,许可证号SCXK(滇)2013-0002。树鼩分为3组:对照组、模型组、治疗组,每组5只。
1.2 主要试剂及仪器 β-淀粉样蛋白(Aβ)1~40购自Sigma公司。将Aβ1~40溶于磷酸盐缓冲液(PBS),充分震荡5 min,待其充分溶解,配成浓度为2 μg/μl,置于37℃避光孵育4 d,使其聚集,老化。盐酸多奈哌齐:山东罗欣药业股份有限公司;兔抗人GFAP多克隆抗体、鼠抗人NeuN单克隆抗体:北京中杉金桥公司,脑立体定位仪由成都仪器厂提供。
1.3 动物模型制备 树鼩用3%戊巴比妥钠(30 mg/kg)肌肉注射麻醉后,固定于脑立体定位仪,头顶保持水平。备皮、消毒后,切开头顶正中皮肤,用3%过氧化氢水溶液擦拭软组织以充分暴露颅骨。选择右侧为注射部位,依照前期实验结果,以APO平面〔2〕前2.0 mm(A2.0)、中线右侧1.0 mm(R1.0)坐标处为穿刺点,钻开颅骨,此时会有少量脑脊液留出,用棉球擦拭干净。用微量注射器取孵育好的Aβ1~40或PBS:垂直进针至硬膜下深约5.0 mm(H5.0),缓慢推入液体,留针10 min后退针,防止药物反流颅外。医用碘伏消毒,缝合皮肤。术后给予5 U青霉素钠盐肌注,每天1次。连续3 d。
1.4 药物干预 对照组侧脑室注射PBS,模型组和治疗组注射Aβ1~408 μl。术后3 d起,治疗组灌胃盐酸多奈哌齐1.0 mg/kg,对照组、模型组灌胃等容积生理盐水,连续14 d。
1.5 免疫组织化学显色 各组动物在药物干预结束后,经左心室灌注固定,取脑,剥离海马和额叶皮层,常规石蜡冠状切片。进行尼氏染色、SP法行GFAP和NeuN免疫组织化学显色,阴性对照用PBS代替一抗。每只动物海马结构取5张切片,每张切片随机选取6个高倍视野观察(400倍),Image-J图像分析系统测出GFAP和NeuN免疫反应阳性细胞数。
1.6 统计学处理 应用SPSS17.0统计软件进行单因素方差分析及两两比较。
2 结 果
2.1 尼氏染色 见图1,表1。对照组树鼩海马CA1、CA3、DG区神经细胞结构完整,神经细胞排列整齐,无明显尼氏体破裂现象。模型组海马神经细胞排列散乱,细胞带断裂,存活细胞数明显减少,大量神经细胞出现尼氏体碎裂,细胞凋亡。治疗组树鼩海马细胞排列尚整齐,但细胞间隙增宽,细胞带较薄,少量细胞可见尼氏体碎裂。胞质中央尼氏体消失。模型组神经细胞数明显低于治疗组和对照组(P<0.05),在CA1和CA3区,治疗组神经细胞数与对照组差异无统计学意义(P>0.05)。在树鼩额叶皮层,正常神经细胞为多边形,胞质尼氏体呈斑块状。模型组神经细胞体积变小,可见核浓密深染、核固缩、凝聚呈凋亡状细胞,尼氏体减少,胞质色淡。治疗组神经细胞数与对照组差异无统计学意义(P>0.05);模型组显著低于对照组和治疗组(P<0.05)。
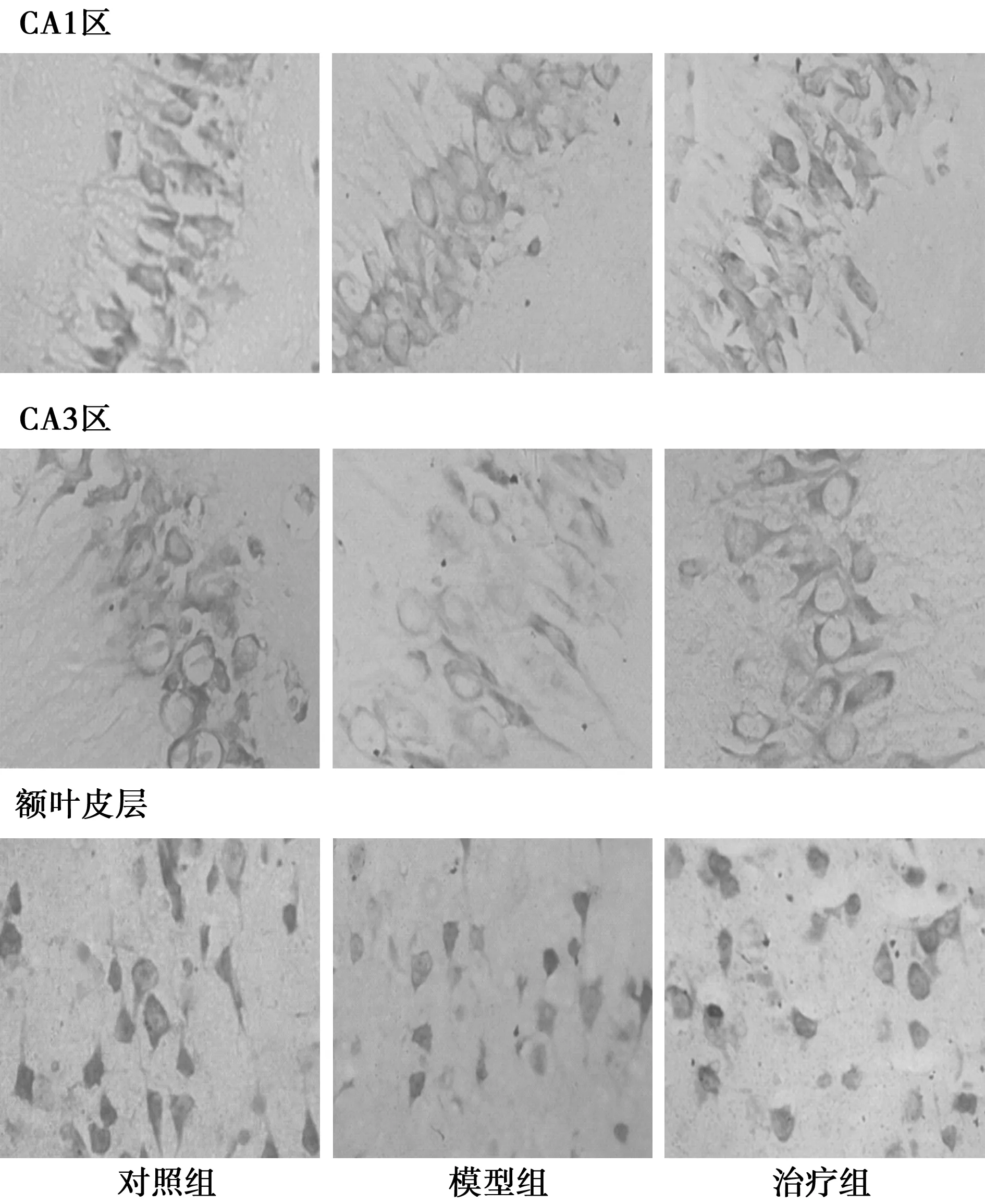
图1 树鼩海马和皮层尼氏染色结果(×400)
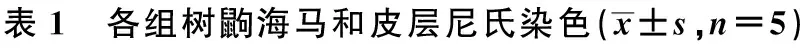

组别CA1区CA3区额叶皮层对照组85.42±6.211)80.44±5.0311)102.03±9.161)模型组67.61±8.5754.61±7.4776.11±9.31治疗组80.13±7.911)72.28±7.161)94.40±8.911)
与模型组比较:1)P<0.05,下表同
2.2 GFAP免疫组织化学显色 GFAP免疫反应阳性为棕黄色,主要在胞质和突起。形态完整的星形胶质细胞,呈星形或蜘蛛状,有明显的突起。对照组树鼩海马CA1、CA3、DG区仅见少量GFAP 免疫反应阳性细胞,突起较少而短,染色淡。模型组树鼩海马GFAP 免疫反应阳性细胞数目多,胞体肥大,突起粗长,染色较深。与对照组比较,模型组GFAP 阳性细胞数多(P<0.01);治疗组海马区GFAP 阳性细胞数较少,颜色较淡,胞体较小,与模型组比较,治疗组海马区GFAP 阳性细胞明显减少(P<0.01)。在树鼩额叶皮层,模型组树鼩GFAP 免疫反应阳性细胞为对照组的5.23倍(P<0.01),治疗组树鼩GFAP 免疫反应阳性细胞降低为模型组的49.33%(P<0.05)(表2)。
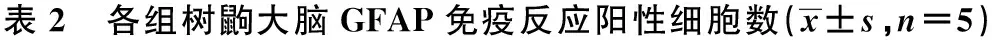
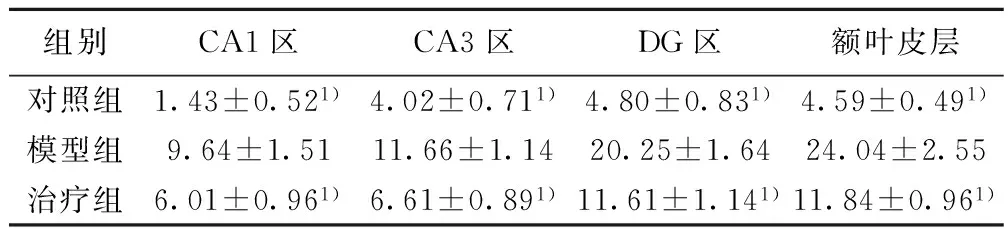
组别CA1区CA3区DG区额叶皮层对照组1.43±0.521)4.02±0.711)4.80±0.831)4.59±0.491)模型组9.64±1.5111.66±1.1420.25±1.6424.04±2.55治疗组6.01±0.961)6.61±0.891)11.61±1.141)11.84±0.961)
2.3 NeuN免疫组织化学显色 NeuN免疫反应阳性呈棕褐色、棕蓝色,在神经细胞核特异性表达。在树鼩海马CA1、CA3和DG区,与对照组比较,模型组树鼩NeuN 免疫反应阳性细胞数明显减少(P<0.01)。在海马CA1、CA3区,与模型组比较,治疗组树鼩NeuN 免疫反应阳性细胞数量较多,颜色较深,治疗组树鼩NeuN 免疫反应阳性细胞数明显增加(P<0.05)。在额叶皮层,模型组树鼩NeuN免疫反应阳性细胞显著低于对照组和治疗组(P<0.01)。对照组树鼩NeuN免疫反应阳性细胞为124.2个,模型组为对照组的30.43%;治疗组为模型组的2.20倍(P<0.01),但仅为对照组67.0%(P<0.01)。见表3。
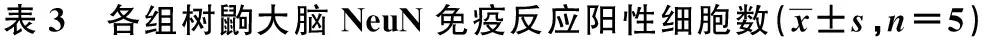

组别CA1区CA3区DG区额叶皮层对照组22.61±1.941)26.44±2.9661)219.63±19.1911)124.20±17.551)模型组9.42±2.076.91±0.89184.42±15.7137.80±5.93治疗组15.63±1.571)8.62±1.141)206.03±15.161)83.20±11.381)
3 讨 论
GFAP是一种胶质中间丝的主要蛋白质,是星形胶质细胞特有、可靠的标志蛋白〔3〕。GFAP过度表达,被认为是星形胶质细胞病理性增多的一个标志〔4〕。星形胶质细胞表面的清道夫受体和晚期糖基化终产物受体是Aβ的结合受体〔5〕。AD大脑中GFAP水平可提高8~16倍〔6〕。活化的星形胶质细胞能释放细胞因子、NO、过氧化物等炎性介质损害神经元,因此加速AD的进展〔7〕。本实验结果与前述文献报道一致,提示AD树鼩脑组织星形胶质细胞被Aβ激活,这可能在Aβ所致的AD发生发展过程中起重要作用。NeuN的免疫反应性在神经元分化成熟后即开始出现〔8〕,故常作为神经元成熟的一种重要标志。有文献报道,神经元受损后将丧失NeuN免疫反应性〔9〕,因此,NeuN在一定程度上能够反映神经元的数量和功能。大脑海马结构在学习和记忆等高级神经活动中起着重要作用〔10〕。海马神经元的数量和状态将影响神经元突触的可塑性,从而影响海马对信息的处理和传递,并进一步对大脑的认知、记忆和学习功能产生影响〔11,12〕。因此,海马区神经元大量丢失是AD 的发病机制之一。AD患者大脑新皮层约40%~78%的神经元丢失,其中以额叶和颞叶受害较严重〔13〕。本文结果提示,盐酸多奈哌齐可缓解海马区和皮层神经元的损伤,神经元的损伤可能是可逆的。推测盐酸多奈哌齐通过抑制的星形胶质细胞活化,减少星形胶质细胞释放的对神经元有毒害作用的细胞因子、NO、过氧化物等炎性介质,进而保护神经元。这一结果为临床治疗AD患者,保护患者脑功能,预防AD发生和发展提供了理论依据。
1 Alzheimer's Association.Alzheimer's disease facts and figures.Alzheimer's & dementia〔J〕.J Alzheimer Assoc,2014;10(2):e47-92.
2 Tigges J,Shantha TR.A stereotaxic brain atlas of tree shrew(Tupaia glis)〔M〕.USA:The Wilkins Company,1969:5-8.
3 Tracey KJ,Cerami A.Tumor necrosis factors,other cyokines and disease〔J〕.Ann Rev Cell Biol,1993;9(2):317-43.
4 Pike CJ,Cummings BJ,Cotman CW.Early association of reactive astrocytes with senile plaques in Alzheimer′s disease〔J〕.Exp Neurol,1995;132(2):172-9.
5 Schubert D,Soucek T,Blouw B.The induction of HIF-1 reduces astrocyte activation by amyloid beta peptide〔J〕.Eur J Neurosci,2009;29(7):1323-34.
6 Kishore V,Kuchibhotla A,Carli R,etal.Synchronous hyperactivity and intercellular calcium waves in astrocytes in Alzheimer mice〔J〕.Science,2009;323(5918):1211-5.
7 Cotm A,Tenner C,Cummings A,etal.Aβ-amyloid converts an acute phase injury response to chronic injury〔J〕.Nurobiol Ageing,1996;17(5):723-31.
8 Sarnat HB,Nochlin D,Born DE,etal.Neuronal nuclear antigen (NeuN):a marker of neuronal maturation in the early human fetal nervous system〔J〕.Brain Dev,1998;20(2):8829.
9 Kiyota T,Ingraham KL,Jacobsen MT,etal.FGF2 gene transfer restores hippocampal functions in mouse models of Alzheimer′s disease and has therapeutic implications for neurocognitive disorders〔J〕.Proc Natl Acad Sci USA,2011;108(49):E1339-48.
10 Zhang XL,Zheng SL,Dong FR,etal.Nimodipine improves regional cerebral blood flow and suppresses inflammatory factors in the hippocampus of rats with vascular dementia〔J〕.J Int Med Res,2012;40(3):1036-45.
11 Liu R,Lei JX,Luo C,etal.Increased EID1 nuclear translocation impairs synaptic plasticity and memory function associated with pathogenesis of Alzhaeimer′s disesse〔J〕.Neurobiol Dis,2012;45(3):902-12.
12 van de PolL,Gertz HJ,Scheltens P,etal.Hippocampal atrophy in subcortical vascular dementia〔J〕.Neurodegener Dis,2011;8(6):465-77.
13 李坤成,杨小平,曹丽珍,等.比较神经影像学〔M〕.第2版.北京:科学技术文献出版社,2012:525-50.
〔2015-12-01修回〕
(编辑 曹梦园)
Effects of donepezil hydrochloride on amyloid-induced dementia in tree shrews
JIAO Jian-Lin,ZHENG Hong,LI Jin-Tao,etal.
Department of Laboratory Animal,Kunming Medical University,Kunming 650500,Yunnan,China
Objective To explore the effects of donepezil hydrochloride on β-amyloid(Aβ)-induced dementia in tree shrews.Methods Fifteen male tree shrews were divided into control,model and treatment groups.The model group was made with unilateral microinjection of aggregated Aβ1~40into lateral ventricle in tree shrews and the control group was injected with PBS instead.The treatment group was administrated with donepezil hydrochloride (1.0 mg·kg-1·d-1) intragastrically after microinjection of aggregated Aβ1~40into lateral ventricle.The GFAP expression of astrocytes and NeuN expression of neurons in the cerebral cortex and hippocampus of each group were detected by immunohistochemical stainning 15 days later.Results The number of GFAP positive astrocyte in the cerebral cortex and hippocampus of model group were obviously increased compared with control group.The number of GFAP positive astrocyte in the cerebral cortex and hippocampus of treatment group were obviously decreased compared with model group.The number of NeuN positive neurons in the cerebral cortex and hippocampus of model group were obviously decreased compared with control group.The number of NeuN positive neurons in the cerebral cortex and hippocampus of treatment group were obviously increased compared with the model group.Conclusions Donepezil hydrochloride could inhibit astrocytic activation induced by Aβ and alleviate damages of mature neurons by Aβ.
Donepezil hydrochloride; Beta-amyloid protein; Astrocyte;Mature neurons; Tree shrews
国家自然科学基金项目(81460647);云南省科技基金项目(2012FB155)
郑 红(1969-),女,博士,副教授,硕士生导师,主要从事神经科学研究。
角建林(1966-),男,高级实验师,主要从事医学实验动物模型研究。
R74
A
1005-9202(2017)06-1323-03;
10.3969/j.issn.1005-9202.2017.06.008
1 云南中医学院实验动物中心
