套细胞淋巴瘤细胞Toll样受体9的表达及意义
2017-04-08安倍莹刘晓会白元松崔久嵬陈京涛
李 爽 杨 阳 安倍莹 刘晓会 吴 静 白元松 崔久嵬 陈京涛
(吉林大学第一医院转化医学研究院,吉林 长春 130061)
套细胞淋巴瘤细胞Toll样受体9的表达及意义
李 爽 杨 阳 安倍莹1刘晓会2吴 静 白元松3崔久嵬4陈京涛
(吉林大学第一医院转化医学研究院,吉林 长春 130061)
目的 观察套细胞淋巴瘤细胞Toll样受体(TLR)9的表达及意义。方法 采用PCR检测TLR9基因的表达,采用流式细胞术检测TLR9蛋白的表达,采用免疫组化检测淋巴瘤患者淋巴结TLR的表达。采用Annexin V/PI双染检测CpG诱导套细胞淋巴瘤细胞的凋亡情况。结果 在套细胞淋巴瘤细胞系,TLR9基因水平和蛋白水平均高表达。套细胞淋巴瘤患者的淋巴结TLR9也有明显的表达。CpG-B刺激套细胞淋巴瘤细胞系后凋亡比例明显上升,并且具有时间和浓度依赖性。结论 TLR9在套细胞淋巴瘤细胞系高表达,CpG-B能够诱导套细胞淋巴瘤细胞凋亡。
Toll样受体;套细胞淋巴瘤;CpG寡聚核苷酸;凋亡
套细胞淋巴瘤(MCL)多发于中老年,男性患者居多,长期生存率低。传统MCL的治疗方法是化疗及放疗〔1,2〕,目前仍无明确的MCL治疗标准〔3〕。
模式识别受体(PRR)是天然免疫中十分重要的免疫受体,能够识别各种病原体〔4〕,引起快速免疫应答。Toll样受体(TLR)是PRR的一种〔5〕。研究表明TLRs在大多数血液系统恶性肿瘤中均有不同程度的表达,包括 B 系淋巴瘤细胞和骨髓瘤细胞等,具有重要的生物学效应〔6,7〕。CpG寡聚核苷酸(CpG-ODN)是TLR9的激动剂。CpG是一组从细菌 DNA 中提取的非甲基化的富含胞嘧啶鸟嘌呤的核苷酸序列〔8〕,主要分三型,A型主要活化浆细胞样树突细胞(pDCs),B型主要活化B细胞〔9〕,C型是出现较晚的一种亚型,兼具A型和B型的活性〔10〕。NCL属于B细胞淋巴瘤,因此本研究主要选用B型CpG〔11,12〕。有研究报道,CpG-B能够诱导白血病细胞的凋亡〔13〕。本研究探讨MCL细胞TLR9的表达及意义。
1 材料和方法
1.1 细胞株及细胞培养 SP53,JEKO-1,G519,MINO,JURKAT细胞株均为ATCC购买并在本实验室保存。细胞培养基配制为RPMI1640(Corning公司),10%胎牛血清(Gibco公司),1%双抗 (Hyclone公司)。细胞株置于37℃,5%CO2饱和湿度培养箱培养,细胞为悬浮细胞系,不需胰酶消化,隔天传代即可。选对数生长期细胞进行实验。
1.2 qPCR检测 收集对数生长期SP53,JEKO-1,G519,MINO、JURKAT细胞1×106,选用EASY PureTMRNA试剂盒(北京全式金公司)提取RNA。再选用TranscriptTM两步法RT-PCR Super Mix试剂盒(北京全式金公司)将mRNA逆转录成cDNA。利用酶标仪检测cDNA的纯度和浓度,A260/280比值均介于1.8~2.0之间。将cDNA进行PCR扩增,扩增参数为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,进行35个循环;然后72℃延伸5 min。将扩增后的cDNA用于不同细胞株的琼脂糖凝胶电泳实验。同时将cDNA进行TLR9 qPCR实验,扩增参数为:95℃预变性10 min;95℃变性10 s,55℃退火30 s,进行40个循环。扩增引物:TLR9上游引物:5' TACCAACATCCTGATGCTAGACTC 3',下游引物:5'TAGGACAACAGCAGATACTCCAGG3'。
1.3 流式细胞仪检测 收集对数生长期的SP53,JEKO-1,G519,MINO细胞,离心1 200 r/min,5 min。细胞计数5×105/管,用破膜液200 μl (BD公司) 将细胞团吹散,室温避光孵育20 min;取400 μl破膜缓冲液洗涤两遍,分别用TLR9抗体,同型对照(BD公司)抗体染色,室温避光孵育30 min,将染好的细胞洗涤两遍,流式细胞仪检测。采用Flowjo流式分析软件分析结果。
1.4 凋亡检测 收集对数生长期的SP53,JEKO-1,G519,MINO细胞,1×105/孔铺于24孔板,分别用CpG-B(CpG684,CpG2006,购自Invitrogen公司) 刺激细胞,各时间点利用Annexin V/PI试剂盒(BD公司)对细胞进行染色,流式细胞仪检测。CpG684序列:5'-tcgacgttcgtcgttcgtcgttc-3',CpG2006序列:5'-tcgtcgttttgtcgttttgtcgtt-3'。
1.5 免疫组化检测 取MCL患者淋巴结的病理切片,置于60℃恒温箱中放置1 h;分别在二甲苯Ⅰ、Ⅱ中浸泡15 min,进行脱蜡,乙醇进行水化后,洗涤3遍;再加热至沸腾的柠檬酸盐缓冲液15 min进行抗原修复,水洗两遍,PBS洗涤3遍;将组织切片在3%甲醇-H2O2中室温浸泡10 min,再用生物素阻断剂试剂盒进行封闭;一抗4℃过夜,PBS洗3遍;用生物素化二抗工作液在37℃温箱孵育30 min,PBS洗涤3遍;辣根酶标记链霉卵白素工作液37℃温箱孵育30 min,PBS洗涤3遍;DAB显色,封片;镜下观察(20×)。
1.6 统计学方法 采用Graph Prism5.0软件对数据进行方差分析及t检验。
2 结 果
2.1 MCL细胞TLR9 mRNA表达 在SP53,JEKO-1,G519,MINO四种B细胞系TLR9 mRNA均有表达,阴性对照组T细胞系JURKAT的TLR9 mRNA表达量则很低,其中JEKO-1和MINO细胞上TLR9表达水平较SP53和G519高,见图1。
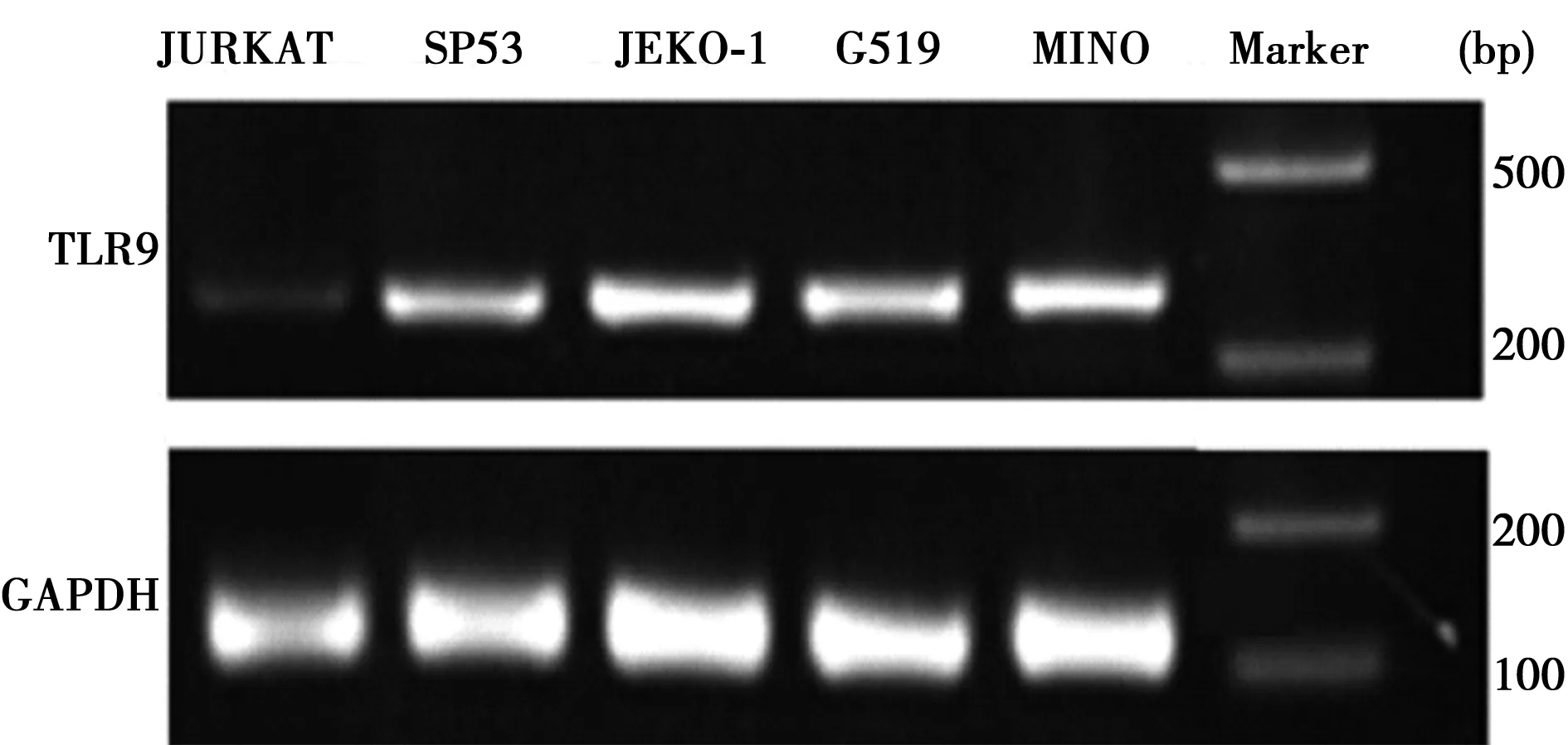
图1 RT-PCR检测不同细胞系TLR9 mRNA表达
2.2 MCL细胞TLR9蛋白表达 SP53、JEKO-1、G519、MINO细胞中TLR9的平均荧光强度(分别为1 203、1 560、1 315、1 487)高于同型对照(分别为985、902、013、898),差异有统计学意义(P<0.05)。 JEKO-1,MINO两种细胞系TLR9的表达量较SP53,G519高,差异有统计学意义(P<0.05)。
2.3 免疫组化结果 正常淋巴结组织结构清晰,而MCL患者的淋巴结轮廓不清晰,组织结构被破坏,有大量棕褐色的阳性结果,说明TLR9在MCL细胞上高表达。见图2。
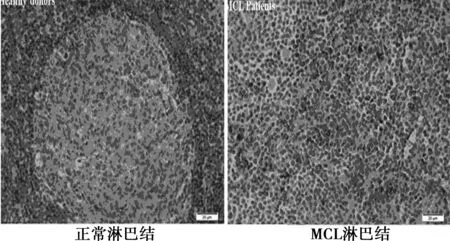
图2 TLR9表达的免疫组化结果(DAB,×200)
2.4 不同浓度CpG-B刺激TLR9诱导MCL的凋亡 本实验选用四种MCL细胞系SP53、JEKO-1、G519、MINO,99%以上细胞均为CD19+的B细胞,细胞系纯度满足实验要求。与阴性对照组相比,B型CpG684和CpG2006均能诱导MCL细胞的凋亡。在SP53,JEKO-1细胞系中,随着CpG684的浓度增加,诱导细胞凋亡的趋势增加,表明CpG-B能够诱导MCL细胞的凋亡,在SP53,JEKO-1细胞系中凋亡具有浓度依赖趋势,但差异无统计学意义(P>0.05)。见表1。
2.5 不同时间CpG-B刺激TLR9诱导MCL的凋亡 在CpG-B刺激MCL 1,3,5 d后,细胞凋亡比例明显增加。在MINO细胞系中,随着刺激时间的增加,CpG2006和CpG684诱导MCL细胞凋亡的比例呈增加趋势,但差异无统计学意义(P>0.05)。见表2。
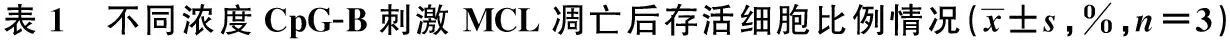
细胞系阴性对照组CpG6841μmol/LP值1)2μmol/LP值1)5μmol/LP值1)CpG2006(5μmol/L)P值1)SP5387.23±7.93079.42±7.2200.542272.16±6.5600.280770.62±6.420.245167.98±6.1800.1956JEKO-199.77±9.07094.16±8.5600.696990.09±8.1900.511386.79±7.8900.393294.82±8.6200.7306G51977.88±7.08068.31±6.2100.416567.32±6.1200.376370.51±6.4100.521065.67±5.9700.3181MINO89.32±8.12080.74±7.3400.515284.48±7.6800.707276.45±6.9500.351734.54±3.1400.02431)
1)与阴性对照组比较,下表同

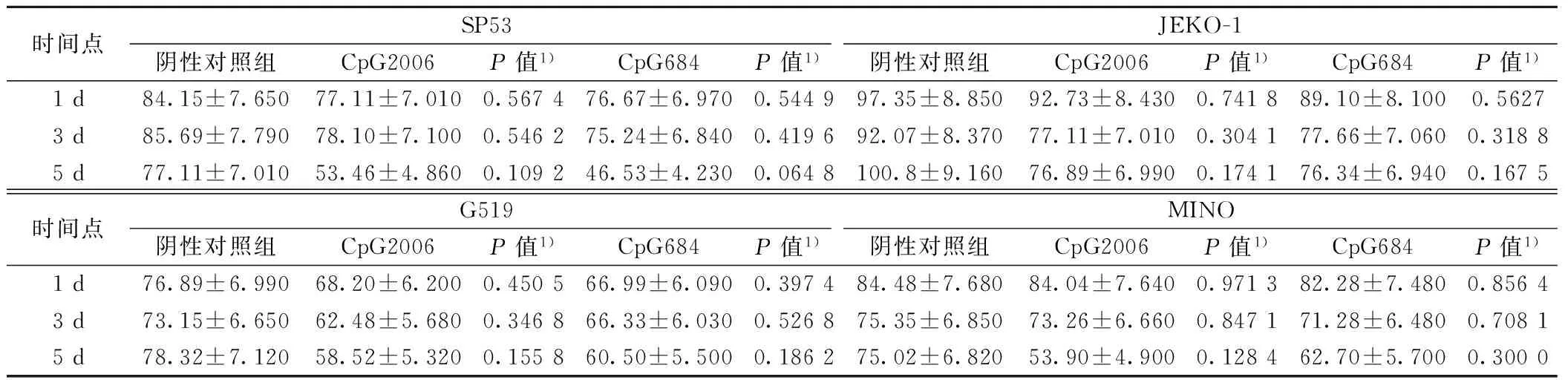
时间点SP53阴性对照组CpG2006P值1)CpG684P值1)JEKO-1阴性对照组CpG2006P值1)CpG684P值1)1d84.15±7.65077.11±7.0100.567476.67±6.9700.544997.35±8.85092.73±8.4300.741889.10±8.1000.56273d85.69±7.79078.10±7.1000.546275.24±6.8400.419692.07±8.37077.11±7.0100.304177.66±7.0600.31885d77.11±7.01053.46±4.8600.109246.53±4.2300.0648100.8±9.16076.89±6.9900.174176.34±6.9400.1675时间点G519阴性对照组CpG2006P值1)CpG684P值1)MINO阴性对照组CpG2006P值1)CpG684P值1)1d76.89±6.99068.20±6.2000.450566.99±6.0900.397484.48±7.68084.04±7.6400.971382.28±7.4800.85643d73.15±6.65062.48±5.6800.346866.33±6.0300.526875.35±6.85073.26±6.6600.847171.28±6.4800.70815d78.32±7.12058.52±5.3200.155860.50±5.5000.186275.02±6.82053.90±4.9000.128462.70±5.7000.3000
3 讨 论
MCL是由体细胞基因突变引起的,B细胞大量扩增,病因不明。MCL多见于60岁左右的老年人,常规的治疗手段痛苦较大,复发率高且生存率低,并不适用于老年人。在国外,一些国家采用干细胞移植的方式,但这种治疗手段配型成功率低,且价格昂贵,普遍性受到限制。目前比较受关注的治疗方式有靶向治疗的生物制剂和免疫治疗,已有靶向药物进入临床试验〔14,15〕。但免疫治疗仍在研究中,人们期待能找到一种有效,可靠的MCL治疗方法。本研究结果表明,MCL肿瘤细胞高表达TLR9,TLR9的激动剂CpG-B能够诱导MCL凋亡。本文发现,SP53在第3天时出现明显凋亡,JEKO-1在第5天时出现明显凋亡,G519整体凋亡趋势不明显,MINO的凋亡具有时间依赖性,造成这种差异的可能因素有:①由细胞自身特性决定的,细胞系大多从病人体内分离得到,病人的个体差异使细胞系之间存在差异;②细胞成系较早,细胞的特性可能会发生一些改变,本实验中已对细胞纯度进行验证;③细胞培养时的状态会存在差异。若想确定凋亡是否具有CpG-B刺激时间或浓度依赖性,还需进一步研究验证。CpG在白血病中的应用颇受争议〔16,17〕,有文章报道称在CpG刺激白血病的肿瘤细胞后,能够促进肿瘤细胞的增殖,并称这一发现对于白血病的微量诊断具有重要意义〔18,19〕。也有研究显示白血病细胞能够表达TLR9,用TLR9的激动剂刺激后能够诱导肿瘤细胞的凋亡,对于白血病的治疗有重要意义〔13〕。本实验表明在MCL中TLR9的激动剂CpG-B能够诱导肿瘤细胞的凋亡。本实验为套细胞淋巴瘤的治疗提供了有力的依据,主要有以下两点:①TLR9在MCL上高表达,为MCL的治疗提供了新的靶点;②CpG-B能够诱导MCL的凋亡,可作为MCL免疫治疗靶向药物。
1 Skarbnik AP,Goy AH.Mantle cell lymphoma:state of the art〔J〕.Clin Adv Hematol Oncol,2015;13(1):44-55.
2 Chandran R,Gardiner SK,Simon M,etal.Survival trends in mantle cell lymphoma in the United States over 16 years 1992-2007〔J〕.Leuk Lymphoma,2012;53(8):1488-93.
3 Klener PJr,Trneny M.Mantle cell lymphoma-cutting edge diagnostics and treatment approaches〔J〕.Klin Onkol,2015;28(Suppl 3):3S80-6.
4 Goldstein MJ,Varghese B,Brody JD,etal.A CpG-loaded tumor cell vaccine induces antitumor CD4+T cells that are effective in adoptive therapy for large and established tumors〔J〕.Blood,2011;117(1):118-27.
5 Medzhitov R.Recognition of microorganisms and activation of the immune response〔J〕.Nature,2007;449(7164):819-26.
6 Diller RA,Riepl HM,Rose O,etal.Ability of prenylflavanones present in hops to induce apoptosis in a human Burkitt lymphoma cell line〔J〕.Planta Med,2007;73(8):755-61.
7 Devaraj S,Kumaresan PR,Jialal I.Effect of C-reactive protein on chemokine expression in human aortic endothelial cells〔J〕.J Mol Cell Cardiol,2004;36(3):405-10.
8 Shirota H,Tross D,Klinman DM.CpG Oligonucleotides as cancer vaccine adjuvants〔J〕.Vaccines (Basel),2015;3(2):390-407.
9 Witzig TE,Wiseman GA,Maurer MJ,etal.A phase Ⅰ trial of immunostimulatory CpG 7909 oligodeoxynucleotide and 90 yttrium ibritumomab tiuxetan radioimmunotherapy for relapsed B-cell non-Hodgkin lymphoma〔J〕.Am J Hematol,2013;88(7):589-93.
10 Bao M,Liu YJ.Regulation of TLR7/9 signaling in plasma cytoid dendritic cells〔J〕.Protein Cell,2013;4(1):40-52.
11 Vollmer J,Weeratna R,Payette P,etal.Characterization of three CpG oligodeoxynucleotide classes with distinct immunostimulatory activities〔J〕.Eur J Immunol,2004;34(1):251-62.
12 Krieg AM.Therapeutic potential of Toll-like receptor 9 activation〔J〕.Nat Rev Drug Discov,2006;5(6):471-84.
13 Liang X,Moseman EA,Farrar MA,etal.Toll-like receptor 9 signaling by CpG-B oligodeoxynucleotides induces an apoptotic pathway in human chronic lymphocytic leukemia B cells〔J〕.Blood,2010;115(24):5041-52.
14 January.Ibrutinib (Imbruvica).Relapsed chronic lymphocytic leukaemia and mantle cell lymphoma:uncertain impact on survival〔J〕.Prescr Int,2016;25(170):89-92.
15 Chen R,Sanchez J,Rosen ST.Clinical management updates in mantle cell lymphoma〔J〕.Oncology (Williston Park),2016;30(4):353-60.
16 Jahrsdorfer B,Muhlenhoff L,Blackwell SE,etal.B-cell lymphomas differ in their responsiveness to CpG oligodeoxynucleotides〔J〕.Clin Cancer Res,2005;11(4):1490-9.
17 Reimann-Berg N,Murua Escobar H,Kiefer Y,etal.Cytogenetic analysis of CpG-oligonucleotide DSP30 plus interleukin-2-stimulated canine B-cell lymphoma cells reveals the loss of one X chromosome as the sole abnormality〔J〕.Cytogenet Genome Res,2011;135(1):79-82.
18 Zent CS,Smith BJ,Ballas ZK,etal.Phase Ⅰ clinical trial of CpG oligonucleotide 7909 (PF-03512676) in patients with previously treated chronic lymphocytic leukemia〔J〕.Leuk Lymphoma,2012;53(2):211-7.
19 Jeong TD,Chi HS,Kim MS,etal.Prognostic relevance of the Ki-67 proliferation index in patients with mantle cell lymphoma〔J〕.Blood Res,2016;51(2):127-32.
〔2016-03-21修回〕
(编辑 曹梦园)
Expression and significance of Toll like receptor 9 on mantle cell lymphoma
LI Shuang,YANG Yang,AN Bei-Ying,etal.
Institute of Translational Medicine,the First Hospital of Jilin University,Changchun 130061,Jilin,China
Objective To explore expression and significance of Toll like receptor (TLR) 9 on mantle cell lymphoma (MCL).Methods MCL cell lines SP53,JEKO-1,G519,MINO and JURKAT were studied.The mRNA or protein expression of TLR9 on MCL cell lines were distinguished by PCR,flow cytometry,and immunohistochemistry.The apoptosis of MCL cell lines was induced by CpG-B treatment and detected by Annexin V and PI staining.Results The expression of TLR9 on MCL cell lines was examined.TLR9 were strongly expressed on the MCL cell lines and lymph nodes from MCL patients.CpG-B,the ligand of TLR9 could induce the apoptosis of MCL cells,which was dose and time dependent.Conclusions MCL cells showed high expression of TLR9,CpG-B could induce tumor apoptosis.
Toll like receptor 9;Mantle cell lymphoma;CpG;Apoptosis
国家自然科学基金(81571534);吉林省科技发展计划项目(国际合作项目)(3D512K213428);吉林省发展与改革委员会项目(2014N147);吉林省科技厅国际合作项目(20140414014GH)
陈京涛(1967-),女,教授,硕士生导师,主要从事肿瘤免疫学研究。
李 爽(1989-),女,硕士在读,主要从事肿瘤免疫学研究。
R73-36
A
1005-9202(2017)06-1310-04;
10.3969/j.issn.1005-9202.2017.06.004
1 吉林大学第一医院检验科 2 安阳市肿瘤医院
3 吉林大学中日联谊医院肿瘤血液科
4 吉林大学第一医院肿瘤中心
