大肠杆菌生产琥珀酸研究进展
2017-03-31沈圆圆陶雪婷张雅欣
沈圆圆, 陶雪婷, 张雅欣, 郭 蓓
北京农学院生物科学与工程学院, 北京 102206
大肠杆菌生产琥珀酸研究进展
沈圆圆, 陶雪婷, 张雅欣, 郭 蓓*
北京农学院生物科学与工程学院, 北京 102206
琥珀酸是一种重要的C4平台化合物,常作为合成通用化学品的起始原料,在化工、食品、医药、农药等领域有广泛的应用前景。与传统的化学合成法相比,微生物发酵生产琥珀酸的原料可再生,具有良好的环境优势,逐渐成为世界各国关注的热点。对近年来通过调控代谢途径提高大肠杆菌琥珀酸产率的研究进展进行了综述,分析了琥珀酸代谢网络及代谢途径中的关键酶基因进行的表达调控、NADH/NAD+的氧化还原态比例对琥珀酸发酵的影响等,并提出了利用RNAi 技术改造大肠杆菌琥珀酸代谢途径的设想,以期为构建高产琥珀酸的工程菌株发酵生产琥珀酸提供新思路。
琥珀酸;大肠杆菌;代谢网络;基因表达调控
琥珀酸又称丁二酸,作为重要的C4平台化合物,是常用于合成通用化学品的起始原料,被广泛地应用于化工行业(如清洁剂、表面活性剂、抗菌剂等)、食品行业(如食品添加剂)以及制药行业,并用于合成多种重要化学品,如γ-丁内酯、1,4-丁二醇、四氢呋喃和2-吡咯烷酮等[1]。同时,琥珀酸作为重要的有机合成中间体,也是用于合成多种如可降解聚酯PBS等聚酯的重要前体物质[2]。
据统计,全球琥珀酸的年产量在3万~5万t[3]。根据Markets and Markets的调查报告显示,琥珀酸的市场需求在2011~2016年间以18.7%的速率稳定增长。传统上琥珀酸是化学合成的,但由于石油资源的减少和环境污染日益严重等问题,化学合成方法的弊端日益显现。而通过生物法发酵生产琥珀酸,因为能够摆脱对不可再生的战略资源石油的依赖、利用可再生资源、固定二氧化碳减轻温室效应等不可替代的优势,展现出良好的发展前景,逐渐成为世界各国关注的热点。
1 大肠杆菌的琥珀酸代谢网络分析
相对于琥珀酸生产依赖石油的传统方法,近年来提升琥珀酸产量的研究开始向微生物发酵的方向转变。为了降低琥珀酸的生产成本,人们多采用遗传背景清楚的、非天然生产琥珀酸的工业生产菌株。
1.1 大肠杆菌生产琥珀酸的优势
当前国内外研究琥珀酸生产的热门菌种有:产琥珀酸厌氧螺菌、产琥珀酸放线杆菌、曼海姆产琥珀酸菌、谷氨酸棒杆菌、酿酒酵母和重组大肠杆菌等[3],经过代谢工程改造这些菌株生产琥珀酸。但以上菌种在生产琥珀酸过程中都会存在一定的问题,以生物法发酵应用较广泛的谷氨酸棒杆菌为例,谷氨酸棒杆菌需要有氧-厌氧双阶段,这会导致全阶段琥珀酸产率较低,并且有氧阶段会大大增加琥珀酸的生产成本[4,5]。就目前琥珀酸的产量、产率与生产力综合考虑而言,相对于其他菌种,工程化的大肠杆菌更具有优势。
野生型大肠杆菌(E.coli)的琥珀酸产量较低,通常为12 mol/100 mol葡萄糖,且有大量副产物。但因为大肠杆菌为兼性厌氧菌,遗传背景清楚、代谢网络明确[6]、易操作、易调控、培养基要求简单、生长迅速等优点,近年来被广泛用于研究琥珀酸代谢途径和提高琥珀酸产量,实践证明用基因重组以及其他分子生物学手段来提高琥珀酸产量是可行的。
1.2 对大肠杆菌琥珀酸代谢途径的研究
近年来,人们深入研究了大肠杆菌的琥珀酸代谢途径,通过对大肠杆菌进行菌株改造和代谢进化筛选,提高了琥珀酸产量。由葡萄糖发酵生产琥珀酸的代谢途径如图1所示。该代谢途径主要包括糖酵解途径(EMP途径)、戊糖磷酸途径(HMP途径)、三羧酸循环(TCA循环)、乙醛酸循环(GAC循环)等环节。
其中,丙酮酸是琥珀酸的前体物质,乳酸脱氢酶能催化丙酮酸生成乳酸,而在细胞内乳酸与丙酮酸之间的转化是可逆的。发酵过程中乳酸含量的增加,会抑制菌体的生长,降低产物转化率,显著提高生产成本。
L-乳酸+NAD=丙酮酸+NADH+H+乳酸
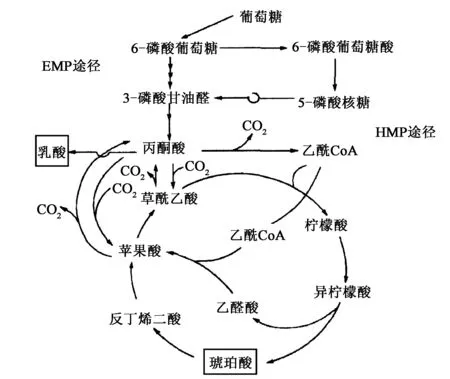
图1 大肠杆菌产琥珀酸的代谢途径Fig.1 Metabolic pathways of succinic acid in E. coli.
基于对大肠杆菌琥珀酸代谢调控网络的分析可以看出,通过基因表达调控,减少乳酸脱氢酶的合成,阻断乳酸代谢支路,使代谢途径中的丙酮酸代谢通道变大,可以引导碳流更快更多的流向琥珀酸。琥珀酸是三羧酸循环的代谢中间产物、乙醛酸循环的代谢末端产物,琥珀酸的积累可使细胞合成的琥珀酸转向分泌型,从而增加琥珀酸的产量[7]。
1.3 基于大肠杆菌代谢琥珀酸网络的分析
通常来讲,利用大肠杆菌发酵生产琥珀酸的方法有3种:好氧生产、厌氧发酵和好氧生长-厌氧发酵两阶段法。这3种生产琥珀酸的方法都有各自的优势和瓶颈,可以尝试构建大肠杆菌工程菌株,使其在好氧、微好氧和厌氧这3种发酵条件下均能大量生产琥珀酸,提高琥珀酸的生产效率。下文将主要介绍在大肠杆菌琥珀酸发酵过程中,对代谢网络进行调控的若干研究进展。
在利用大肠杆菌生产琥珀酸的代谢网络中,因为涉及到的酶催化反应众多,对基因进行逐个改造难度会非常大。由于加快碳源的跨膜转运是提高琥珀酸产量和生产强度的关键,如果尝试对琥珀酸代谢途径和调控NAD(H)的氧化还原态比例的关键酶基因进行改造,比如增强代谢途径上的某些酶基因表达、运用基因敲除的方法阻断某些酶基因表达、利用RNAi沉默某些酶基因等,都是改变代谢通路中碳流分布的有效途径,以此提高琥珀酸的产量,进而提升生产强度。
2 对代谢途径中的关键酶基因进行表达调控
2.1 增强代谢途径中酶基因的表达
Vemuril等[7]进一步将编码丙酮酸(PEP)羧化酶基因的质粒转移到AFPlll中,通过IPTG诱导后,使琥珀酸的产量进一步提高。再通过有氧培养,在无氧发酵产酸的两步法培养中,发现对大肠杆菌产酸起决定作用的是转换时间的选择,选择最合适的转换时间 (即发酵液的溶氧浓度刚开始下降,仍在90%左右时) 能使琥珀酸的终浓度达到99.2 g/L,产率为110%,生产效率1.3 g/L。Millard等[8]通过在大肠杆菌JCLl208中过量表达PEP羧化酶,可以使琥珀酸的产量提高3.5倍,但尝试过量表达PEP激酶干扰琥珀酸代谢的方法却没有任何效果。Millard等通过在大肠杆菌中表达PEP羧化酶基因而得到E.coli(JCLl242/pTre99A-pyc),发现pyc的表达对糖的消耗速率和细胞的生长速率没有影响。改变发酵条件,发现无氧发酵时,pyc的表达使琥珀酸的产量提高了2.7倍,而乳酸的产量则有明显下降[9]。
刘学胜等[10]对草酰乙酸这一代谢节点进行调控,在CDW-S中表达了PEP羧化酶及PYC羧化酶基因,结果显示,羧化酶的过量表达有助于琥珀酸的累积,其中PYC羧化酶的过量表达对琥珀酸产量影响较大,但PEP羧化酶也能在一定程度上促进谷氨酸棒状杆菌厌氧合成琥珀酸。同时对菌体重复利用进行产酸的研究发现,菌体连续重复利用三代的情况下丁二酸的转化率及菌体的产酸强度保持不变。
2.2 基因敲除法阻断代谢途径中酶基因的表达
在琥珀酸生成中,副产物乳酸的积累是限制琥珀酸转化率提高的主要因素。乳酸发酵过程是一个典型的细胞生长与产物形成间的代谢与控制矛盾体,精确并简便调节这一矛盾体,可实现细胞的高速生长。在厌氧条件下,野生型大肠杆菌进行混合酸发酵时,其产物主要有甲酸、乳酸、乙酸、乙醇,以及少量的琥珀酸,由此可知,促进乳酸向丙酮酸的转化,可以减少发酵产物中副产物乳酸的含量,有利于发酵液的后期分离。在发酵过程中乳酸含量的增加,会抑制菌体的生长,降低产物转化率,并且不利于发酵液的后期分离,会显著地增加生产成本。要达到高产琥珀酸的目的,可以通过抑制乳酸代谢途径实现,其中乳酸脱氢酶是一个关键酶。
Pan等[11]以大肠杆菌W3110作为受体菌株,构建了大肠杆菌双重突变株SS373 (W3110pta∷Tn 10ldhA)。在构建时,利用P1噬菌体转导的方法,依次缺失了两个基因(磷酸转移酶基因pta和乳酸脱氢酶基因ldhA)。在厌氧条件下进行发酵时,野生菌W3110发酵的主要产物是乳酸和乙酸,而双重突变株SS373发酵的主要产物是琥珀酸和丙酮酸,两种产物的比率受到碳源种类的影响。当使用非葡萄糖(PTS)类发酵时,发酵产物接近于纯的琥珀酸。贾全栋等[4]对敲除了乳酸脱氢酶基因的谷氨酸棒状杆菌进行厌氧发酵,并运用代谢流分析方法分析发酵数据,发现敲除乳酸脱氢酶基因可以使大肠杆菌磷酸烯醇式丙酮酸生成琥珀酸的流量提高214.3%,而其生成乳酸方向的流量变为0。刘学胜等[10]通过对谷氨酸棒状杆菌厌氧产酸条件进行细胞重复利用连续产酸研究发现:阻断乳酸代谢支路,消除了主要副产物乳酸。并且,其发酵液中乳酸的产量由起始菌的60.5 g/L降为发酵液中几乎检测不到,琥珀酸及乙酸产量得以显著增加。由此证明,如果切断生成乳酸的代谢支路,更多的碳代谢流有可能流向琥珀酸支路。
李宜奎等[11]发现乳酸脱氢酶基因的敲除使得丙酮酸生成乳酸减弱,而其生成甲酸和乙酸能力增强,同时部分丙酮酸得以积累,有利于提高琥珀酸的产量。于芳等[12]经PCR验证和LDH酶活测定,证实编码LDH的基因ldh被成功敲除后,C.acetoacidophilumΔldh产琥珀酸在缺氧条件下,流向乳酸的代谢流量为零,流向琥珀酸的代谢流量比ATCC13870提高了159%。乳酸脱氢酶(ldhA)的删除使乳酸浓度由13.36 g/L降低到0.59 g/L,同时丙酮酸由无积累增加到1.7 g/L,乙酸浓度则由3.47 g/L升高到4.97 g/L,甲酸由1.73 g/L升高到4.30 g/L。
2.3 运用RNAi技术沉默代谢途径中的酶基因
与传统的基因敲除等方法相比,RNAi克服了要求苛刻、过程繁琐的缺点,快速、可靠、经济,越来越受到生物学家的关注,成为分子生物学、细胞生物学最热门的研究领域之一。
RNAi通过序列特异的方式抑制,由长约21~23个核苷酸的双链RNA分子(small interfering RNA, siRNA)[13]介导。由于siRNA可以直接在转录及转录后水平抑制基因表达,所以可直接采用注射双链RNA的方式抑制有害基因的表达[14,15]。RNAi技术常用于结构基因的功能研究,用于细胞周期调控、代谢、信号转导、膜转运等多方面的基因功能研究,但在大肠杆菌代谢调控方面少有应用。
目前来说,RNAi能够迅速、特异地抑制同源基因的表达,成为改变菌株代谢途径或构建出新代谢途径的代替基因敲除的方法,是筛选或构建能用于工业化生产的高产琥珀酸大肠杆菌菌株的可选优化技术。我们设想并试图尝试通过RNAi沉默大肠杆菌乳酸脱氢酶基因,减少乳酸脱氢酶的合成,引导更多的碳源流向琥珀酸,为构建高产琥珀酸的大肠杆菌提供技术参考。
3 调控NAD(H)的氧化还原态比例对琥珀酸发酵的影响
实验研究证明在起始的好氧阶段,细胞快速生长,发酵液中琥珀酸的积累基本上与菌株生长相偶联。过量表达NAD+依赖的关键酶可有效降低NADH/NAD+的比例,恢复重组大肠杆菌对葡萄糖的代谢,是琥珀酸积累的必要条件。NADH/NAD+的比例下降59.4%,使重组菌在厌氧条件下能够正常代谢葡萄糖[16,17]。在过量表达了NAD(H)合成中的限速酶基因——烟酸单核苷酸腺苷转移酶基因后,使NADH/NAD+的比例下降36%,NAD(H)总量提升了2.63倍,同时减少了丙酮酸的积累有利于琥珀酸的大量合成[18]。梁丽亚等[19]构建了苹果酸脱氢酶的重组菌大肠杆菌NZN111/pTrc99a-mdh,在厌氧摇瓶发酵过程中通过0.3 mmol/L的IPTG诱导后重组菌的苹果酸脱氢酶(malate dehydrogenase,MDH)酶活较出发菌株提高了14.8倍,NADH/NAD+的比例从0.64下降到0.26,同时NAD+和NADH浓度分别提高了1.5倍和0.2倍,厌氧条件下重组菌株具有生长和代谢葡萄糖的能力。
在厌氧发酵过程中,细胞内不同的氧化还原电位值(ORP)对NADH的代谢通量分布及NADH/NAD+的比例也有较为显著的影响[20]。苟冬梅等[18]在研究中还发现,在厌氧发酵时,由于NADH不能及时再生为NAD+,胞内辅酶NAD(H)变得不平衡,最终使厌氧发酵过程中发酵菌株无法正常利用葡萄糖进行生长代谢。NaDD是烟酸单核苷酸腺苷酰转移酶(nicotinicacid mononucleotide adenylyltransferase,NAMNAT)的编码基因,能催化NAD(H)合成途径中烟酸单核苷酸(NaMN)生成烟酸腺嘌呤二核苷酸(NaAD),利用过量表达NaDD基因的方式能够提高NAD(H)的总量和维持胞内适宜的NADH/NAD+比例。充足的NAD+进行葡萄糖氧化可以满足细胞的生长需求,大肠杆菌NZN111由于敲除了丙酮酸甲酸裂解酶基因(pfl)与乳酸脱氢酶基因(ldh),NAD+不能及时再生,从而导致胞内辅酶NADH/NAD+比例的不平衡,以至于该菌株厌氧条件下不能代谢葡萄糖进行细胞生长和产酸。
通过NADH的再生提供更多的还原力,即提高大肠杆菌产NADH的能力可以使琥珀酸的转化率得到提高。曹剑磊等[21]从枯草芽孢杆菌Bacillussubtilis168中克隆出葡萄糖脱氢酶基因片段,整合到质粒pET28+中并在大肠杆菌中进行表达,由其编码生成葡萄糖脱氢酶,增强了葡萄糖脱氢酶的表达,促进了NADH的再生。王乐等[22~25]发现一致化NADH脱氢酶可以提高大肠杆菌在厌氧条件下生产琥珀酸的性能。敲除大肠杆菌好氧电子传递链中主要的两个NADH脱氢酶基因(NDH-II和WrbA),一致化琥珀酸在好氧生长、厌氧发酵中NADH电子传递链中的NADH脱氢酶,可以提高大肠杆菌在厌氧阶段对葡萄糖的消耗,增加琥珀酸的产量。这一全阶段的大肠杆菌发酵过程,不仅实现了产物琥珀酸的高产量、高生产强度和高设备周转率,并且乳酸等副产物积累较少,极大地降低了在最后环节分离纯化琥珀酸的成本,因此,具有十分可观的工业化、规模化应用价值和开发前景。
4 展望
通过微生物代谢控制发酵进行琥珀酸生产有着不可替代的优势,具有良好的生产前景。在发酵生产过程中,可以在大肠杆菌琥珀酸的代谢途径中通过重组技术对关键酶的基因进行表达调控,使琥珀酸成为生物代谢过程中的主要产物,并且实现其浓度和纯度也达到较高的水平。当前对重组大肠杆菌及高产琥珀酸工程菌株的代谢控制研究,多数集中在过量表达代谢途径中的关键酶、敲除或沉默干扰产物合成途径中的关键酶、维持辅酶NAD(H)的氧化还原平衡等方面。但由于琥珀酸的积累和菌体的生长存在部分偶联效应,在对菌体进行代谢控制策略后会导致发酵周期延长等一系列不利于提高发酵效率的问题,从而限制琥珀酸的工业化生产。
随着RNAi 分子机制的阐明, RNAi技术在功能基因组学、基因治疗等方面应用越来越广阔,但应用于提高大肠杆菌发酵生产能力的研究较少,用RNAi技术提高大肠杆菌的琥珀酸生产能力极具发展前景。但在工程菌发酵的实际生产应用中仍然存在不少问题,现对今后的研究方向提出以下建议:①通过对大肠杆菌琥珀酸代谢网络进行优化,在多个基因位点同时进行RNAi,不断优化琥珀酸合成途径;②尝试阻断或减少琥珀酸的降解途径;③研究发酵条件,优化发酵工艺方式,对有利于琥珀酸积累的厌氧发酵方式进行优化控制;④发展琥珀酸发酵与分离耦合工艺,取长补短,开发新的技术,对原有技术进行深入的改进和耦合,及时将琥珀酸转移出来,消除产物抑制效应;⑤找到更能节省成本的底物,进一步提高琥珀酸发酵生产的经济效益。
[1] Cheng K K, Zhao X B, Zeng J,etal.. Biotechnological production of succinic acid: current state and perspectives[J]. Biofuel. Bioprod. Bioref., 2012, 6(3):302-318.
[2] Xu J, Guo B H. Poly(butylene succinate and its copolymers: research, development and industrialization[J]. Biotechnology, 2010, 5(5):1149-1163.
[3] Nattrass L, Aylott M, Higson A N. Renewable chemicals factsheet: Succinic acid[R]. NNFCC, 2013.
[4] Cok B,Tsiropoulos I,Roes A L,etal.. Succinic acid production derived from carbohy drates:an energy and greenhouse gas assessment of a platform chemical toward abio-based economy[J]. Biofuel. Bioprod. Bioref., 2014, 8(1):16-29.
[5] Litsanov B, Brocker M, Bott M. Toward homosuccinate fermentation: metabolic engineering ofCorynebacteriumglutamicumfor anaerobic production of succinate from glucoseand formate[J]. Appl. Environ. Microbiol., 2012, 78(9):3325-3337.
[6] 刘嵘明, 梁丽亚, 吴明科,等. 微生物发酵生产丁二酸研究进展[J]. 生物工程学报, 2013, 10 (29):1386-1397.
[7] Vemuri G N, Eiteman M A, Altman E. Effects ofgrowth mode and pyruvatecarboxylase on succinic acid production by metabolically engineered strains ofEscherichiacoli[J]. Appl. Environ. Microbiol., 2002, 68(4):1715-1727.
[8] Hong S H, Lee S Y. Importance of redox balance on the production of succinic acid by metabolically engineeredEscherichiacoli[J]. Appl. Microbiol. Biotechnol., 2002, 58 (3):286-290.
[9] 李娇娇, 祁庆生. 琥珀酸的生物制造:细菌还是酵母? [J].生物产业技术, 2016, 01:49-53.
[10] 刘学胜, 贾全栋, 张伟国. 产丁二酸谷氨酸棒状杆菌基因缺失代谢工程菌株的构建[J]. 微生物学通报, 2013, 5(40):739-748.
[11] 李宜奎. 好氧—厌氧产琥珀酸大肠杆菌的构建及全阶段发酵设计的研究[D]. 山东:山东大学, 博士学位论文, 2014.
[12] 于 芳. 谷氨酸棒杆菌产琥珀酸研究[D]. 江苏:江南大学, 硕士学位论文, 2012.
[13] 谌苗苗, 钟 亮, 赵春山,等. RNAi技术研究现状及其在柞蚕基础应用研究的前景[J]. 北方蚕业, 2016, 02:6-10.
[14] Dong Y, Wang D, He G Q,etal.. An efficient tool for random insertional mutagenesisAgrobacteriumtumefaciens-mediated transformation of the filamentous fungusAspergillusterreus[J]. J. Microbiol. Methods, 2014, 98:114-118.
[15] Zheng G Y, Wang Z Y, Wang D Z,etal.. Enhancement of sludge dewaterability by sequential inoculation of filamentous fungusMucorcircinelloidesZG-3 andAcidithiobacillusferrooxidansLX5[J]. Chem. Engin. J., 2016, 284:216-223.
[16] 吴 昊, 马江锋, 吴明科,等. 非粮生物质制备生物基丁二酸的研究进展[J]. 广西科学, 2015, 01:20-26.
[17] 林丽华, 郭 媛, 裴建新,等. 产丁醇大肠杆菌工程菌的构建[J]. 广西科学, 2014, 1:42-46.
[18] 苟冬梅, 梁丽亚, 刘嵘明,等.过量表达烟酸单核苷酸腺苷酰转移酶对大肠杆菌NZN111产丁二酸的影响[J]. 生物工程学报, 2012, 09:1059-1069.
[19] 梁丽亚, 马江锋, 刘嵘明,等.过量表达苹果酸脱氢酶对大肠杆菌NZN111产丁二酸的影响[J]. 生物工程学报, 2011, 07:1005-1012.
[20] Wang L, Yang M, Fan X G,etal.. An environmentally friendly and efficient method for xylitol bioconversion with high-temperature-steaming corncob hydrolysate by adapted Candida tropicalis [J]. Proc. Biochem.,2011,46(8):1619-1626.
[21] 曹剑磊, 周 丽, 张 梁,等.产琥珀酸重组大肠杆菌的构建和发酵性能[J].应用与环境生物学报,2010, 6:851-857.
[22] 尹 强, 康 振, 钟盛华, 等.产琥珀酸工程菌株的发酵工艺条件优化[J]. 生物加工过程, 2010, 4:1-5.
[23] Wang L, Fan X G, Tang P W H,etal.. Xylitol fermentation usinghemicellulose hydrolysate prepared by acid pre-impregnated steamexplosion of corncob [J]. J. Chem. Technol. Biotechnol.,2013, 88 (11):2067-2074.
[24] 何华美, 李淑珍, 陈丹霞,等. 芽孢杆菌混合发酵工艺条件的优化[J]. 中国酿造, 2014, 4:56-60.
[25] 王 乐, 宇光海, 杨硕晔,等, 一株丁二酸高产菌株的筛选与选育[J]. 生物技术通报, 2015, 3:127-134.
Progress on Succinic Acid Production byEscherichiacoli
SHEN Yuanyuan, TAO Xueting, ZHANG Yaxin, GUO Bei*
CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China
Succinic acid, an important C4 compound, is often used as a raw material for synthesis of commodity chemicals. It has broad application prospects in chemical industry, food, medicine, pesticide, etc. Compared with the traditional chemical synthesis, microbial fermentation production of succinic acid is gradually considered as focus in the world due to its renewable and environment-friendly nature. This paper reviewed the research progress of how to improve succinic acid production rate ofEscherichiacoli(E.coli) by regulating metabolic pathway in recent years. We also summerized the metabolic network of succinic acid, the regulation on gene of the key enzymes in metabolic pathway and the influence of the production of succinic acid caused by the ratio of NADH/NAD+. In addition, we put forward a suggestion that reform the succinic acid metabolic pathways inE.coliby RNAi and gave a new idea about constructing a genetic engineering strain for improving the production of succinic acid.
succinic acid;E.coli; metabolic network; regulation of gene expression
2016-11-17; 接受日期:2017-01-22
国家863计划项目(2012AA021502)资助。
沈圆圆,硕士研究生,研究方向为生物工程发酵。E-mail:2396782076@qq.com。*通信作者:郭蓓,教授,研究方向为遗传与基因工程。E-mail:guobeibac@sohu.com
10.3969/j.issn.2095-2341.2017.02.10
