内质网钙池操控钙内流研究进展
2017-03-31郑思思赵福宽
郑思思, 项 楠, 赵福宽
北京农学院生物科学与工程学院, 北京 102206
内质网钙池操控钙内流研究进展
郑思思, 项 楠, 赵福宽*
北京农学院生物科学与工程学院, 北京 102206
细胞内的内质网钙库清空所引发的钙内流是细胞钙信号的重要组成,介导胞外钙离子进入细胞内,并参与细胞内一系列广泛的生理过程。该过程主要由内质网上的钙离子感受器STIM蛋白和细胞膜上的Orai钙离子通道的所介导的。对钙库操控性钙内流的研究进展进行了讨论,并展望了未来的研究方向,以期为相关研究提供参考。
钙库操控性钙内流;STIM蛋白;Orai通道;2-APB
钙离子在细胞内起到很重要的作用,钙离子与细胞内许多重要过程相关,包括转录因子的激活、细胞的增殖和凋亡、蛋白质的修饰等,可以说生命的整个过程都离不开钙离子的调控。钙离子在生命体内的浓度受到很严密的调控,才能使生命体处于一个较稳定的状态。当钙离子处于紊乱状态,生命体则会发生很多不利的反应。调控钙离子浓度的机制各式各样,而细胞内钙内流主要由SOCE这一过程所介导,即钙库操控性的钙内流。当钙库发生清空时,该过程负责钙内流,从而重新填满钙库。SOCE所介导的钙信号能通过调控NFAT、CREB等的功能,调节很多关键基因的表达水平,进而影响细胞增殖分化,特别是免疫细胞的功能。众多的研究表明,STIM、 Orai的各种同源蛋白、各种亚型及它们介导的SOCE与众多疾病,如人体自免疫疾病、心脏肥大及心率不齐、动脉粥样硬化、肌肉疼痛、各种癌症等密切相关。因此,钙内流的分子机制研究显得格外重要。1986年,Putney[1]在腮腺腺泡细胞(parotid gland acinar cells)上研究钙库清空、钙内流和钙库重新充满三者之间的关系时,首次提出了一个容量性钙内流(capacitative calcium entry)的假说。之后对其机制的相关研究不断取得进展。但是对这一过程的分子机制却一直没有进展。直到RNA干扰技术的出现,找到了在此过程中相关的STIM蛋白[2]和Orai蛋白[3],确定了STIM蛋白在钙库操控性钙内流中的重要地位。本文将对SOCE的研究情况进行简述,以期对今后的研究提供参考。
1 细胞内钙离子信号
细胞内钙离子浓度的变化称为钙信号。而钙离子作为细胞内的第二信使,是一种最为常见的细胞内的信号传递方式,与细胞增殖、分化、凋亡、基因表达、肌肉收缩等多种生命活动密切相关[4]。
正常情况下,细胞处于一个钙离子浓度梯度被严格控制的环境下。细胞处于静息时,细胞质内的钙离子浓度被控制在100 mmol/L左右,而胞外的钙离子浓度约为1~2 mmol/L,胞外的钙离子浓度比胞内的钙离子浓度高10 000倍。胞质内外之间的钙离子浓度梯度差异是钙离子作为细胞内第二信使的前提和重要条件。细胞膜和细胞器膜表面广泛存在一些通道蛋白能参与Ca2+浓度调控, 包括内质网、线粒体等细胞器。与细胞内钙离子浓度调控相关的通道蛋白有很多,包括位于细胞膜上的PMCAs (plasma membrane Ca2+-ATPase),内质网膜上的SERCAs (sarco-endoplasmic reticulum Ca2+-ATPase),高尔基体膜上与分泌途径相关的Ca2+-ATP酶(secretory pathway Ca2+-ATPase, SPCAs)等[5]。
细胞内主要储存钙离子的细胞器为内质网,浓度约为400 μmol/L,而内质网被称为钙库。胞内钙库操纵的钙离子内流(SOCE)是细胞摄取外源钙离子的主要途径之一。而钙库操控性的钙离子通道的激活与内质网中钙离子浓度的减小密切相关。
2 钙库操控性钙内流概述
2.1 钙库操控性钙内流
钙库操控性的钙内流,与钙库内的钙离子浓度密切相关。当钙库内的钙离子减小到一定程度后,会激活钙库操控性的钙通道,引发胞外的钙内流,从而重新补充内质网内的钙离子。在之前的研究中发现,钙库操控性钙内流在非兴奋性细胞中起着更重要的作用[6]。最近的研究发现钙库操作性Ca2+通道广泛存在于兴奋性和非兴奋性细胞中。
钙库操控性的钙内流的产生过程中主要包括两个阶段,一是感受内质网中的钙离子浓度的减小, 二是介导胞外钙离子的内流。随着RNA干扰技术的出现,并应用于细胞内蛋白表达的敲除后,组成SOCE的两个蛋白分子也逐渐被发现。介导这一过程的两个蛋白分子主要是位于内质网上的基质互作蛋白(stromal interaction molecule, STIM)(图1A,彩图见封三图版)和位于细胞膜上的钙离子通道Orai蛋白(图1B)。通过对STIM1蛋白表达的抑制,或是过量表达,以及Orai1蛋白的共表达,这些实验都表明只有两者共同作用才能引发钙库操控性的钙内流。
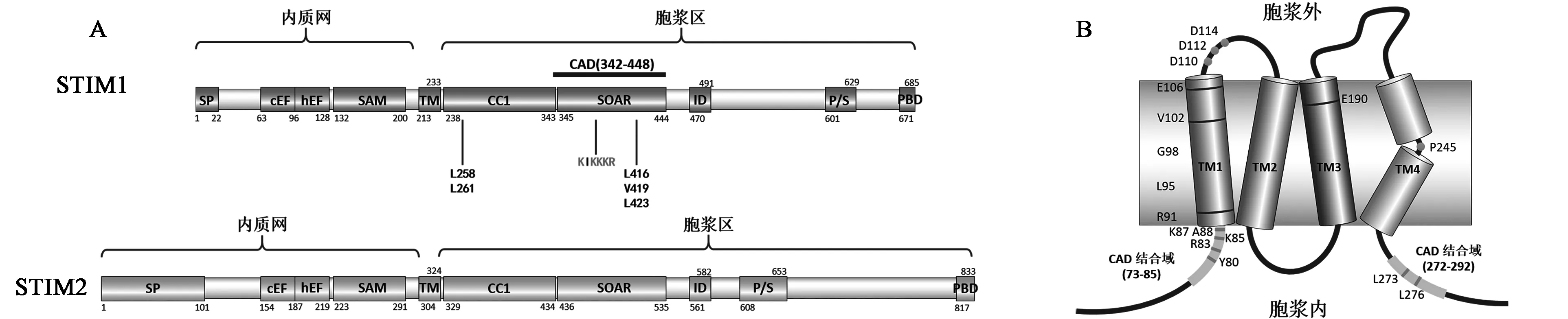
图1 STIM蛋白和Orai1模式图Fig.1 Structure of STIM and Orai.(彩图见封三图版)
从电生理的角度来看,钙库操控性的钙内流通道又称为钙离子释放激活的钙离子通道(Ca2+release-activated Ca2+channel,CRAC),有其独特的电生理图谱[7]。
钙库操控性钙内流的过程具体表述为:在静息状态下, STIM蛋白较均匀地分布在内质网膜上,STIM1蛋白位于内质网中的cEF手性结构域结合充足的钙离子形成EF-hand-SAM结构域[8]。当内质网内的Ca2+浓度较低时,Ca2+从cEF手性结构域中解离,引起EF-hand-SAM结构域的展开,从而使STIM1蛋白构象变化并发生多聚化,并激活位于细胞膜上的Orai蛋白,引发钙内流,从而补充钙库。当钙库内的Ca2+浓度重新升高后, STIM1蛋白快速地与Orai蛋白分离,Orai通道也随之关闭。
2.2 SOCe生理激活途径
生理情况下,储存在内质网的钙离子瞬时释放是通过G蛋白偶联受体或酪氨酸激酶的信号通路所实现的。当第一信使激活上述的通路后,位于细胞膜上的磷脂酶C(phospholipase, PLC)就会被激活。激活的磷脂酶会引起磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol 4,5-biosphosphate,PIP2)的水解,生成第二信使分子1,4,5-三磷酸肌醇(IP3)和二酰基甘油(diacylgycerol,DAG)。而IP3与内质网上的IP3受体结合之后,就会引起内质网中的钙离子释放到胞浆中,从而引起内质网中钙离子浓度的降低,即钙库清空。
在平滑肌细胞的肌浆网膜上,还存在一类 Ca2+释放通道——ryanodine受体[9]。ryanodin受体(RyRs)被细胞膜上的电压依赖性钙离子通道(CaV1.1)所激活,引发钙释放,进而清空钙库,激活SOCE过程。
3 SOCE相关蛋白及相互间的作用
3.1 Orai蛋白及其结构
Orai蛋白是定位于细胞膜上的钙离子通道蛋白,它的开闭情况受到细胞内钙库(内质网或肌浆网)中钙离子浓度的严格调控。人源的Orai家族共有3个成员,包括Orai1、Orai2、Orai3,其中研究最广泛了解最多的为Orai1蛋白。
3种不同亚型的Orai蛋白分子均是定位于细胞膜上的4次跨膜蛋白,其NH2-端和-COOH端均处于细胞内。Orai蛋白的NH2-端有一个钙调蛋白类似的结构域,而-COOH端有多个连续的酸性氨基酸。并且,在钙库中钙离子浓度发生降低之后,3种不同亚型的Orai通道均能与STIM蛋白结合并被激活,从而引发钙内流。
但3种Orai蛋白之间也有所不同。在结构上,Orai1具有更长的NH2-端,而Orai3在胞外的第二个loop结构更长,Orai2的胞外的第一个loop结构与其他两者也有区别。而Orai1和Orai3在胞外的第一个loop结构在酸性氨基酸含量也有所不同,研究表明,当在细胞内共表达Orai1和Orai3时,两者会形成异源二聚体,从而减少通道对钙离子的选择性。在功能上,3个Orai亚型被激活后的表现也有所不同,所产生的CREC电流有一定的差异。对于胞内钙离子浓度上升过程中,通道失活的敏感程度也不同。当细胞质内钙离子浓度达到500 nmol/L时,Orai 1通道基可以被完全抑制,Orai 2通道产生的钙离子内流则被抑制60%,而Orai3通道产生的钙离子内流基本不受影响。3种不同亚型的Orai蛋白在各组织及个体生长的各阶段表达情况都有差异。
人源Orai蛋白分子一共有301个氨基酸,分子量约为33 kDa[10]。Orai分子的C端胞质区主要参与分子的募集。当切除Orai分子的C端时,即使内质网中的钙离子浓度降低,Orai也无法与STIM1结合形成钙内流。同样,Orai分子发生L273S和L276D突变后,Orai与STIM之间的相互作用同样会消失[11]。然而,Orai的C端与STIM作用不足以激活Orai通道,关于Orai的 NH2-端,则主要参与Orai1通道的开放。Orai的第一个跨膜区主要作用是多聚化形成通道,而其他3个跨膜区则主要参与激活信号的传递。
对于Orai蛋白的突变实验,有利于更好地研究Orai蛋白的功能。人源Orai1的第106位Glu突变为Arg(E106A)后,Orai通道则不再通透钙离子;若突变为Asp(E106D),则会影响Orai1对钙离子的选择通透性。若第190位的Glu突变为Asp或者Arg,均对通道功能没有影响;但若突变为Gln(E190Q),通道对Ca2+的选择性就会降低。可以分析这个位点Glu 突变为Asp或是Arg时,对Ca2+的选择性没有影响,但是突变为Gln 后可能会影响蛋白质内的离子键等,从而改变通道高级结构,使其不再能通透钙离子部分[10]。
在人类个体中,若Orai1发生突变,则会引起个体的免疫缺陷等疾病。目前的研究发现,与免疫缺陷相关的突变有3个:R91W、移码突变和A103E/L194P。R91W突变,主要由于第一个跨膜区的第91个氨基酸突变后使Orai1的功能完全消失,从而引起严重的免疫缺陷。移码突变则使Orai无法正常表达,人体内没有完整的Orai蛋白而引发免疫缺陷。存在A103E/L194E突变的人同样无法表达Orai蛋白。因此,研究Orai通道蛋白相关的生理功能研究能为相关疾病的研究和治疗提供理论基础。
3.2 STIM蛋白
STIM蛋白是主要位于内质网上的Ⅰ型跨膜蛋白,含有多个不连续的功能结构域。STIM蛋白的主要功能是感受内质网中钙离子的耗竭,从而发生寡聚化,并于细胞膜上的Orai通道蛋白结合,随后激活Orai引发钙内流,达到重新充满钙库的目的。
STIM蛋白分为STIM1和STIM2两种亚型,两者在氨基酸组成上有很大的相似性,它们在N端高度相似,而在C端的相似性较低。主要以STIM1蛋白为例,介绍STIM蛋白的各个结构域。人源STIM1蛋白有685个氨基酸,主要有N端信号肽(1~22位氨基酸,正确定位后被切除)、EF-hand结构域、SAM结构域、跨膜区(第214~233位氨基酸)、C端多个螺旋卷曲结构域和S/P结构域。STIM1的EF-SAM区主要参与识别内质网中钙离子的浓度变化。当内质网中钙离子浓度处于400 μmol/L以上时,EF-SAM区与钙离子结合,STIM1蛋白处于非激活状态[12];当内质网中蛋白质下降到一定程度后,EF-SAM区不再结合钙离子,从而激活STIM1蛋白,STIM1蛋白发生构象变化,并引起寡聚化后与Orai1蛋白结合引发钙内流。STIM1寡聚化后,在内质网上形成斑块状。STIM1的胞质区主要作用是,在钙库的钙离子被消耗后,STIM1聚集并定位于内质网-质膜间的连接处,并激活Orai通道。与Orai1蛋白结合并激活Orai的STIM1的最小激活片段成为SOAR(STIM1-orai1-activation region),由344~442个氨基酸组成[13]。之前C端胞质区被定义为很多不同的激活片段,包括CAD结构域(氨基酸342~448)。自2009年发现STIM1(344-442)这一片段是能够与Orai发生相互作用并能激活Orai1 的最小片段。通过晶体衍射实验,解析出了SOAR的二级结构,单体的SOAR有4段,α-螺旋形成一个“R”型结构,二聚体的SOAR则由两个“R”型结构反相交叉,形成一个“V”型结构[14]。这一片段中的碱性氨基酸对其激活Orai通道有着巨大意义,当这些碱性氨基酸被突变为中性或酸性时,SOAR结合或是激活Orai的能力都将丧失。SOAR结构域的解析为STIM蛋白激活原理的研究提供了更大的可能性。此外,C端胞质区存在自我封闭区,使非活化状态下的STIM1不能与Orai1结合引发钙内流。最近的文献报道显示,在这种细胞内开关中,在CC1和SOAR之间的相互作用包括在CC1的第一个α螺旋结构的第258位和261位的亮氨酸和分别位于SOAR的第4个α螺旋上的第419位的缬氨酸和第416位亮氨酸之间的相互作用[15]。两者之间的相互作用决定着STIM1自身的折叠与解折叠的状态。
STIM2亚型含有833个氨基酸。STIM2激活Orai1的能力明显弱于STIM1,即引发的CRAC电流小于STIM1[16]。但STIM2感受内质网内钙离子变化的敏感性强于STIM1,从而使STIM2更容易激活Orai。STIM1和STIM2中SOAR结构域在氨基酸组成上有所不同,这些不同决定了它们激活Orai1能力的不同。SOAR1所引发的Orai1通道的钙内流要大于SOAR2,说明SOAR2激活Orai1的能力比SOAR1更弱。有文献报道,将SOAR1和SOAR2不同的3个α-螺旋进行交换,进行钙信号和FRET的实验[17]。通过对比交换的α-螺旋,找出了SOAR结构域中与Orai1的激活相关的重要位点,即SOAR-F394。
STIM1和STIM2蛋白在定位上有所不同。有75%~85%的STIM1蛋白位于内质网,而其他的STIM1蛋白位于细胞膜上[18]。相对的,STIM2由于存在更长的信号肽,使得STIM2没有在细胞膜上的定位。位于内质网上的蛋白参与SOCE的激活,而位于细胞膜上的STIM1蛋白参与Orai3的持续激活,并且不依赖于钙库的清空。
STIM1蛋白与许多疾病密切相关。STIM1蛋白的突变、缺失或提前终止,同样会引发严重的免疫缺陷。当STIM1蛋白表达缺陷时,T细胞的增殖受到影响,且T细胞的功能也受到损害。在肿瘤的相关研究中发现,STIM蛋白的增高会促进癌细胞的增殖;而敲除STIM蛋白则会减少癌细胞的增殖[19]。
同时,STIM蛋白在心血管疾病方面也有很多相关研究。其中有研究动脉血栓与STIM蛋白的关系[20]。血小板与动脉血栓形成有很大关系。当细胞内钙离子水平上升后,血小板开始被激活和聚集。而钙库操控性的钙内流主要引发钙离子向胞内流动,因此和血小板的活化密切相关。在小鼠中敲除STIM1,小鼠表现为更高的致死率和明显的发育迟缓。并且敲除STIM1小鼠的血小板的黏着力减弱,血栓体积减小。因此,STIM蛋白与血栓的形成有很大作用。
3.3 STIM1与Orai1间的作用
目前的研究表明,Orai通道为六聚体,由6个Orai单体组成。Orai的6个第一跨膜区形成了通道。因为STIM1是以二聚体形式存在,所以猜想每个Orai单体与2个STIM1蛋白形成的二聚体结合作用,则一个Orai通道的激活需要12个STIM1单体。通过对STIM1和荧光蛋白的融合表达,可以发现STIM1被激活后在内质网呈现斑块状。
STIM1与Orai1相互作用的位置位于内质网-质膜连接处(ER-PM junction)。内质网-质膜连接处的宽度范围在10~17 nm之间,在细胞的静息状态下,主要的内质网-质膜连接处已经预先存在,而当内质网清空后,内质网-质膜连接处的数量就会增多。在内质网-质膜连接处存在很多蛋白,其中可能存在对STIM和Orai蛋白间相互作用的调节因子[21]。
STIM-Orai复合体在感受到钙离子上升后即会失活,这一现象称为钙依赖性的失活(Ca2+-dependent inactivation,CDI)。STIM蛋白胞浆区有一个抑制结构域氨基酸(470-491)称为抑制域(inhibitory domain,ID),这一区域含有丰富的酸性氨基酸,对于CDI是必需的。内质网内的钙离子对STIM-Orai复合体的聚合和解离起主导作用。
4 2-APB对SOCE的作用
2-APB是一种被广泛认可的作用于CARC的分子,且具有复杂的药理性。在淋巴T细胞、B细胞和巨噬细胞中的天然CARC通道,2-APB会引起复杂的反应。2-APB在低浓度时,可多倍增强ICARC,而高浓度的2-APB则先短暂升高后被抑制[22]。和2-APB在高浓度时缓慢发展的抑制作用相同,2-APB同样可导致ICARC钙离子依赖的快速失活。这些反应不但使2-APB作为未来药物发展的基础成为可能,2-APB作用于CRAC通道蛋白使之激活或者失活这一重要特性也可以帮助理解CRAC通道蛋白如何受控制。尽管2-APB被广泛用于钙信号领域的研究,但是2-APB作用于CRAC通道的分子机制却仍然知之甚少。
5 展望
Ca2+作为细胞内重要的第二信使,其与细胞中各种胞内信号途径的调控有关。在静息状态下, 胞内的Ca2+浓度与胞外的Ca2+浓度差为钙离子作为信号提供可能。参与Ca2+浓度调控的通道蛋白广泛存在于细胞内的各部分, 包括细胞膜、内质网和线粒体等。这些通道蛋白主要完成两种功能, 一是使胞外的钙离子流入胞内, 二是使细胞内的钙库释放入胞浆。钙库操作性钙内流 (store-operated calcium entry, SOCE)是介导胞外Ca2+进入细胞内的重要通道之一, 其过程由位于内质网上的STIM蛋白和细胞膜上的Orai通道蛋白构成。钙库操作性钙离子通道广泛存在于非兴奋性细胞膜上,在一些兴奋细胞中也有非常重要的作用,与胞外钙离子内流有着重大的关系。
STIM1与Orai1之间的激活机理十分复杂,至今并未研究透彻。但对于STIM1及Orai1的功能结构域的研究有很多。通过研究清楚STIM1和Orai1的激活机制,从而为SOCE的生理功能提供理论基础。而对于SOCE的生理功能仍有待进一步研究,以期为各种疾病的治愈提供可能性。
[1] Putney J W J. A model for receptor-regulated calcium entry[J]. Cell Calcium, 1986, 7(1):1-12.
[2] Liou J, Kim M L, Heo W D,etal.. STIM is a Ca2+sensor essential for Ca2+-store-depletion-triggered Ca2+influx[J]. Curr. Biol., 2005, 15(13):1235-1241.
[3] Zhang S L, Yeromin A V, Zhang X H,etal.. Genome-wide RNAi screen of Ca2+influx identifies genes that regulate Ca2+release-activated Ca2+channel activity[J]. Proc. Natl. Acad. Sci. USA, 2006, 103(24):9357-9362.
[4] Clapham D E, Calcium signaling[J]. Cell, 2007, 131(6):1047-1058.
[5] Berridge M J, Bootman M D, Roderick H L. Calcium signalling: Dynamics, homeostasis and remodelling[J]. Nat. Rev. Mol. Cell Biol., 2003, 4(7):517-529.
[6] Salido G M, Sage S O, Rosado J A. Biochemical and functional properties of the store-operated Ca2+channels[J]. Cell Signal, 2009, 21(4):457-461.
[7] Hoth M, Penner R. Depletion of intracellular calcium stores activates a calcium current in mast cells[J]. Nature, 1992, 355(6358):353-356.
[8] Demaurex N, Frieden M. Measurements of the free luminal ER Ca2+concentration with targeted "cameleon" fluorescent proteins[J]. Cell Calcium, 2003, 34(2):109-119.
[9] Fellner S K, Arendshorst W J. Store-operated Ca2+entry is exaggerated in fresh preglomerular vascular smooth muscle cells of SHR[J]. Kidney Int., 2002, 61(6):2132-2141.
[10] Prakriya M, Feske S, Gwack Y,etal.. Orai1 is an essential pore subunit of the CRAC channel[J]. Nature, 2006, 443(7108):230-233.
[11] Muik M, Frischauf I, Derler I,etal.. Dynamic coupling of the putative coiled-coil domain of ORAI1 with STIM1 mediates ORAI1 channel activation[J]. J. Biol. Chem., 2008, 283(12):8014-8022.
[12] Stathopulos P B, Zheng L, Li G Y,etal.. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry[J]. Cell, 2008, 135(1):110-122.
[13] Yuan J P, Zeng W, Dorwart M R,etal.. SOAR and the polybasic STIM1 domains gate and regulate Orai channels[J]. Nat. Cell Biol., 2009, 11(3):337-343.
[14] Yang X, Wu F, Lin X,etal.. Live and let die —— the B(sister) MADS-box gene OsMADS29 controls the degeneration of cells in maternal tissues during seed development of rice (Oryzasativa)[J]. PLoS ONE, 2012, 7(12):e51435.
[15] Ma G, Wei M, He L,etal.. Inside-out Ca2+signalling prompted by STIM1 conformational switch[J]. Nat. Commun., 2015, 6:7826.
[16] Parvez S, Beck A, Peinelt C,etal.. STIM2 protein mediates distinct store-dependent and store-independent modes of CRAC channel activation[J]. FASEB J., 2008, 22(3):752-761.
[17] Wang X, Wang Y, Zhou Y,etal.. Distinct Orai-coupling domains in STIM1 and STIM2 define the Orai-activating site[J]. Nat. Commun., 2014, 5:3183.
[18] Soboloff J, Spassova M A, Hewavitharana T,etal.. STIM2 is an inhibitor of STIM1-mediated store-operated Ca2+entry[J]. Curr. Biol., 2006, 16(14):1465-1470.
[19] Capiod T. The need for calcium channels in cell proliferation[J]. Recent Pat. Anticancer. Drug Discov., 2013, 8(1):4-17.
[20] Varga-Szabo D, Braun A, Kleinschnitz C,etal.. The calcium sensor STIM1 is an essential mediator of arterial thrombosis and ischemic brain infarction[J]. J. Exp. Med., 2008, 205(7):1583-1591.
[21] Treves S, Franzini-Armstrong C, Moccagatta L,etal.. Junctate is a key element in calcium entry induced by activation of InsP3 receptors and/or calcium store depletion[J]. J. Cell Biol., 2004, 166(4):537-548.
[22] Ma H T, Venkatachalam K, Parys J B,etal.. Modification of store-operated channel coupling and inositol trisphosphate receptor function by 2-aminoethoxydiphenyl borate in DT40 lymphocytes[J]. J. Biol. Chem., 2002, 277(9):6915-6922.
Progress on Store Operated Calcium Entry
ZHENG Sisi, XIANG Nan, ZHAO Fukuan*
CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China
Store operated calcium entry (SOCE) is an important calcium influx process in cells, which mediates extracellular Ca2+into cell. SOCE also participates in many intracellular physiological process. In these processes, SOCE is mediated by STIM (stromal interaction molecule) protein and Orai calcium channels. In this review, recent progresses regarding SOCE were discussed, and the future research direction were prospected, which was expected to provide reference for related research.
SOCE; STIM; Orai; 2-APB
2016-11-16; 接受日期:2016-12-14
国家自然科学基金项目(31171952)资助。
郑思思,硕士研究生,研究方向为细胞培养与代谢工程。E-mail: Shirley7474@7474.com。*通信作者:赵福宽,教授,博士,研究方向为细胞培养与代谢工程。E-mail:zhaofukuan@sina.com
10.3969/j.issn.2095-2341.2017.02.07
