农用乙酰胆碱酯酶抑制剂研究进展
2017-03-31李梦怡邵文华师光禄卜春亚
李梦怡, 彭 博, 李 博, 邵文华, 杨 金, 付 欣, 师光禄, 卜春亚*
1.北京农学院生物科学与工程学院, 北京 102206;2.北京农学院, 农业部华北都市农业重点实验室, 北京 102206
农用乙酰胆碱酯酶抑制剂研究进展
李梦怡1,2, 彭 博2, 李 博1,2, 邵文华1,2, 杨 金1,2, 付 欣1,2, 师光禄1,2, 卜春亚1,2*
1.北京农学院生物科学与工程学院, 北京 102206;2.北京农学院, 农业部华北都市农业重点实验室, 北京 102206
乙酰胆碱酯酶(AChE)在生物神经传导中起着至关重要的作用,其主要功能是迅速水解胆碱部位的神经递质乙酰胆碱(ACh),终止神经冲动的传递。有机磷和氨基甲酸酯类杀虫剂是最常见的AChE抑制剂,虽然对灭虫起到很大的作用,但是同时也会对人、哺乳动物等非靶标生物造成危害,所以需要研制出一种高效的、针对害虫的乙酰胆碱酯酶抑制剂。综述了有机磷和氨基甲酸酯类、部分生物碱类抑制剂,以及一些选择性的新型乙酰胆碱酯酶抑制剂的研究进展,以期为安全的乙酰胆碱酯酶抑制剂的研制提供参考。
乙酰胆碱酯酶;有机磷;氨基甲酸酯;生物碱类;选择性抑制剂
乙酰胆碱酯酶(acetylcholinesterase,AChE,EC3.1.1.7)属于丝氨酸水解酶,其主要生理功能是快速水解蓄积在神经元和神经肌肉接头处的神经递质乙酰胆碱(acetycholine,ACh),终止ACh对突触后膜的兴奋作用,确保神经信号的正常传递。近几年AChE的研究已经涉及医学、化学、农药和植物保护等方面。
乙酰胆碱酯酶是占农药市场较大比重的有机磷类和氨基甲酸酯类杀虫剂的主要作用靶标。这类杀虫剂的作用机理是与AChE活性位点的丝氨酸残基形成共价键,使乙酰胆碱酯酶失活,导致ACh在胆碱能神经末梢堆积产生拟胆碱作用,抑制正常的神经转导,从而使整个生理生化过程失调,并受到破坏,最终造成昆虫的死亡。AChE抑制剂还可以用于治疗阿尔茨海默症、重症肌无力和青光眼等疾病。人畜等的AChE活性位点处都存在丝氨酸残基位点,所以该类杀虫剂的施用对哺乳动物也存在一定的毒性[1]。有机磷和氨基甲酸酯类这两种抑制剂虽然在防治害虫的过程中取得了一定的成效,但是也对哺乳动物特别是胎儿造成了一定程度的伤害。合理的抑制剂可以避免害虫抗药性和预防病虫害的发生,提高杀虫剂的环保性能,因此研制高效安全、针对害虫靶点作用的乙酰胆碱酯酶抑制剂有助于提高灭虫效率,并且将对哺乳动物等非靶标生物的伤害降到最低。本文将简要介绍乙酰胆碱酯酶的分子结构和主要功能,以及常见的有机磷类和氨基甲酸酯类AChE抑制剂、生物碱类AChE抑制剂以及新型AChE抑制剂等的研究进展,以期为安全的乙酰胆碱酯酶抑制剂的研制提供参考。
1 乙酰胆碱酯酶的结构和功能
1.1 乙酰胆碱酯酶的结构
AChE是一种多分子型糖蛋白,不同种属的一级结构差异较大,不同生物组织和器官中的AChE,根据分子形状可分为球形(对称型)和尾型(不对称型)两种不同的分子形式[2]。乙酰胆碱酯酶首次被报道是1991年,Sussman等[3]绘制出电鳐(Torpedocalifornia)乙酰胆碱酯酶催化基团的晶体结构X射线衍射图谱。从而确定了AChE的三维空间结构。根据三维结构图发现了AChE中有一条通向酶活性中心深而窄的峡谷,长约2 nm,包含各种活性位点。AChE的活性中心主要有3个区域:酯解部位、疏水性区域和阴离子部位[4]。电鳐AChE活性位点示意图见图1[5],活性口袋深度约为酶分子的一半,袋内大部分被芳香族氨基酸残基占据,这些残基与周围的序列都是高度保守的[6]。
AChE的活性位点如图1所示,主要有:①催化三联体(esteratic site):由Ser200、His440和Glu327组成,位于活性峡谷底部附近,是AChE的活性中心和抑制剂的键合位点;②外周阴离子位点(peripheral anionic site,PAS):主要由一些带负电的氨基酸组成,位于活性峡谷的边缘处,是ACh首先与AChE结合的部位;③酰基口袋(acyl pocket):由2个苯丙氨酸残基Phe288和Phe290组成,它们的侧链延伸向活性中心,昆虫AChE的酰基口袋与脊椎动物的相比更大,可以水解底物的酰基部分;④氧阴离子洞(oxyanion hole):由Gly118、Gly119、Ala201的主链碳原子和羰基氧之间的相互作用,以及酯键氧和His440咪唑基之间的相互作用组成[7]。
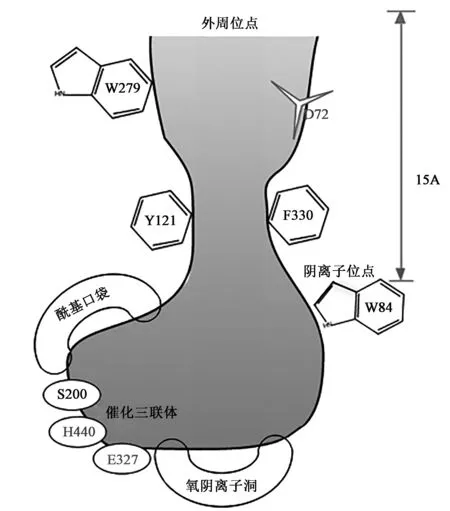
图1 电鳐AChE的活性位点结构示意图[5]Fig.1 The structure of the enzyme active site of electric ray’s acetylcholinesterase[5].
1.2 乙酰胆碱酯酶的功能
生理条件下,定位于突触后膜的AChE发挥其“经典”功能,主要是催化水解ACh,使ACh对突触后膜的兴奋作用终止。AChE的经典功能中,AChE分三步水解ACh,第一步AChE的外周阴离子部位通过静电引力与ACh带正电的季铵阳离子头结合,同时AChE酶解部位的丝氨酸羟基以共价键形式与ACh的羰基碳结合;第二步ACh-AChE复合物裂解,成为乙酰化的AChE和胆碱;第三步乙酰化的AChE迅速水解分离出乙酸,之后酶的活性恢复[8]。乙酰胆碱酯酶抑制剂与ACh类似,与AChE结合,使AChE活性受到抑制,从而导致ACh在胆碱能在神经末梢堆积,产生拟胆碱作用。
现在普遍认为AChE主要有3种催化机制:第一种是由芳香环引导机制:活性口袋内侧排列着14个疏水的芳香族氨基酸残基,这些氨基酸位于保守的环状区域,这个疏水区可能便于ACh进入活性中心。第二种机制是酶外周结合区引起的抑制作用:一些体积较大或者性质不同的配体无法进入峡谷,但是如果在外周结合区与AChE结合,可以通过阻塞峡谷入口处的一部分来起到抑制作用。第三种机制是后门开放机制,在Trp84附近可能存在一个瞬间开放的通路,是底物或产物进出峡谷的另一条通道[9]。
除了在神经细胞中,AChE还有一些其他功能,比如生成神经突触、细胞增殖、细胞凋亡以及黏附等。现在关于AChE的其他功能的研究报道越来越多,但是大部分功能的具体机制目前尚不清楚,但是越来越多的报道将帮助研究者了解AChE更丰富的功能。
2 AChE抑制剂
乙酰胆碱酯酶抑制剂的主要来源有化学合成和天然产物,而天然产物则是这种抑制剂的重要来源,其中植物来源的主要有生物碱类和萜类,此外还有部分来源于真菌和动物[10]。
2.1 有机磷和氨基甲酸酯类
乙酰胆碱酯酶是有机磷和氨基甲酸酯类的作用靶点,这两类是最常用的乙酰胆碱酯酶抑制剂。有机磷除了能和AChE活性位点结合使其失活以外,还可能对线粒体呼吸链中与呼吸以及能量代谢有关的酶产生影响,并且与乙酰胆碱酯酶结合的因素综合起来阻断神经递质的正常传递[11,12]。这两类抑制剂确实起到了显著的杀虫作用效果,但是同时也带来了农药残留的问题,继而引发一些新的问题如伤害到人、哺乳动物等非靶标性生物,而且一些害虫已对这两类杀虫剂产生抗药性,如马来西亚蚊虫乙酰胆碱酯酶发生位点突变对氨基甲酸酯类产生了抗药性[13]。于是,相关研究人员便研制出越来越多的农药残留检测方法,如基于重组乙酰胆碱酯酶的农药检测方法,相比传统的农药检测方法速度快、稳定性强、灵敏度高[14];还有研究人员构建出一种化学发光生物传感器检测农作物和食品中有机磷和氨基甲酸酯类的残留量[15]。
2.2 生物碱类
2.2.1 石杉碱甲(huperzine A) 石杉碱甲(huperzine,Hup A)是一种倍半萜生物碱,源于蕨类植物蛇足石杉,于1980年首次从石杉科植物中被分离出来,是高效、高选择性、可逆的AChE抑制剂,也是我国开发的最成功和最有前途治疗AD的药物。也是一种很强的乙酰胆碱酯酶抑制剂并且可用来治疗重度抑郁症。研究发现,在重度抑郁症辅助治疗过程中,石杉碱甲A有助于快速缓解经常伴随重度抑郁症的认知症状[16]。石杉碱甲与AChE活性部位水解较慢,使AChE活性受到抑制,产生拟胆碱作用,对乙酰胆碱酯酶具有竞争性抑制和非竞争性抑制的混合抑制作用[17]。


图2 石杉碱甲与AChE活性位点的相互作用[18]Fig.2 The interaction of huperzine A and the enzyme active site of acetylcholinesterase[18].(彩图见封三图版)
2.2.2 毒扁豆碱(physostigmine) 毒扁豆碱是1864年从毒扁豆的种子中首次分离获得的,是最先发现的抗胆碱酯酶药物,源于属于毒扁豆子种子的生物碱类,这种抑制剂的特点是非选择性且可逆,其结构式见图3。
毒扁豆碱的主要作用是抑制G1和G4 AChE的形成[19],易于吸收和透过血脑屏障,因为毒性大、半衰期较短,所以不能成为临床应用药[20]。毒扁豆碱通过其氨甲酰部分以及胺基部分与AChE的酯解部分结合达到抑制AChE活性的作用[20,21]。

图3 毒扁豆碱结构式Fig.3 The structural formula of eserine.
2.2.3 加兰他敏(galanthamine) 加兰他敏是一种生物碱,来源于石蒜科雪花莲属,是具有选择性和竞争性的乙酰胆碱酯酶抑制剂,它能够通过控制胆碱酯酶的量来调节类胆碱酯的系统,结构式如图4所示。加兰他敏能刺激烟碱受体,提高胆碱功能和记忆,其疗效与他克林相似,稍弱于毒扁豆碱,有效时间长。加兰他敏除了应用于精神疾病和神经疾病方面,还可应用于眼病的治疗甚至免疫方面[22]。
加兰他敏与AChE结合方式和石杉碱甲类似,结合在AChE结构向内凹陷的又深又窄的口袋处[23]。有研究报道,加兰他敏主要作用于人AChE和Tc-AChE的催化位点[24,25];加兰他敏的-OH与AChE的Glu199之间形成氢键;环己烯与AChE的Trp84形成P-P键[26];对加兰他敏的N-末端烷基化的修饰有利于其接近AChE催化位点的底部[27]。

图4 加兰他敏结构式Fig.4 The structural formula of galantamine.
2.2.4 斯替宁碱乙(stenine B)和斯替宁碱(stenine) 斯替宁碱乙和斯替宁碱分别是一种从百部根部提取出的一类生物碱,二者是非对应异构体,且都具有较强的抗AChE活性,IC50分别为2.1 μmol/L和19.8 μmol/L。
对斯替宁碱乙进行分子对接研究,如图5(彩图见封三图版)所示,它与AChE内部的Trp 84有相互作用,同时斯替宁碱乙的内酯环上的氧和Tyr130的羟基形成了一条氢键。该化合物与AChE的结合与石杉碱甲类似,它是AChE可逆的竞争性抑制剂[9]。

图5 斯替宁碱乙与AChE的分子模拟复合体Fig.5 Molecular structure simulate complex of stenine B and acetylcholinesterase.(彩图见封三图版)
2.2.5 夹竹桃科总生物碱 在夹竹桃科(Apocynaceae)狗牙花属(Ervatamia)海南狗牙花(Ervatamiahainanensis)的茎中分离出了8种生物碱,实验发现狗牙花碱和老刺木精对AChE的抑制活性较强[28]。狗牙花(Ervatamiadivaricata)的根茎提取物中分离出了4种双吲哚生物碱,实验发现19,20-二氢山马茶明碱和19,20-二氢海南狗牙花碱对AChE的抑制活性较强,分别是加兰他敏的2倍和8倍[29]。夹竹桃科长春花属(Catharanthus)长春花(Catharanthusroseus)的根部提取物蛇根碱对AChE具有很强的体外抑制活性,其活性是毒扁豆碱的10多倍[30]。
2.2.6 苄基异喹啉类生物碱 在蒺藜科(Zygophyllaceae)骆驼蓬属(Peganum)骆驼蒿(Peganumnigellastrum)种子的甲醇提取物中分离出了8种生物碱,它们都对AChE具有较强的抑制活性,骆驼蓬碱、二氢骆驼蓬碱、骆驼蓬醇和哈尔满的活性与加兰他敏相当[31]。在芸香科(Rutaceae)类药芸香属植物中分离出的喹啉酮型生物碱对AChE有较强的抑制活性[32]。以上几种对AChE有较强抑制作用的生物碱的结构、与AChE结合方式和作用机制还有待于进一步的研究。
2.2.7 甾体类和三萜类生物碱 甾体类生物碱是生物碱中结构最复杂的一类。黄杨科柳叶野扇花(Sarcococcasaligna)中分离出18个甾体类生物碱[33],其中6种对AChE有较强的抑制性,与毒扁豆碱相当。而在从柳叶野扇花(Sarcococcasaligna)中分离到的7个甾体类生物碱中,仅有化合物2,3-dehydrosarsalignone、16-dehydrosarcorine和salignarine-C对AChE的活性有显著的抑制力,与加兰他敏的抑制活性的能力相当,但其他分离出的化合物抑制能力较弱,但这7种化合物对丁酰胆碱酯酶BChE有较强的抑制能力。
2.2.8 双白术内酯 Xie等[34]从烘干的白术的根茎乙酸乙酯提取物中用多步色析法分离出双白术内酯,并且已通过核磁H谱和C谱确认了其结构。双白术内酯对AChE的半抑制浓度是6.545 8 μg/mL,而作为对照的石杉碱甲的IC50是0.019 2 μg/mL。分子对接软件是用来通过常用的分子对接方法来寻找双白术内酯与AChE蛋白之间的分子作用位点,而在一个以剂量为变量的实验中,双白术内酯对小鼠的胚胎纤维细胞的AChE的表达具有下调作用。该结果证实了双白术内酯对AChE抑制作用的分子机制不仅需要与AChE结合,而且需要通过抑制GSK3β的活性来抑制AChE的表达。
2.2.9 其他 Fadaeinasab等[35]从80余种中国药用植物中提取出甲醇、二氯甲烷以及一些含水的粗提物,并且运用了Ellman比色法测定了其体外抑制AChE活性的能力。小檗类植物黄连和黄柏的3种提取物包含了大量异喹啉,对AChE有较强的抑制能力。实验发现,黄连的甲醇水提取物的抑制AChE活性能力是加兰他敏的100倍。黄连素、黄连碱和巴马亭这几种生物碱共同作用可增加AChE的抑制效果。由此可以看出,传统的中国药用植物可通过它们生产的几种不同的次生代谢产物共同作用来增加AChE的抑制效果。而杨忠铎等[36]2011年从采集到的22种甘肃文县和舟曲的植物中的总生物碱中筛选具有乙酰胆碱酯酶抑制功能的提取物,其中弯柱唐松草(ThalictrumuncinulatumFranch)、刺柄南星(ArisaemaaspeiatumN. E. Brown) 等8种植物的乙酰胆碱酯酶抑制性较强。
2.3 珊瑚菌提取物对乙酰胆碱酯酶的抑制作用
海洋微生物的生活环境较为特殊(高盐、高压、低氧、低温等),所以这些微生物能产生结构特殊、活性特异的次级代谢产物。其中,已有报道珊瑚产生的珊瑚菌具有抗菌、抗氧化、酶抑制以及抗肿瘤作用。2015年,班海峡等[37]从徐闻珊瑚保护区的珊瑚中分离出43种珊瑚菌,并研究其对乙酰胆碱酯酶的活性抑制作用。实验发现,当被测的珊瑚礁真菌发酵液乙酸乙酯萃取物的浓度为1 mg/mL时,有23株菌表现为酶抑制活性,其中8株活性抑制力较强,表明珊瑚海洋真菌提取物有潜在的抗乙酰胆碱酯酶的能力。
2.4 绿僵菌对东亚飞蝗乙酰胆碱酯酶活性的抑制作用
绿僵菌(Metarhiziumanisopliae) 是具有广泛杀虫谱的一类生防真菌。绿僵菌主要通过两种途径侵染昆虫:一种是通过体壁侵染,另一种则是在昆虫取食的过程中绿僵菌通过消化道侵染。研究表明,绿僵菌IPPM202在侵染东亚飞蝗后,乙酰胆碱酯酶活性有显著的变化,即先上升后下降(不明显)然后又上升,只是后期无法上升到开始的水平[38]。根据结果判断,绿僵菌侵染东亚飞蝗后,刺激肠内生理生化反应,乙酰胆碱酯酶水平提高,阻断虫体神经传导。随着绿僵菌在虫体内分泌物增多,乙酰胆碱酯酶的活性下降,从而一定程度上抑制了AChE的活性,达到灭虫作用。
2.5 4-吡啶基噻唑-2-胺衍生物
除了植物中提取,或者自然界的菌类作抑制剂以外,还有一些人工合成的化合物具有抑制乙酰胆碱酯酶活性的作用。2016年,曹婷婷等[39]合成了4-吡啶基噻唑-2-胺的一些衍生物,共10个化合物。其中有7个化合物具有一定的体外AChE的抑制作用。从本实验看出,化合物的抑制能力取决于其官能团,当待测化合物所连的二级胺为四氢吡咯和哌啶时,乙酰胆碱酯酶活性抑制能力较强。
3 新型乙酰胆碱酯酶抑制剂
自从高效的化学合成农药问世以来,其在防治农、林、卫等有害生物中大量而长期使用,不仅造成农药残留、农药抗性、再复活问题,还引起了环境污染、生态系统被破坏、食品安全等一系列问题。鉴于此,寻找和开发高效、低毒、低残留、快速降解的新型农药已成为当前最重要的研究课题之一[40]。对有益生物毒性小、低残留,且易降解、具有广谱杀虫活性的新型农药是今后的发展趋势。
近年来美国环境保护协会提出一些有机磷和氨基甲酸酯类杀虫剂,会进入胎儿和儿童的大脑,影响发育中的神经系统,因此研制出害虫特有的保守AChE活性位点靶标的新的杀虫剂迫在眉睫。2009年Pang等[41]报道了含甲烷硫代磺酸的小分子在6.0μmol/L时可以抑制麦二叉蚜AChE的活性,并且没有检测到对人AChE的抑制作用,通过研究发现该分子作用于AChE活性位点处的半胱氨酸残基处,能够不可逆的抑制95%的非洲疟蚊AChE活性,80%的埃及伊蚊和尖音库蚊的AChE活性,对人AChE有较好的选择性。在2007年Pang[42]报道了麦二叉蚜和英国麦长管蚜AChE活性位点处的半胱氨酸残基是哺乳动物AChE所没有的,因此该氨基酸残基可以作为新的安全的特异性杀虫剂靶点。2010年Gregory等[43]报道了含甲烷硫代磺酸的小分子对蟑螂、面象虫、彩色瓢虫、臭虫和黄蜂的AChE有抑制作用,对哺乳动物、鸟类和鱼类的毒性较低。2016年Dorothea等[44]报道了苯氧乙酰胺类化合物对蚊虫的乙酰胆碱酯酶活性的抑制能力是人类哺乳动物乙酰胆碱酯酶抑制能力的100倍,结构选择性抑制可归因于酶的3D结构,选择性的不同是由两个影响整个酶活性结构的环的不同决定的[44]。卜春亚课题组[45~47]克隆了朱砂叶螨AChE基因,构建了螨AChE结构,发现了一些潜在的螨特有的杀螨剂作用靶点,并进行了选择性杀螨化合物的筛选,获得了几个有较好特性的杀螨化合物。
昆虫和哺乳动物的AChE的催化特性和抑制动力学可能存在很多的区别,甚至一种昆虫的两个AChE也可能存在明显的差别,这些差别为研制出更多的选择性杀虫剂提供了可能性。
4 展望
防治害虫一直是农业上的一个重点问题。有机磷类、氨基甲酸酯类是最常用的两类乙酰胆碱酯酶抑制剂,并且在防治害虫上确实有一定的成效,但同时也存在副作用。这些抑制剂既能起到灭虫作用,同时也会给人类及哺乳动物带来不同程度的危害。另外,随着同样的杀虫剂使用时间的增长,害虫也容易产生抗药性,使得抑制剂失效,所以除了这两类常用的抑制剂以外,人们不断在寻找其他种类的抑制剂。
从植物中分离到的生物碱类杀虫剂对害虫有较好的防治作用,是一类高效安全的生物农药。注重可持续发展地现代农业中,研制并开发生物碱类杀虫剂,尤其是对人畜无害的选择性杀虫剂尤为迫切。深入研究生物碱类化合物的杀虫机制和作用的靶位点,可以指导合成具有新的选择性靶位点的杀虫剂。一些生物碱类化合物在昆虫体内作用于乙酰胆碱酯酶,影响昆虫的神经系统,从而毒杀昆虫。因此了解一些生物碱类化合物对昆虫乙酰胆碱酯酶作用的靶位点,筛选出对人畜无害的选择性乙酰胆碱酯酶抑制剂,而这种选择性抑制剂将会在杀虫剂方面有良好的应用前景。富含生物碱的植物种类繁多,资源丰富,易于人工栽培和研究,在当今贯彻执行“有害生物综合治理”中,有望研发出新型生物碱类害虫控制剂。
除了生物碱类乙酰胆碱酯酶抑制剂,急需寻找高效安全的,针对害虫特有靶点的抑制剂。前文提到传统的抑制剂在消灭害虫的同时也常会对哺乳动物及人类造成危害,因此需要研究出能抑制害虫乙酰胆碱酯酶活性,而对其他生物乙酰胆碱酯酶影响较小的抑制剂。近些年来,研究发现一些抑制剂对一些害虫乙酰胆碱酯酶活性的抑制程度远远大于对其他生物的乙酰胆碱酯酶活性。这种新型的乙酰胆碱酯酶抑制剂除了对害虫针对性强,同时也需要低毒、低残留以及降解性强,是现在急需的一种较为理想的农用乙酰胆碱酯酶抑制剂。
[1] Pang Y P. Species marker for developing novel and safe pesticides[J]. Bioorgan. Med. Chem. Lett., 2007,17(1):197-199.
[2] 姜 爽,张英鸽.乙酰胆碱酯酶的构效关系研究进展[J].生物技术通讯,2005,16(5):563-566.
[3] Sussman J L, Harel M, Frolow F,etal.. Atomic structure of acetylcholinesterase from torpedo californica: A prototypic acetylcholine-binding protein[J]. Science,1991,253(5022):872-879.
[4] 徐恩斌,张忠兵,谢渭芬. 乙酰胆碱酯酶的研究进展[J].国外医学生理(病理科学与临床分册), 2003,23(1):73-75.
[5] Dvir H, Silman I, Harel M,etal.. Acetylcholinesterase: From 3D structure to function[J]. Chemico. Biol. Interact.,2010,187(1-3):10-22.
[6] Xu Y, Colletier J P, Weik M,etal.. Flexibility of aromatic residues in the active-site gorge of acetylcholinesterase: X-ray versus molecular dynamics[J]. Biophys. J.,2008,95:2500-2511.
[7] 周伯儒,卢慧甍,曹慧玲,等.乙酰胆碱酯酶分子研究进展[J].生物技术通讯, 2012,23(1):148-152.
[8] 张 千,王取南.乙酰胆碱酯酶生物功能的研究进展及其应用[J].国外医学卫生学分册,2008,35(3):143-147.
[9] 赖东海.植物中生物碱类乙酰胆碱酯酶抑制剂的研究[D]. 兰州:兰州理工大学,硕士学位论文,2012.
[10] 楼影涵,査晓明,张莉莉,等.来源于天然产物的乙酰胆碱酯酶抑制剂研究进展[J].药学进展,2012,36(9):385-393.
[11] 王志超,康志娇,史雪岩,等.有机磷类杀虫剂代谢机制研究进展[J].农药学学报,2015, 17(1) : 1-14
[12] 赵 敏,陈良宏,张志刚,等.有机磷农药中毒机制和治疗新进展[J].中国实用内科杂志, 2014,34(11):1064-1068.
[13] Mutunga J M, Chen Q H,Wong D M,etal.. Bivalent carbamates as novel control agents of the malaria mosquito, anopheles gambiae[J]. CHIMIA Int. J. Chem., 2016,70(10):704-708.
[14] 彭少杰,吴卫平,赵宇翔,等. 基于重组乙酰胆碱酯酶的有机磷和氨基甲酸酯类农药残留快速检测方法的应用验证[J]. 中国卫生检验杂志,2010,20(7):1636-1638.
[15] 王晓朋,曾 梅,万德慧,等. 化学发光生物传感器法测定食品中有机磷与氨基甲酸酯类农药残留[J]. 食品安全质量检测学报,2014,5(12):4163-4171.
[16] Zheng W, Xiang Y Q, Ungvari G S,etal.. Huperzine A for treatment of cognitive impairment in major depressive disorder: A systematic review of randomized controlled trials[J].Shanghai Arch. Psych.,2016,28(2):64-71.
[17] 边红玲.毒扁豆碱的结构修饰及抗胆碱酯酶构效关系的研究[D].杭州:浙江工业大学,硕士学位论文,2009.
[18] Raves M L,Harel M, Pang Y P,etal.. Structure of acetylcholinesterase complexed with the nootropic alkloid, huperzine A[J].Nat. Struct. Biol.,1997,4(1):57-63.
[19] 王淑月, 刘亚妹,姚道鲁,等. 乙酰胆碱酯酶抑制剂的研究现状[J]. 承德医学院学报, 2002, 19(4):310-312.
[20] 许 明,宋新波,张丽娟.石杉碱甲的研究进展[J].药物评价研究, 2010,33(6):442-446.
[21] 胡海峰, 朱宝泉, 龚炳永.乙酰胆碱酯酶及其抑制剂的研究进展[J].国外医药(抗生素分册),1999,20(2):81-87.
[22] Mucke H A. The case of galantamine: repurposing and late blooming of a cholinergic drug[J] Future Sci., 2015,1(4):FSO73.
[23] 崔永明.甘草黄铜的分离鉴定、药效及其指纹图谱研究[D].武汉:华中科技大学,博士学位论文,2009.
[24] Corey B J. Galantamine: A review of its use in Alzheimer’s disease and vaseular dementia[J].Int. J. Clin. Pract., 2003,57(3):219-223.
[25] Greenblatt H, Kryger G, Lewis T,etal.. Strueture of acetyleholinesterase complexed with(-)-galanthamine at 2.3 Å resolution[J]. FEBS Lett., 1999,463(3):321-326.
[26] Han S Y, Sweeney J E, Baehman E S,etal.. Chemical and pharmacological charaeterization of galanthamine,an acetyleholinesterase inhibitor,and its derivatives. A potential applieation in Alzheimer’s disease[J].Eur. J. Med. Chem.,1992:27:673-687.
[27] Aude M, Dolor Z R, Catherine G,etal.. Potent acetyleholinesterase inhibitors: design, synthesis, and strueture-activity relationships of bis-interacting ligands in the galanthamine series[J]. Bioorgan. Med. Chem.,1998,6(10),1835-1850.
[28] Zhan Z J, Yu Q, Wang Z L,etal.. Indole alkaloids fromErvatamiahainanensiswith potent acetylcholinesterase inhibition activities[J]. Biol. Org. Med. Chem. Lett., 2010,20(21):6185-6187.
[29] Ingkaninan K, Changwijit K, Suwanborirux K. Vobasinyliboga bisndole alkaloids,potent acetylcholinesterase inhibitors fromTabernaemontanadivaricataroot[J]. Pharm. Pharmacol., 2006,58(6):847-852.
[30] Pereira D M, Ferreres F, Oliveira J M A,etal.. Pharmacological effects ofCatharanthusroseusroot alkaloids in acetylcholinesterase inhibition and cholinergic neurotransmission[J].Phytomedicine,2010,17(8/9):646-652.
[31] Zheng X Y, Zhang Z J, Chou G X,etal.. Acetylcholinesterase inhibitive activity-guided isolation of two new alkaloids from seeds ofPeganumnigellastrumBunge by an in vitro TLC-bioautographic assay[J].Arch. Pharmacol. Res.,2009,32(9):1245-1251.
[32] Cardoso-Lopes E M, Maier J A, Silva M R. Alkaloids from stem ofEsenbeckialeiocarpaEngl.(Rutaceae) as potential treatment for Alzheimer disease[J]. Molecules, 2010,15(12):9205-9213.
[33] 孙春红,邹峥嵘. 植物来源的生物碱类乙酰胆碱酯酶抑制剂研究进展[J].中草药,2014,45(21):3172-3184.
[34] Xie Y C,Ning N, Zhu L,etal.. Primary investigation for the mechanism of biatractylolide from atractylodis macrocephalae rhizoma as an acetylcholinesterase inhibitor[J] Evid. Based Comp. Altern. Med.,2016,8:1-7.
[35] Fadaeinasab M, Basiri A, Kia Y,etal.. New indole alkaloids from the bark ofRauvolfiareflexaand their cholinesterase inhibitory sctivity.[J]. Cell. Physiol. Biochem.,2015,37(5):1997-2011.
[36] 杨中铎, 赖东海, 张东博,等.具有乙酰胆碱酯酶抑制活性的总生物碱提取物的筛选[J].中医药学报,2011,39(3):71-74.
[37] 班海侠, 钟 敏, 雷晓凌, 等. 具抗菌及乙酰胆碱酯酶抑制活性珊瑚真菌的筛选[J]. 微生物学杂志, 2015,35(5):23-27.
[38] 张彦丰, 王正浩, 农向群, 等. 绿僵菌侵染对东亚飞蝗中肠保护酶和解毒酶的影响[J].中国生物防治学报,2015,31(6):876-881.
[39] 曹婷婷, 陈俊涛, 杨春柳,等. 4-吡啶基噻唑-2-胺衍生物的设计、合成及其对乙酰胆碱酯酶的抑制活性研究[J].药学学报,2016,51(9):1436-1440.
[40] Cecilia E, Sofie K, Fredrik J E,etal.. Discovery of selective inhibitors targeting acetylcholinesterase 1 from disease-transmitting mosquitoes[J]. Am. Chem. Soc.,2016,59(20):9409-9421.
[41] Pang Y P, Singh S K, Gao Y,etal.. Selective and irreversible inhibitors of aphid acetylcholinesterases: steps toward human-safe insecticides[J]. PLoS ONE,2009,4(2):1-13.
[42] Pang Y P. Species marker for developing novel and safe pesticides[J]. Bioorgan. Med. Chem. Lett.,2007,17(1):197-199.
[43] Gregory A P, Sanjay K S, Rajesh K M,etal.. Insect-specific irreversible inhibitors of acetycholinesterase in spests including the bed bug,the eastern yellow jacket, German and American cockroaches, and the confused flour beetle[J]. Chemico. Biolog. Interact.,2010,187(1-3):142-147.
[44] Dorothea K, Anudeep K D, Ahmad T,etal.. Extracts from traditional Chinese medicinal plants inhibit acetylcholinesterase, a known alzheimer’s disease target[J]. Molecules, 2016,21(9):1-16.
[45] Bu C, Peng B, Cao Y,etal.. Novel and selective acetylcholinesterase inhibitors forTetranychuscinnabarinus(Acari: Tetranychidae)[J]. Insect. Biochem. Mol. Biol., 2015, 66:129-135.
[46] Bu C Y, Feng X J, Wang X Q,etal.. Cloning and characterization of the acetylcholinesterase1 gene ofTetranychuscinnabarinus[J]. J. Econ. Entomol., 2015,108(2): 769-779.
[47] Bu C Y, Li J L, Wang X Q,etal.. Transcriptome analysis of the carmine spider mite,Tetranychuscinnabarinus(Boisduval, 1867) (Acari: Tetranychidae), and its response to β-sitosterol[J]. Bio. Med. Res. Int., 2015,doi:10.1155/2015/794718.
Advances on Agricultural Anticholinesterase Inhibitors
LI Mengyi1,2, PENG Bo2, LI Bo1,2, SHAO Wenhua1,2, YANG Jin1,2, FU Xin1,2, SHI Guanglu1,2, BU Chunya1,2*
1.CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China;2.KeyLaboratoryofUrbanAgriculture(NorthChina),MinistryofAgriculture,BeijingUniversityofAgriculture,Beijing102206,China
Acetylcholinesterase (AChE) is a key enzyme in the biological nerve conduction, and its main function is to terminate the transmission of nerve impulses by hydrolysis of the neurotransmitter acetylcholine (ACh) in cholinergic synapses. Organophosphate and carbamate insecticides are the most common acetylcholinesterase inhibitors, although they played a key role in pest control, they might be harmful to other non-target creatures such as human, mammal, etc. Thus it would be critical to develop efficient acetylcholinesterase inhibitors, which only interact with target creatures like pests. This paper reviewed the advances in acetylcholinesterase inhibitors such as organophosphate and carbamate, alkaloids inhibitors, and some novel acetylcholinesterase inhibitors, which would provide reference for development of safe acetylcholinesterase inhibitors.
acetylcholinesterase; organophosphate; carbamate; alkaloids; selective inhibitors
2016-11-16; 接受日期:2017-01-12
国家自然科学基金项目(31670648);教育部科学技术重点研究项目(212001);北京市自然科学基金项目(6162004)资助。
李梦怡,硕士研究生,研究方向为生物工程。E-mail:mengyili1203@aliyun.com。*通信作者:卜春亚,副教授,博士,主要从事昆虫分子生物学研究。E-mail:buchunya@163.com
10.3969/j.issn.2095-2341.2017.02.08
