树莓酮生物合成途径及关键酶功能研究进展
2017-03-31张奋强黄丽娜姜梦嫣周义杰邹宇晨杨明峰马兰青
张奋强, 刘 欢, 黄丽娜, 姜梦嫣, 周义杰, 邹宇晨, 杨明峰*, 马兰青,3*
1.北京农学院植物科学技术学院, 农业部华北都市农业重点实验室, 北京 102206;2.北京农学院生物科学与工程学院, 农业部华北都市农业重点实验室, 北京 102206;3.北京农学院, 北京林果业生态环境功能提升协同创新中心, 北京 102206
树莓酮生物合成途径及关键酶功能研究进展
张奋强1, 刘 欢1, 黄丽娜2, 姜梦嫣2, 周义杰1, 邹宇晨2, 杨明峰2*, 马兰青2,3*
1.北京农学院植物科学技术学院, 农业部华北都市农业重点实验室, 北京 102206;2.北京农学院生物科学与工程学院, 农业部华北都市农业重点实验室, 北京 102206;3.北京农学院, 北京林果业生态环境功能提升协同创新中心, 北京 102206
树莓酮(raspberry ketone),又称覆盆子酮,其化学名称为4-对羟基苯基-2-丁酮[4-(4-hydroxyphenyl)-2-butanone],是存在于多种植物中的香气化合物。树莓酮不仅因其独特的香味被食品行业和化妆品行业应用,而且树莓酮有很好的减肥作用。由于从植物中提取树莓酮的成本非常高,而且产量少,导致市售的树莓酮价格含量极高。因此通过代谢工程的方法来合成树莓酮成为近年来研究的热点。近十几年来,国内外对于树莓酮的生物合成途径做了大量的研究。总结了近十几年来国内外对于树莓酮生物合成途径的成果,并在此基础上提出了对于树莓酮生物合成的一些见解,以期对树莓酮生物合成途径的研究有所启发。
树莓酮;生物合成;研究进展
树莓酮(raspberry ketone),又称覆盆子酮,其化学名称为4-对羟基苯基-2-丁酮[4-(4-hydroxyphenyl)-2-butanone],是存在于桃子、葡萄、苹果以及浆果等多种植物中的香气化合物。此种化合物赋予树莓独有的特征性香气,因此称其为树莓酮。在树莓果实的成熟阶段,树莓酮的含量最高[1, 2]。树莓酮不仅因其独特的香味在食品和化妆品领域备受青睐,而且因其具有多种药用价值[3],近年来也收到制药行业的关注。但是,树莓酮在植物中的含量非常少,每千克果实中仅含几毫克树莓酮,而且纯化成本过高,因此通过从植物中提取树莓酮远远不能达到市场的需求。通过化学合成的方法虽然比从植物中提取树莓酮要简单而且大量,但是合成过程中会出现许多有毒的副产物,而且合成的树莓酮被视为非自然化合物,不符合食品法[4]。这些因素导致市售的树莓酮价格高达每千克20 000美元。因此,研究者们开始寻找既高效又绿色的生物合成方法合成树莓酮。近年来,国内外许多专家和学者对树莓酮的合成途径做了许多相关的研究和报道,对树莓酮的合成途径有了较为清晰的认识。本文总结了近年来有关树莓酮生物合成的相关研究成果,并对树莓酮存在的两种途径(植物途径和微生物途径)做了比较,希望为树莓酮生物合成途径的研究提供新的视野与思路。
1 树莓酮的生物合成途径
树莓酮在植物中的生物合成前体来自于苯丙烷代谢途径(phenylpropanoid pathway),即苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)的作用下生成肉桂酸,之后肉桂酸在肉桂酸-4-羟基化酶(cinnamate-4-hydroxylase,C4H)的作用下生成4-香豆酸,最后4-香豆酸在4-香豆酰辅酶A连接酶(4-coumarate-CoA ligase, 4CL)的作用下生成4-香豆酰辅酶A[5~7],此为合成树莓酮的其中一个底物(图1)。苯亚甲基丙酮合成的另一个底物是丙二酰辅酶A(malonyl-CoA),此化合物是乙酰辅酶A(acetyl CoA)通过乙酰辅酶A羧化酶(acetyl CoA carboxylase, AACase)作用形成的。之后这两种底物在苯亚甲基丙酮合酶(benzalacetone synthase,BAS)的作用下,通过脱羧缩合反应生成苯亚甲基丙酮,苯亚甲基丙酮再通过苯亚甲基丙酮还原酶(benzalacetone reductase,BAH)的作用生成树莓酮[1, 2, 8](图1)。
树莓酮不仅在植物中可以合成,在微生物中同样可以,只是方式有所不同。分别用1-13C、2-13C、3-13C标记的苯丙氨酸供给Nidulaniveotomentosa,实验结果发现只有用3-13C标记的苯丙氨酸供给时才能检测到有同位素标记的苯亚甲基丙酮[9]; Fischer等[10]在研究真菌催化合成树莓酮时,发现用含有C6-C1结构的化合物做底物(如 马尿酸)比用含有C6-C3结构的化合物做底物前期合成效率更高,这有可能是C6-C1结构的化合物比C6-C3结构的化合物更易于通过细胞膜,有趣的是含有C6-C2结构的化合物却不能作为底物来合成苯亚甲基丙酮,这说明在真菌合成树莓酮时很有可能是先将C6-C3结构的化合物分解为C6-C1结构的化合物,进而再进行侧链的延伸,而这种分解方式是以二碳为单位进行的。这种催化方式与之前所述的植物中树莓酮的合成途径有所区别(图1),而催化C6-C3结构变为C6-C1结构的相关酶还没有明确的报道。另外,此研究发现乙酰辅酶A羧化酶抑制剂能抑制丙二酰辅酶A的合成,苯亚甲基丙酮的产量也随之降低,这表明真菌合成树莓酮时,侧链延伸所用的底物与植物中合成树莓酮时侧链延伸所用的底物都是丙二酰辅酶A,只不过前者在侧链缩合的过程中需要两分子的丙二酰辅酶A[9],而通过植物途径合成树莓酮时只需1分子的丙二酰辅酶A,这说明两种不同的生物合成途径在合成树莓酮时所用的底物不同,催化方式也不同。此外,Kosjek等[11]发现在马红球菌冻干细胞中存在一种仲醇脱氢酶(secondary alcohol dehydrogenase,ADH),这种酶可以将4-对羟基苯基-2-丁醇(杜鹃醇)脱氢氧化生成树莓酮(图1)。在上述几个研究中,研究者同样能在产物中检测到含有同位素标记的4-对羟基苯基-2-丁醇[9, 10],这表明在其他菌种中也有可能存在仲醇脱氢酶,与其他途径协同催化树莓酮的合成。
2 树莓酮生物合成途径中的两个关键酶
2.1 苯亚甲基丙酮合酶(BAS)
苯亚甲基丙酮合酶(BAS)是植物合成树莓酮过程中催化4-香豆酰辅酶A与丙二酰辅酶A脱羧缩合生成苯亚甲基丙酮的关键酶。BAS基因最早是从掌叶大黄中克隆分离得到的[5],经分析,该基因编码42 kDa的氨基酸,与CHS超家族中其他成员(如)编码的氨基酸序列有60%~75%的相似性。值得注意的是,该基因编码的氨基酸序列与CHS相比缺少215位的苯丙氨酸,但是保留了具有催化活性的半胱氨酸-组氨酸二聚体。Jules等[12]利用定点突变分别将RiCHS基因214位的Leu和215位的Phe突变为Ile和Leu,即RiCHS-Mut。通过体外酶促反应得知,在体外条件下,RiCHS合成苯亚甲基丙酮的活性要比RiCHS-Mut高的多。此外,马兰青等[6,7]从虎杖中成功克隆分离到的基因PcPKS1和PcPKS2,经过分析,基因PcPKS2为BAS,而PcPKS1编码的蛋白具有CHS和BAS双功能酶活性,而且双功能酶PcPKS1表现出的BAS活性要比PcPKS2高约70倍。
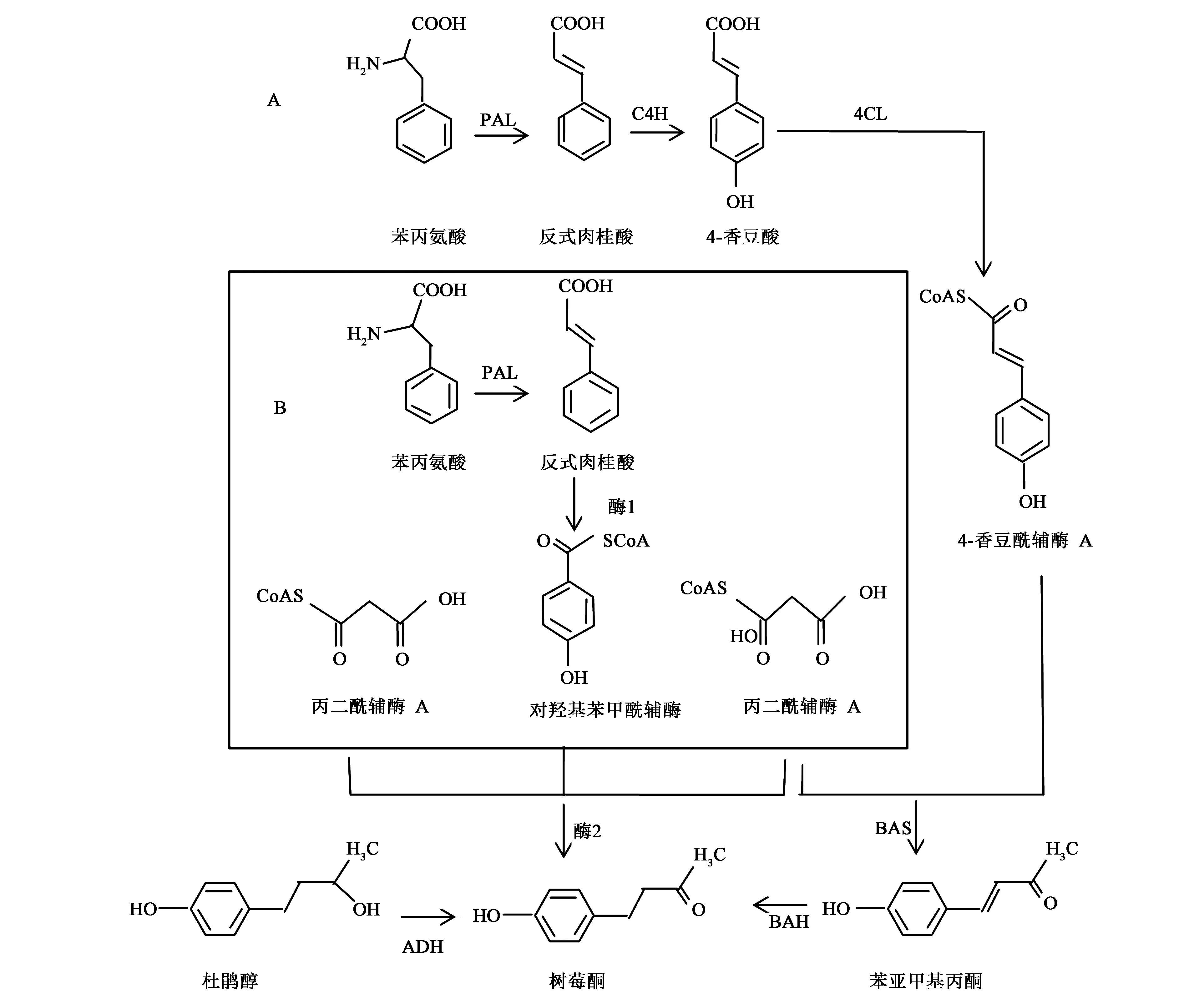
图1 树莓酮生物合成途径Fig.1 Biosynthesis pathway of raspberry ketone.A为植物途径;B为微生物途径;图中实线框表示的部分为可能存在的步骤。4CL:4-香豆酰辅酶A连接酶;ADH:仲醇脱氢酶;BAS:苯亚甲基丙酮合酶;C4H:肉桂酸-4-羟基化酶;PAL:苯丙氨酸解氨酶;酶1和酶2到目前为止还没有相关报道
值得注意的是,上述这些研究中,双功能酶表现出高的BAS活性时的pH与BAS单功能酶非常相似,这说明在高pH条件下有利于催化苯亚甲基丙酮的合成;与CHS相比,BAS缺少了215位的苯丙氨酸,而且双功能酶表现出的BAS活性要比BAS单功能酶高的多,因此CHS中的苯丙氨酸更有利于酶与底物的结合。Lee等[13]研究发现将4CL和BAS融合基因导入酿酒酵母中进行培养,可以得到高产量的树莓酮。到目前为止,专门起BAS作用的基因仍然没有从树莓中克隆分离。
2.2 苯亚甲基丙酮还原酶(BAH)
苯亚甲基丙酮还原酶是催化树莓酮生物合成的最后一步关键酶,它催化苯亚甲基丙酮还原成树莓酮。Takao等[14]从树莓中克隆分离到了具有该活性的RZS,该酶是一个双功能酶,即树莓酮/姜油酮合酶。这也是首次从高等植物中克隆分离到的具有编码苯亚甲基丙酮还原酶活性的基因,通过研究发现与其他还原酶不同,该酶具有很高的底物特异性,特异识别丁烯基侧链中的α、β不饱和键,此外Häkkinen等[15]发现在进行其他植物细胞培养时,其他植物细胞(如烟草)也具有将苯亚甲基丙酮转化成树莓酮的能力。Jules等[12]在研究中发现,细菌和真菌中同样也存在着具有苯亚甲基丙酮还原酶活性的酶,不过目前还没有对微生物中存在的这种酶做相关的研究与鉴定。
3 展望
树莓酮,这种存在于多种植物中的化合物,以其自身独特的性质,近年来备受食品、化妆品以及制药行业等领域的青睐。但是因其在植物中含量很少并且通过化学合成方法有诸多的限制因素,因此通过生物方法来合成树莓酮成了研究的热点。经过十几年的研究,树莓酮在植物中的合成途径已经渐渐被人们所熟知,最为清楚的苯丁烷代谢途径,即BAS催化4-香豆酰辅酶A与丙二酰辅酶A脱羧缩合生成苯亚甲基丙酮,之后在苯亚甲基丙酮还原酶的作用下生成树莓酮。但是,树莓酮在植物体内的合成绝不止这一条途径,比如Fischer等[9]在研究Nidulaniveotomentosa合成树莓酮时,该菌所用的途径就不是苯丁烷代谢途径,Kosjek等[11]在研究马红球菌合成树莓酮时发现乙醇脱氢酶可催化杜鹃醇生成树莓酮等。
BAS是合成树莓酮过程中的关键酶,但决不仅仅是BAS才能合成苯亚甲基丙酮,还存在1种CHS/BAS双功能酶也能催化苯亚甲基丙酮的合成。有趣的是,双功能酶催化苯亚甲基丙酮合成时的反应pH与BAS合成苯亚甲基丙酮时的反应pH相似[6]。这表明pH可能通过影响酶的结构,从而影响酶促反应产物。4CL和BAS融合基因的研究说明相对于BAS来说,催化树莓酮合成最后一步起还原作用的酶可能不那么受重视,但是其在整个树莓酮合成过程中却是不可缺少的。Takao等[14]首次从树莓中成功克隆分离得到了催化树莓酮合成最后一步的还原酶RZS1,不仅在树莓中存在催化树莓酮合成最后一步的还原酶,Häkkinen等[15]研究发现在其他一些不相关的植物中也存在将苯亚甲基丙酮转化成树莓酮的还原酶;Jules等[12]通过研究证明了细菌及真菌中都存在NADPH依赖性的还原酶,至于是哪种酶,目前还没有鉴定。
虽然近十几年来对于树莓酮生物合成途径的报道不少,相关的合成途径也研究的比较清晰。但是适用于树莓酮批量合成的方式仍然没有找到。通过发酵的方法来合成人们所需要的化合物一直被广大企业所采用,就是因为用于发酵的微生物有生存能力强、产量大等优点。目前有关树莓酮代谢工程方面的研究有基因的定点突变[12]、融合基因[13]等。本文总结并比较了近年来树莓酮生物合成途径中相关酶的催化性能,对于今后的树莓酮代谢工程有一定的指导意义,为今后通过微生物大量生产树莓酮提供了借鉴。
[1] Borejsza-Wysocki W, Hrazdina G. Biosynthesis of p-hydroxyphenylbutan-2-one in raspberry fruits and tissue cultures [J]. Phytochemistry, 1994, 35(3): 623-628.
[2] Borejsza-Wysocki W, Hrazdina G. Aromatic polyketide synthases—purification, characterization, and antibody development to benzalacetone synthase from raspberry fruits [J]. Plant Physiol., 1996, 110(3): 791-799.
[3] Kima M, Baekb H S, Leea M,etal.. Rhododenol and raspberry ketone impair the normal proliferation of melanocytes through reactive oxygen species-dependent activation of GADD45 [J]. Toxicol. Vitro., 2016, 32: 339-346.
[4] Vandamme E J, Soetaert W. Bioflavours and fragrances via fermentation and biocatalysis [J]. J. Chem. Technol. Biot., 2002, 77(12): 1323-1332.
[5] Abe I, Takahashi Y, Morita H. Benzalacetone synthase: A novel polyketide synthase that plays a crucial role in the biosynthesis of phenylbutanones inRheumpalmatum[J]. Eur. J. Biochem., 2001, 268: 3354-3359.
[6] Ma L Q, Guo Y W, Gao D Y. Identification of a Polygonum cuspidatum three-intron gene encoding a type III polyketide synthase producing both naringenin and p-hydroxybenzalacetone [J]. Planta, 2009, 229: 1077-1086.
[7] Ma L Q, Pang X B, Shen H Y,etal.. A novel type III polyketide synthase encoded by a three-intron gene fromPolygonumcuspidatum[J]. Planta., 2009, 229(3): 457-469.
[8] Pedapudi S, Chin C K, Pedersen H. Production and elicitation of benzalacetone and the raspberry ketone in cell suspension cultures ofRubusidaeus[J]. Biotechnol. Prog., 2000, 16(3): 346-349.
[9] Zorn H, Berger R G, Fischer-Zorn M. A labeling study to elucidate the biosynthesis of 4-(4-Hydroxyphenyl)-butan-2-one (raspberry ketone) byNidulaniveotomentosa[J]. Appl. Environ. Microb., 2002, 69(1): 367-372.
[10] Fischer M, Berger A B R G. Fungal formation of raspberry ketone differs from the pathway in plant cell culture [J]. Food Biotechnol., 2006, 15(3): 147-155.
[11] Kosjek B, Stampfer W, Deursen R. Efficient production of raspberry ketone via ‘green’ biocatalytic oxidation [J]. Tetrahedron, 2003, 59: 9517-9521.
[12] Beekwilder J, Sibbesen O, Broekgaarden M,etal.. Microbial production of natural raspberry ketone [J]. J. Biotechnol., 2007, 2(10): 1270-1279.
[13] Lee D, Lloyd N D R, Pretorius I S,etal.. Heterologous production of raspberry ketone in the wine yeastSaccharomycescerevisiaevia pathway engineering and synthetic enzyme fusion [J]. Microb. Cell. Fact., 2016, 15: 1-7.
[14] Koedukaa T, Watanabea B, Suzukic S. Characterization of raspberry ketone/zingerone synthase, catalyzing the alpha, beta-hydrogenation of phenylbutenones in raspberry fruits [J]. Biochem. Bioph. Res. Commun., 2011, 412(1): 104-108.
[15] Häkkinen S T, Seppänen-Laakso T, Oksman-Caldentey K M,etal.. Bioconversion to raspberry ketone is achieved by several non-related plant cell cultures [J]. Front Plant Sci., 2015, 6: 1035.
Progress on Biosynthesis Pathway and Function of Key Enzyme in Raspberry Ketone
ZHANG Fenqiang1, LIU Huan1, HUANG Lina2, JIANG Mengyan1, ZHOU Yijie2, ZOU Yuchen2, YANG Mingfeng2*, MA Lanqing2,3*
1.KeyLaboratoryofUrbanAgriculture(NorthChina),MinistryofAgriculture,PlantScienceandTechnologyCollege,BeijingUniversityofAgriculture,Beijing102206,China2.KeyLaboratoryofUrbanAgriculture(NorthChina),MinistryofAgriculture,CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China;3.BeijingCollaborativeInnovationCenterforEco-environmentalImprovementwithForestryandFruitTrees,BeijingUniversityofAgriculture,Beijing102206,China
Raspberry ketone is a kind of aroma compound, its chemical name is 4-(4-hydroxyphenyl)-2-butanone, which is existing in many kinds of plants. Raspberry ketone is not only applied in food industries and comestic industries as its unique flavor, but also has good effect on loseing weight. The cost that abstract raspberry ketone from plants is exceedingly high and the yield is very low, which leads high price of raspberry ketone. So through metabolic engineering to synthesize raspberry ketone has become research hotspots recently. In recent ten years, there are many research on biosynthesis pathway of raspberry ketone at home and abroad. The paper summarized the achivements on biosynthesis pathway of raspberry ketone and proposed some opinions, which was expected to provide reference for further study on raspberry ketone biosynthesis.
raspberry ketone; biosynthesis pathway; research progress
2016-11-16; 接受日期:2016-12-14
国家自然科学基金项目(21606020);北京市自然科学基金项目(2164059);北京市科技创新服务能力建设-协同创新中心项目(PXM2017_014207_000043)资助。
张奋强,硕士研究生,研究方向为果树品质优质生态安全。E-mail: huanliu0824@163.com。*通信作者:杨明峰,副教授,研究方向为植物分子生物学和植物代谢调控研究。E-mail: mingfengyang@bua.edu.cn;马兰青,教授,研究方向为植物次生代谢分子调控。E-mail:lqma713@163.com
10.3969/j.issn.2095-2341.2017.02.05
