红景天苷生物合成机制及其基因工程研究进展
2017-03-31黄丽娜张奋强姜梦嫣周义杰周王艳薛飞燕马兰青
黄丽娜, 刘 欢, 张奋强, 姜梦嫣, 于 跃, 周义杰, 周王艳, 薛飞燕 *,马兰青,3*
1.北京农学院生物科学与工程学院, 农业部华北都市农业重点实验室, 北京 102206;2.北京农学院植物科学技术学院, 农业部华北都市农业重点实验室, 北京 102206;3.北京农学院, 北京林果业生态环境功能提升协同创新中心, 北京 102206
红景天苷生物合成机制及其基因工程研究进展
黄丽娜1, 刘 欢2, 张奋强2, 姜梦嫣1, 于 跃1, 周义杰2, 周王艳1, 薛飞燕1*,马兰青1,3*
1.北京农学院生物科学与工程学院, 农业部华北都市农业重点实验室, 北京 102206;2.北京农学院植物科学技术学院, 农业部华北都市农业重点实验室, 北京 102206;3.北京农学院, 北京林果业生态环境功能提升协同创新中心, 北京 102206
红景天苷主要来源于红景天,是红景天属植物的重要活性物质,具有抗辐射、抗缺氧、抗肿瘤等多种药用功效。由于红景天野生资源少,且红景天苷在红景天中含量极少、提取率低,因此,研究提高红景天苷产量的生产方法具有重要的意义和价值。在研究红景天苷生物合成机制的基础上,通过基因工程技术来提高红景天苷的产量具有一定的前景和研究价值。综述了红景天苷的生物合成机制、代谢途径中的关键酶和利用代谢工程合成红景天苷的方法,并对其研究前景进行了展望,以期为红景天苷的生物合成相关研究提供参考。
红景天苷;关键酶;代谢工程
红景天属于景天科(Crassulaceae)红景天属(Rhodiola)植物,是珍稀药用植物之一,其生长环境恶劣,主要分布于北半球的亚北极地区,包括北欧、中欧、亚洲和北美[1,2]。红景天具有多种药用功效,被誉为“藏人参”,在亚洲和欧洲国家有着很长的民间药用历史[3]。研究表明,红景天属植物的主要活性物质红景天苷(Salidroside)[4~6]具有抗辐射、抗缺氧、抗肿瘤等适应原功效,在医学和保健食品中具有重要的应用价值[7]。
红景天的药用价值明显,但其野生资源少,其主要原因有:①红景天生长环境恶劣,在海拔2 500~5 000 m的山地冰川、山梁草地或山谷岩石上成簇生长,但近几年由于过度放牧和采挖,使原本脆弱的生态环境遭到破坏;②花粉表面光滑,不利于授粉等自身生殖生理特性;③近交衰退严重[8]。红景天本身资源少且红景天苷在红景天中的含量低,只有0.5%~0.8%[9],直接从红景天中提取红景天苷面临着材料少、提取工艺复杂、提取率低等问题。人工栽培红景天有效成分含量低且易发生根腐烂病。利用化学途径合成红景天苷涉及有机溶剂等难以保障其食用的安全性。目前通过研究红景天苷生物合成途径,运用现代分子技术结合基因工程和代谢工程来提高红景天苷的产量已逐渐成为该领域的研究热点。本文对红景天苷的生物合成机制及其关键酶进行了阐述,并总结了利用代谢途径中的关键酶来合成红景天苷的方法,以期为红景天苷的生物合成研究提供参考。
1 红景天苷的生物合成机制
总结前人的研究,红景天中红景天苷生物合成途径中主要的两步:一是酪醇的合成;二是以酪醇 (tyrosol)为糖基受体,以尿苷二磷酸葡萄糖 (UDPG)为糖基供体,在尿苷二磷酸葡萄糖基转移酶 (UDP-glucosyltransferase,UDPGT,UGTs)的作用下,催化合成红景天苷[7,10],这一步的合成已无争议。对于红景天中酪醇合成的机制也已逐步研究清楚。
酪醇属于酚类化合物,植物酚类化合物的生物合成途径主要是莽草酸途径,莽草酸(shikimate)由磷酸烯醇式丙酮酸(phosphoenolpyruvate)和赤藓糖-4-磷酸(erythrose 4-phosphate)形成[11]。经过几步酶促反应莽草酸形成阿罗酸(arogenate),阿罗酸在阿罗酸脱水酶和阿罗酸脱氢酶的催化下分别生成苯丙氨酸(phenylalanine)和酪氨酸(tyrosine),之后合成酪醇的途径可能有3条:苯丙烷代谢途径、酪氨酸转氨代谢途径和酪氨酸脱羧酶代谢途径。酪氨酸转氨酶催化酪醇的合成途径至今未见相关文献报道。在植物中苯丙烷代谢途径的苯丙氨酸经苯丙氨酸解氨酶催化去氨基形成肉桂酸,肉桂酸羟基化后形成4-香豆酸。此前有关红景天中酪醇合成的争议主要在于酪醇是来自于苯丙氨酸还是酪氨酸,目前更多的研究证明酪醇起始于酪氨酸(图1)[7, 10]。Ma等[12]从高山红景天中克隆了苯丙氨酸解氨酶基因PALrs1,过表达PALrs1,结果使苯丙氨酸代谢途径的香豆酸含量增加3.3倍,但酪醇和红景天苷的含量却分别下降了4.7倍和7.7倍,因此推测酪醇不是来自于苯丙氨酸。Hu等[13]用2-氨基茚满-2-磷酸(AIP)处理肉苁蓉悬浮细胞培养物来抑制其苯丙氨酸解氨酶(PAL)活性,结果使总酚类化合物含量下降,但红景天苷却没有类似的结果。Zhang等[14]从高山红景天中克隆酪氨酸脱羧酶基因RsTyrDC,过表达RsTyrDC,结果显示酪醇和红景天苷的含量提高了1.6倍和2.7倍;而当抑制TyrDCs的表达时,酪醇和红景天苷的含量分别下降了2.7倍和4.1倍,酪醇来源于酪氨酸代谢途径。
酪醇起始于酪氨酸,酪氨酸在酪氨酸脱羧酶(tyrosine decarboxylase,TyDC)催化下生成酪胺(tyramine),在单氨氧化酶(monoamine oxidase, MAOA)催化生成4-羟基苯乙醛(4-hydroxyphenylacetaldehyde,4-HPAA);4-HPAA在4-羟苯醇脱氢酶(p-hydroxybenzyl alcoholdehydrogenase,areB)还原合成红景天苷的苷元酪醇(tyrosol)。之前有文献报道植物中存在催化酪胺生成 4-羟基-苯乙醛的单氧化酶[15]。Lan等[16]从大花红景天中克隆了酪氨酸脱羧酶基因RcTYDC,过表达RcTYDC产生的酪胺、酪醇和红景天苷与对照相比分别提高了3.21~6.84倍、1.50~2.19倍和1.27~3.47倍,证实了重组53 kDa的RCTYDC酪氨酸转换成酪胺。因此,对红景天苷生物合成机制的推测途径如图1所示,其代谢途径中的关键酶是酪氨酸脱羧酶和尿苷二磷酸葡萄糖基转移酶。
在微生物中,目前没有直接合成红景天苷的报道。但可以利用微生物中的酶,通过添加底物的方式来合成红景天苷。酿酒酵母存在合成酪醇的机制,以L-酪氨酸为底物经过转氨脱羧反应合成酪醇[17],但没有研究证明其能直接合成红景天苷。利用生物酶来合成红景天苷主要是以添加的酪醇和葡萄糖为底物,筛选红景天苷高转化菌株或分离纯化菌株中的糖苷酶来催化底物生成产物红景天苷[18,19]。
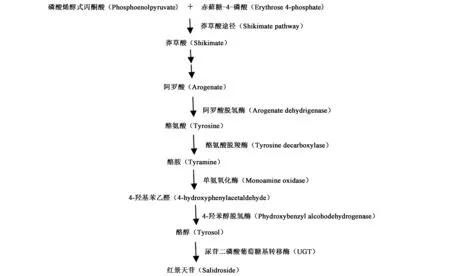
图1 推测的红景天苷生物合成途径Fig.1 Proposed biosynthetic pathways of salidroside.
2 红景天苷合成的关键酶
2.1 酪氨酸脱羧酶(tyrosine decarboxylase,TyDC)
酪氨酸是高等植物次生代谢产物的一种重要前体物质,酪氨酸脱羧酶(TyrDC,EC4.1.1.25)处于初级代谢和次生代谢的交叉点上,通常在调控终产物的生物合成起着关键的作用[20]。总结之前相关文献的报道,酪氨酸脱羧酶在红景天苷的生物合成中有着重要的调控作用。Zhang 等[13]从高山红景天中分离克隆到编码酪氨酸脱羧酶的基因,命名为RsTyrDC,构建正义和反义植物表达载体,将正义植物表达载体、反义植物表达载体和空载体通过根癌农杆菌转回高山红景天中,HPLC分析表明在高山红景天植株中过表达RsTyrDC导致酪醇和红景天苷含量的显著增加;但在RsTyrDC下调表达的转基因高山红景天植株中,酪醇和红景天苷的水平分别比对照低274%和412%,说明酪氨酸脱羧酶(RsTyrDC)能调节酪醇和红景天苷的生物合成。Landtag[15]将欧芹的TyrDC转入马铃薯,过表达TyrDC,结果在转基因马铃薯块茎中,发现了红景天苷。Gyorgy 等[21]从红景天中分离克隆TyDC基因,通过实时定量PCR对基因的表达进行检测发现,TyDC在红景天的根中表达量显著高于叶,这与红景天苷在植物的地下部分优先累积的事实相一致;并且红景天苷含量高的株系,TyDC表达也更高,表达强度的差异表明酪氨酸脱羧酶(TyDC)在红景天苷生物合成中起决定性作用。Lan等[16]从大花红景天中克隆酪氨酸脱羧酶基因RcTYDC,经水杨酸处理,RcTYDC和RcUDPGT的表达比对照分别提高了49倍和36倍,RcTYDC和RCUDPGT的组织分布有着高度一致性:茎中的表达水平最高,叶比花和根的表达水平高。RcTYDC表达水平与红景天苷积累水平相一致。这说明RcTYDC在红景天苷的生物合成中发挥了重要的作用。
2.2 尿苷二磷酸葡萄糖基转移酶(UDP-glucosyltransferase,UGT)
糖基转移酶(glycosyltransferase, GT, EC2.4.x.y)一个主要的功能就是将高能单糖残基转移至糖、蛋白质、脂类、核酸以及另外一些小分子受体上完成糖基化。在红景天苷合成机制中的另一个关键酶是UDP-葡萄糖基转移酶,催化酪醇和UDP-葡萄糖生成红景天苷。Ma等[22]从高山红景天愈伤组织中分离克隆了UGT基因,命名为UGT73B6,这是第一个从红景天属植物中分离的与酪醇糖基化有关的基因。RNA印迹分析表明UGT73B6转录本在根、愈伤中的积累比茎、叶多,且在叶中几乎检测不到,这与红景天苷在不同组织中的积累情况相一致。在转基因植物和愈伤中过表达UGT73B6导致红景天苷的含量与对照比分别增加了2倍和2.4倍。这些结果说明UGT73B6具有催化酪醇生成红景天苷的功能。然而,叶片中含有微量的红景天苷,而RNA印迹显示UGT73B6转录本在高山红景天叶片中检测不到,说明红景天中可能有其他的糖基转移酶。
Yu等[23]从高山红景天的根和愈伤组织中分离得到2个UGTs,命名为UGT72B14和UGT74R1。前者在根中表达更多,而后者在愈伤组织中表达更多。对UGT72B14、 UGT74R1 和UGT73B6进行体外和体内实验研究显示,在体外酶促实验中,重组UGT72B14、UGT74R1 和UGT73B6的最适底物分别为酪醇、水杨酸和4-香豆酸。UGT72B14的活性最高,其催化效率(Vmax/Km)比UGT74R1和UGT73B6分别高6.2倍和1.7倍。在体内实验中,通过发根农杆菌介导法转回高山红景天毛状根中,转UGT72B14、UGT74R1和UGT73B6植株红景天苷含量比对照分别提高了4.2倍、0.5倍和1.3倍。体外酶促功能验证以及体内验证分析得出,UGT72B14和UGT73B6在红景天苷生物合成中有着重要作用;UGT74R1在根茎中不表达可能与红景天苷生物合成缺乏有关。
3 基因工程法合成红景天苷
红景天苷的生物合成机制已逐渐清楚,利用代谢途径中的关键酶来生产和提高红景天苷的产量有着广阔的前景。目前,已有文献报道在转基因植物、毛状根和微生物中利用关键酶来合成红景天苷及其前体物质酪醇。
在转基因植物中,Zhang等[14]通过根癌农杆菌侵染,在高山红景天中过表达酪氨酸脱羧酶,使红景天苷的含量提高。Ma等[22]通过根癌农杆菌介导法将克隆的糖基转移酶基因UGT73B6转回高山红景天的愈伤和植株中,经高效液相色谱(HPLC)分析表明过表达UGT73B6导致红景天苷含量的增加。而之后的研究报道中,将代谢途径的关键酶进行表达的生物反应体系更多的是应用毛状根体系。通过发根农杆菌侵染植物形成的毛状根,具有遗传稳定、产率较高等特点,被认为是一种有效的次生代谢生产系统[24,25]。Yu等[23]在转基因毛状根中表达糖基转移酶基因UGT72B14、UGT74R1和UGT73B6,提高了红景天苷的产量,并且UGT73B6转基因毛状根中红景天苷的含量比转基因植株和转基因愈伤高。Lan等[16]在大花红景天毛状根系统中表达酪氨酸脱羧酶提高了酪醇和红景天苷的产量。
近年来,利用基因工程结合代谢工程改造微生物,来实现在微生物中生产目标产物已逐渐成为研究的热点[26~29]。在生物合成红景天苷中,将代谢途径中的关键酶糖基转移酶基因通过基因工程的手段转入微生物合成红景天苷也已有报道。 Xue等[30]通过密码子优化糖基转移酶UGT72B14基因,将优化后的基因转入大肠杆菌中进行表达和催化合成红景天苷,结果表明,采用分批和分批-补料发酵培养方法均能使优化型UGT72B14重组大肠杆菌的红景天苷产量提高,最高达6.7 mg/L,较野生型UGT72B14增加了3.2倍。Bai等[31]通过过表达酪醇合成途径的基因,并通过消除竞争性途径和反馈抑制构建重组菌提高酪醇的产量;并将红景天糖基转移酶基因UGT73B6转入上述重组大肠杆菌中,使红景天苷的产量达到56.9 mg/L。
4 展望
对红景天苷的生物合成机制进行探索和分析,研究认为酪醇的合成来源于酪氨酸代谢途径,其中酪氨酸脱羧酶(TyDC)和尿苷二磷酸葡萄糖基转移酶(UGT)是关键酶。
由于红景天苷资源非常有限,利用合成生物学理念来提高红景天苷的产量是现在研究的热点。种植植物具有生长周期长、占用耕地等缺点,因而利用转基因植物来生产次生代谢产物仍具有局限性。微生物具有繁殖速度快、生长周期短、对培养环境的要求比组织培养和细胞培养低、易于工业化生产等特点,因而更有应用前景。利用基因工程结合代谢工程,将基因转入到微生物中构建基因工程菌,使目的基因在微生物中进行表达并完成一系列的催化反应将有着广阔的应用前景。
[1] Yousef G G, Grace M H, Cheng D M,etal.. Comparative phytochemical characterization of threeRhodiolaspecies[J]. Phytochemistry, 2006, 67(21): 2380-2391.
[2] Grech-Baran M, Syklowska-Baranek K, Pietrosiuk A. Biotechnological approaches to enhance salidroside, rosin and its derivatives production in selectedRhodiolaspp. in vitro cultures[J]. Phytochem. Rev., 2015, 14(4): 657-674.
[3] Panossian A, Wikman G, Sarris J. Rosenroot (Rhodiolarosea): traditional use, chemical composition, pharmacology and clinical efficacy[J]. Phytomedicine,2010,17(7):481-493.
[4] Xu J F, Su Z G, Feng P S. Activity of tyrosol glucosyltransferase and improved salidroside production through biotransformation of tyrosol inRhodiolasachalinensiscell cultures[J]. J. Biotechnol., 1998, 61(1): 69-73.
[5] Yang Y N, Liu Z Z, Feng Z M,etal.. Lignans from the root ofRhodiolacrenulata[J]. J. Agric. Food. Chem., 2012, 60(4): 964-972.
[6] Qu Z Q, Zhou Y, Zeng Y S,etal.. Protective effects of a Rhodiola crenulata extract and salidroside on hippocampal neurogenesis against streptozotocin-induced neural injury in the rat[J]. PLoS ONE, 2012, 7(1): 29641.
[7] 马兰青,柳春梅,于寒松,等. 红景天甙生物合成途径:酪醇合成的起始反应及其糖基化 [J]. 生物工程学报, 2012, 28(3): 282-294.
[8] Zhu L, Lou A. Mating system and pollination biology of a highmountain perennial plant,Rhodioladumulosa(Crassulaceae)[J]. J. Plant Ecol. UK, 2010, 3(3): 219-227.
[9] 王 洋, 张 璞, 于 涛. 高效液相色谱法测定红景天苷含量方法的研究[J]. 植物研究, 2001, 21(1): 113-115.
[10] 祝顺琴, 刘万宏, 戴传云. 红景天苷生物合成的细胞与分子生物学研究进展[J]. 食品科学, 2012, 33(3): 267-271.
[11] Taiz L, Zeiger E. Plant Physiology(4th ed.) [M]. Sunderland:Sinauer Associates, 2010,369-400.
[12] Ma L Q, Gao D Y,Wang Y N,etal.. Effects of overexpression of endogenous phenylalanine ammonia-lyase (PALrs1) on accumulation of salidroside inRhodiolasachalinensis[J]. Plant Biol. (Stuttg), 2008, 10(3): 323-333.
[13] Hu G S, Hur Y J, Jia J M,etal.. Effects of 2-aminoindan-2-phosphonic acid treatment on the accumulation of salidroside and four phenylethanoid glycosides in suspension cell culture ofCistanchedeserticola[J]. Plant Cell Rep., 2011, 30(4): 665-674.
[14] Zhang J X, Ma L Q,Yu H S,etal.. A tyrosine decarboxylase catalyzes the initial reaction of the salidroside biosynthesis pathway inRhodiolasachalinensis[J]. Plant Cell Rep., 2011, 30(8): 1443-1453.
[15] Landtag J, Baumert A, Degenkolb T,etal.. Accumulation of tyrosol glucoside in transgenic potato plants expressing a parsley tyrosine decarboxylase[J]. Phytochemistry, 2002, 60(7): 683-689.
[16] Lan X, Chang K, Zeng L,etal.. Engineering salidroside biosynthetic pathway in hairy root cultures ofRhodiolacrenulatabased on metabolic characterization of tyrosine decarboxylase[J]. PLoS ONE, 2013, 8(10): 75459.
[17] Sentheshanmuganathan S, Elsden S R. The mechanism of the formation of tyrosol bySaccharomycescerevisiae[J]. Biochem. J., 1958, 69: 210-218.
[18] 王梦亮, 张 芳, 刘滇生. 微生物催化D-葡萄糖与酪醇葡糖基转移合成红景天甙的初步研究[J]. 催化学报, 2006, 27(3): 233-236.
[19] Zhang C, Yu H, Lu M. Enzymic synthesis of salidroside: Purification and characterization of salidrosidase fromAspergillasniger[J]. Proc. Biochem., 2005, 40: 3143-3147.
[20] Facchini P J, Huber-Allanach K L, Tari L W. Plant aromatic L-amino acid decarboxylases: evolution, biochemistry, regulation, and metabolic engineering applications[J]. Phytochemistry, 2000, 54(2): 121-138.
[21] Gyorgy Z, Jaakola L, Neubauer P,etal.. Isolation and genotype-dependent, organ-specific expression analysis of aRhodiolaroseacDNA encoding tyrosine decarboxylase[J]. J. Plant Physiol., 2009, 166(14): 1581-1586.
[22] Ma L Q, Liu B Y,Gao D Y,etal.. Molecular cloning and overexpression of a novel UDP-glucosyltransferase elevating salidroside levels inRhodiolasachalinensis[J]. Plant Cell Rep., 2007, 26(7): 989-999.
[23] Yu H S, Ma L Q, Zhang J X,etal.. Characterization of glycosyltransferases responsible for salidroside biosynthesis inRhodiolasachalinensis[J]. Phytochemistry, 2011, 72(9): 862-870.
[24] 谷荣辉, 洪利亚, 龙春林. 植物细胞培养生产次生代谢物的途径[J]. 植物生理学报, 2013, 49(9): 869-881.
[25] 唐克轩, 沈 乾, 付雪晴. 植物次生代谢产物生物反应器研究进展[J]. 中国农业科技导报, 2014, 16(1): 7-15.
[26] Lin Y, Jain R, Yan Y. Microbial production of antioxidant food ingredients via metabolic engineering[J]. Curr. Opin. Biotechnol., 2014, 26: 71-78.
[27] Lin Y, Sun X,Yuan Q,etal.. Combinatorial biosynthesis of plant-specific coumarins in bacteria[J]. Metab. Eng., 2013, 18: 69-77.
[28] Marienhagen J, Bott M. Metabolic engineering of microorganisms for the synthesis of plant natural products[J]. J. Biotechnol., 2013, 163(2):166-178.
[29] Boghigian B A, Zhang H, Pfeifer B A. Multi-factorial engineering of heterologous polyketide production inEscherichiacolireveals complex pathway interactions[J]. Biotechnol. Bioeng., 2011, 108(6): 1360-1371.
[30] Xue F Y, Guo H, Hu Y Y,etal.. Expression of codon-optimized plant glycosyltransferaseUGT72B14 inEscherichiacolienhances salidroside production[J/OL]. Biomed. Res. Int., 2016, http://dx.doi.org/10.1155/2016/9845927.
[31] Bai Y F, Bi H P, Zhuang Y B,etal.. Production of salidroside in metabolically engineeredEscherichiacoli[J]. Sci. Rep., 2014, 4: 1-8.
Progress of Biosynthesis Mechanism and Genetic Engineering of Salidroside
HUANG Lina1, LIU Huan2, ZHANG Fenqiang2, JIANG Mengyan1, YU Yue1, ZHOU Yijie2, ZHOU Wangyan1, XUE Feiyan1, MA Lanqing1,3*
1.KeyLaboratoryofUrbanAgriculture(NorthChina),MinistryofAgriculture,CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China;2.KeyLaboratoryofUrbanAgriculture(NorthChina),MinistryofAgriculture,PlantScienceandTechnologyCollege,BeijingUniversityofAgriculture,Beijing102206,China;3.BeijingCollaborativeInnovationCenterforEco-environmentalImprovementwithForestryandFruitTrees,BeijingUniversityofAgriculture,Beijing102206,China
Salidroside, mainly fromRhodiolarosea, is an important active substance fromRhodiolaplants and has diversified medicinal efficacy such as radiation resistance, hypoxia resistance, tumor resistance, etc. Because of limited source of wildRhodiolarosea, extremely low ratio of Salidroside inRhodiolaroseaand low extraction rate of Salidroside, it is important and valuable to study production methods that could increase the output of Salidroside. Studying on Salidroside biosynthesis mechanism and using genetic engineering techniques to increase the output of Salidroside would have certain extent of promising prospect and value of study. This paper gave an overview of Salidroside biosynthesis mechanism, key enzymes in the metabolic pathway and the Salidroside synthesis method by means of metabolic engineering, followed by proposing the prospect of this study, which was expected to provide reference for research on Salidroside biosynthesis.
salidroside; key enzymes; metabolic engineering
2016-11-16; 接受日期:2016-12-16
国家自然科学基金项目(21606020);北京市自然科学基金项目(2164059);北京市优秀人才资助项目(2013D05021000003);北京市科技创新服务能力建设-协同创新中心项目(PXM2017_014207_000043)资助。
黄丽娜,硕士研究生,研究方向为细胞代谢工程。E-mail:buguxing@126.com。*通信作者:薛飞燕,讲师,研究方向为生物发酵。E-mail:feiyanxue@bua.edu.cn;马兰青,教授,研究方向为植物次生代谢分子调控。E-mail: lqma@bac.edu.cn
10.3969/j.issn.2095-2341.2017.02.04
