半胱氨酸链蛋白及其在听觉形成中的作用
2017-03-29张世丽郭维维乔月华杨仕明
张世丽 郭维维 乔月华,3 杨仕明
1 半胱氨酸链蛋白(cysteine string protein,CSP)的发现和基本概述
CSP首次发现于果蝇中,因该蛋白存在由11个连续的半胱氨酸形成的半胱氨酸串状结构,因此发现者将其命名为半胱氨酸链蛋白[1]。随后,在太平洋电鳐[2]和哺乳动物(如大鼠、小鼠、牛等)中也证实有CSP的存在[3,4],并发现CSP位于突触囊泡上[5]。早期研究认为CSP仅存在于神经元细胞,但随后的研究证实CSP也表达于一些非神经元细胞的分泌颗粒中,包括内分泌、神经内分泌以及外分泌细胞[3,4]。哺乳动物有3个CSP编码基因,分别编码CSPα,β,γ3个亚型,CSPα是最主要的一个亚型,在许多细胞特别是几乎所有的神经元细胞中均有表达。与此CSPα不同的是CSPβ和CSPγ的表达范围较局限,目前报道,CSPβ表达于睾丸组织、脑组织以及耳蜗毛细胞中[6],而CSPγ只在睾丸组织中表达[7]。虽然CSPβ的生物学功能尚不清楚,但它与CSPα具有高度的同源性,因此猜测两者具有相似的生物学功能,然而,研究者对CSPγ氨基酸序列进行分析发现其与CSPα氨基酸序列差异较大,故分析其功能可能与其他2个亚型存在较大差异[8]。
2 CSP的蛋白质序列
对CSP进行序列分析发现该蛋白包含4个结构域,见图1。①N-端J结构域,该结构域高度保守,为酵母菌DnaJ/Hsp分子伴侣家族的特征性结构域,因此,CSP是DnaJ/HSP分子伴侣家族的一员。在CSP的J结构域具有特征性的HPD模体结构,与Hsp 70/Hsc 70相结合,并激活Hsp 70/Hsc 70的ATP酶以及改变结合Hsc 70的底物的聚合[9];②疏水中心半胱氨酸串区域,该区域高度棕榈酰化,与CSP的膜黏附有关;③保守的连接结构域,连接J结构域和半胱氨酸串结构域,高度保守,有研究认为该结构域对CSP参与胞外分泌过程具有重要作用;④多样性的C端结构域,DnaJ的C端结构域可连接CSP的底物蛋白[10]。
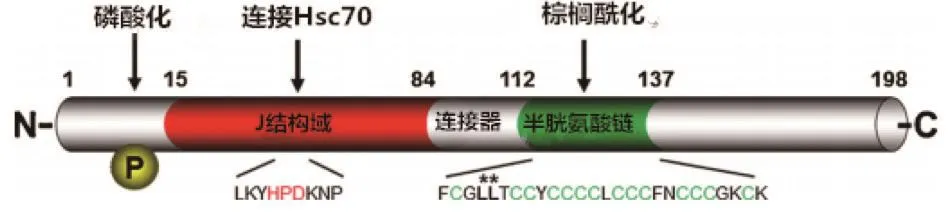
图1 人类CSPα的结构域。从左到右依次为丝氨酸磷酸化位点、J结构域上的HPD模体、连接结构域、半胱氨酸串结构域、C端结构域[11]
3 CSP的功能
在对果蝇CSP无义突变体进行研究时发现,CSP具有重要的功能。这种突变导致大部分果蝇在未发育成熟时就已经死亡,只有小部分能存活到成年,但往往发育成温度敏感型瘫痪表型并且寿命较野生型明显缩短[12,13]。对存活突变果蝇幼体的神经肌肉连接进行研究发现,CSP缺失严重降低正常温度范围内诱发的神经递质释放,果蝇在高于正常温度时的神经递质释放几乎停止[7]。基于以上研究成果,研究者对CSP在突触囊泡中的具体功能进行了更为深入的研究。
3.1 CSP调节钙离子通道
有学者认为CSP通过增加钙离子通道的活性促进递质释放[14],然而,在tsa-201细胞,CSP与瞬时表达的N型钙离子通道共表达产生一种由Gβγ介导的钙离子通道紧张性抑制[15]。因此,钙离子通道的调控模式或许依赖于蛋白环境。
目前为止,CSP敲除小鼠和果蝇并没有就CSP介导调控突触前膜钙离子通道提供直接的证据[16]。尽管如此,CSP突变果蝇表现为突触前膜钙离子水平升高[17],CSPα敲除小鼠的神经肌肉连接处也可能表现出钙离子水平增高[16]。CSPα很可能调节异三聚体G蛋白与Hsc 70和SGT(small glutamine-rich tetratricopeptide repeatcontaining protein)结合,CSPα通过单独的连接位点与G蛋白的α-和βγ亚基相连,并与任一连接位点相互作用引出N型钙离子通道的紧张性抑制[15]。CSP与P/Q型钙离子通道之间的相互作用也被注意到,但这种作用的功能尚不清楚。
3.2 CSP的分子伴侣功能
果蝇CSP突变可产生温度诱发性表型,而CSP是DnaJ分子伴侣家族的一员,具有典型的J结构域,能与Hsp 70/Hcs 70结合[18],由此人们做出假设,认为CSP具有分子伴侣的功能。为了证明这一假设,研究者进行了相关实验[19,20]。
最初研究发现,CSP像其他DnaJ蛋白一样,可以与变性的蛋白质结合。此外,CSP与Hsc 70协同作用防止变性蛋白质聚集,显示这两个蛋白能够发挥分子伴侣的功能[10]。Tobaben等人证明CSP/SGT/Hsc 70复合体构成了一个位于突触囊泡表面的突触伴侣结构,该结构可使邻近突触囊泡表面的错误折叠的蛋白质重新折叠,从而使变性失活的蛋白质恢复活性[20]。
3.3 CSP与SNARE蛋白相互作用
目前的数据表明,虽然CSP或许具有调节钙离子通道的功能,但它一定也在胞吐机制中发挥直接作用。CSPα过表达提高PC12细胞的胞吐功能[21],但抑制胰岛素分泌细胞的胞外分泌功能[22]。肾上腺嗜铬细胞中过表达CSPα通过减少释放次数以及减缓释放动力学,破坏儿茶酚胺的分泌,说明CSP调节涉及膜融合步骤的蛋白质[23]。
小泡缔合性膜蛋白(vesicle-associated membrane protein,VAMP)和突触融合蛋白(syntaxin-1)以及SNAP-25(soluble attachment proteins-25)相互作用,组成一个非常稳定的SNARE复合体[27]。SNARE蛋白复合体是突触前囊泡释放运动的基本蛋白质,也因此被认为可能是CSP的作用底物。在果蝇体内,当只有CSP的过表达时对果蝇幼体神经肌肉接头处的囊泡释放递质活动没有明显的影响,但能抑制因突触融合蛋白1A(syntaxin-1A)过表达导致的囊泡释放递质活动下降,表明CSP调节突触融合蛋白(syntaxin-1)之间的相互作用[25]。在CSPα基因敲除小鼠,SNAP-25、SNAP-23、α-synuclein(α-突触核蛋白)、Hsp 70,Hsc 70以及聚合的SNARE复合体的水平下降[29]。SNARE同时与Hsc 70和CSP相连,共同调节突触囊泡的胞吐过程。
4 CSP对突触的神经保护作用
通过对CSP突变果蝇进行研究发现,CSP具有重要的神经保护作用。随后对CSPα敲除小鼠进行分析,CSP的神经保护作用表现更为突出。在敲除鼠出生后2周内,表现正常,并没有出现任何神经递质缺失症状[7],但是,在2~4周敲除鼠即出现进行性致命性感觉运动功能损伤,并且在大约出生后8周死亡[7]。这些CSPα敲除小鼠还表现出广泛迅速的视网膜感光细胞退行性病变[27],对敲除小鼠进行更为详细的分析显示,神经肌肉接头处的突触囊泡循环遭到破坏[28]。
目前,尚不清楚为何完全缺乏CSP会导致果蝇有大约95%的胚胎死亡,而对CSP敲除线虫和小鼠的生育和早期生存能力却没有影响,这可能反映了CSP在果蝇发育过程中发挥特殊的功能。老年秀丽隐杆线虫dnj-14突变体神经退行性病变首先影响感觉神经元,而且实际上在神经退行性病变明显之前这些动物就表现出严重的化学感觉神经元功能损坏[29]。
5 CSP与神经退行性疾病
近年人们逐渐发现CSP与人类一些神经系统疾病有直接关系。有报道称编码CSPα蛋白的DNAJC5基因发生突变,导致成年神经元蜡质样脂褐素沉积病(adult-onset neuronal ceroid lipofuscinosis,ANCL)[30]。研究者发现在DNAJC5基因中有两个致病突变位点c.346_348delCTC和c.344T>G,这两个突变分别导致半胱氨酸串结构域中的p.Leu116del缺失和p.Leu116del改变,从而影响CSPα的棕榈酰化以及CSPα在神经元细胞中的数量。这些改变导致突触前膜功能破坏,神经进行性退变,错误折叠的蛋白质和不能水解的蛋白质以脂质沉积的形式在溶酶体内蓄积[30]。在ANCL临床早期阶段,神经纤维没有或仅有很少的CSPα表达减少,而在该疾病晚期病例的脑组织匀浆样本中CSPα,SNAP-25表达量明显下降[31]。还有报道称CSPα在阿尔茨海默病中也发挥保护作用[32]。在疾病的早期,前脑中的CSPα表达量减少,这种改变可能影响突触退变的早期阶段。然而有趣的是,患者小脑组织中的CSPα的表达量上调,甚至能达到年轻人健康水平,这或许是一种保护脑组织的机制[32]。
6 CSP与听觉产生
传入到内耳的声音信号是通过对毛细胞产生机械刺激,引起其释放神经递质,从而造成传入神经元兴奋而引发动作电位,而将兴奋传入听觉中枢系统。毛细胞的纤毛受到机械刺激后,可打开其机械换能通道,钾离子和钙离子在电压差的作用下由中阶(内淋巴液,高钾)进入毛细胞,使毛细胞电位升高,引起电压依赖性钙通道的打开,使毛细胞去极化。与其他神经细胞和感受器不同,毛细胞本身不产生动作电位,而是产生感受器电位,促进毛细胞底部的神经递质释放。用荧光标记的实验方法发现这些钙通道分布在内毛细胞侧底部称为突触前膜兴奋区的部位[33]。
内毛细胞的电压依赖性钙通道对产生毛细胞感受器电位至关重要。内毛细胞的主要兴奋性神经递质为谷氨酸,在毛细胞内有许多谷氨酸的突触囊泡。内毛细胞内存在一种称为突触带的独特结构,突触带是一椭圆的电子密集体,直径小于1μm,可附着约100个突触囊泡[34]。耳蜗内神经纤维按功能可分为传入神经和传出神经纤维,其中的传入神经是将听觉信息传入中枢神经系统的唯一通道。内毛细胞直接与所有的Ⅰ型螺旋神经节细胞形成突触并组成辐射状传入神经纤维进入脑干的蜗核,外毛细胞的传入神经起源于为数不多的Ⅱ型螺旋神经节细胞。外侧橄榄耳蜗系统起源于同侧上橄榄复合体外侧,对内毛细胞与Ⅰ型螺旋神经节细胞形成的传入突触进行反馈调节;内侧橄榄耳蜗系统起源于上橄榄复合体的内侧核,其神经纤维大部分交叉到对侧,对外毛细胞的活动进行负反馈调节。
传统的中枢神经系统突触囊泡中含有突触蛋白(synapsin),突触小泡蛋白(synaptophysin),突触结合蛋白Ⅰ、Ⅱ、Ⅲ和Ⅴ(synaptotagminⅠ、Ⅱ、Ⅲ和Ⅴ),突触融合蛋白(syntaxin-1)以及SNAP-25和VAMP,这些蛋白之间相互作用共同调控神经递质胞吐过程。已有研究者报道在中枢神经系统CSP与突触融合蛋白(syntaxin-1)、VAMP 2相互作用并直接或间接作用于钙离子通道[35]。其中,突触融合蛋白(syntaxin-1)、SNAP-25和VAMP 1在毛细胞中也有表达并组成一个重要的复合体(SNARE复合体)参与神经递质的胞吐过程[35]。
6.1 CSP在内毛细胞中表达
Eybalin等对CSP在耳蜗发育成熟过程中的表达和调控情况进行了研究,发现CSP及其mRNA在螺旋神经节细胞和内毛细胞中均有表达[35]。Schmitz等用CSPα敲除鼠对视网膜和内耳中的带状突触进行研究发现,敲除CSPα导致小鼠视网膜感光细胞带状突触在幼鼠睁眼之前就发生严重的快速的神经退行性变,这种病变导致小鼠进行性眼盲[21]。相反,听觉内毛细胞的带状突触并未出现类似的突触前膜病变,听力也未受到任何影响。这是因为内毛细胞带状突触还表达另一CSP亚型-CSPβ,可能是这一亚型代偿了CSPα的功能[27]。另有研究者分离CBA小鼠的耳蜗基底膜内外毛细胞分别进行基因测序发现内毛细胞上表达Dnajc5b基因[36],而这个基因正是CSPβ的编码基因。这些研究报道说明CSP在内毛细胞上有表达,且表达的亚型至少有1种。敲除CSPα只对视网膜感光细胞的带状突触产生影响,对视网膜其他细胞突触没有明显影响[27]。比前有研究者发现CSP位于内毛细胞突触带的突触囊泡上[35]。
6.2 CSP在橄榄耳蜗束神经纤维末端表达
CSP在外侧橄榄耳蜗束和内侧橄榄耳蜗束神经纤维末端的突触前分布存在差异[35]。大鼠出生当天(P0)在基底膜底回内毛细胞下的神经纤维内就有微弱的CSP免疫反应,并且在此时就可观察到CSP与突触小泡蛋白(synaptophysin)共定位的实验结果。大鼠出生后2天,在底回和中回的内毛细胞以及底回第一排外毛细胞下的神经纤维内有这两者的共定位免疫反应。到出生后第四天,底回的所有外毛细胞之下的神经纤维内都检测到这种共定位现象。出生后第8天,CSP和突触小泡蛋白(synaptophysin)共定位于整个基底膜的所有内外毛细胞之下[35]。
6.3 CSP与内毛细胞动作电位的关系
首次记录到微音电位和听神经复合动作电位是耳蜗功能开始出现的指标。微音电位发生在听神经活动之前,而复合动作电位(compound action potential,CAP)为听神经的同步化反应,是数根传入神经纤维动作电位的空间总和,大约在大鼠出生后11~12天出现。与此相对应的是,在出生12天之前的大鼠耳蜗内毛细胞内没有CSP的表达,直到出生后第12天,才在基底膜底回的内毛细胞底部检测到微弱的CSP免疫荧光。此免疫荧光信号主要位于内毛细胞核之下,靠近蜗轴的质膜侧。到出生后14天,内毛细胞内免疫荧光信号密度增强,而且中回的内毛细胞也出现了CSP的表达。到出生后16天,CSP的免疫荧光信号密度达成年鼠水平[35]。
与内毛细胞相反,在出生后大鼠耳蜗Corti氏器发育成熟的整个时期外毛细胞都不表达CSP或CSP mRNA,这可能与Ⅱ型螺旋神经节树突形成的突触有关。比如,Ⅱ型神经元不能向大脑传递听觉信息或者Ⅱ型神经元只能对非常高频的噪声刺激做出反应。外毛细胞中缺乏CSP的表达表明外毛细胞进行神经递质释放的机制与内毛细胞不同[35]。
总之,虽然CSP在内毛细胞中的功能和作用机制尚不明确,但它与带状突触的突触囊泡关系密切,并且CSP在内毛细胞的表达与耳蜗电位的出现和成熟保持同步,这表明CSP参与内毛细胞由声音诱发的谷氨酸释放,进一步说明CSP与神经递质释放有关,无论是在中枢神经系统还是在耳蜗内毛细胞的带状突触。同时,CSP不在外毛细胞表达,说明外毛细胞神经递质的释放与内毛细胞不同[35]。
7 总结与展望
CSP作为DnaJ/Hsp 40分子伴侣家族的一员,具有重要的分子伴侣功能,能通过调节Ca2+通道以及直接与突触囊泡膜上的SNARE复合体相互作用等方面调控突触囊泡的神经递质释放,具有重要的神经保护功能。近来发现CSP与一些神经退行性疾病,如阿尔茨海默病、ANCL有关。但关于CSP在耳科领域的研究较少,根据目前仅有的几篇研究报道,发现在耳蜗基底膜内毛细胞中至少有1种CSP亚型,且其表达情况与听力发育相关,这说明CSP极有可能在耳科领域也发挥着重要的作用。但CSP在内毛细胞中的具体功能及作用机制仍不明确,接下来仍需要大量的研究来明确CSP在内毛细胞中的功能,并探索其与内耳相关疾病,如听神经病的关系,为人类进一步认识听力发育以及相关疾病打下基础。
[1]Zinsmaier KE,Hofbauer A,Heimbeck G,et al.A cysteinestring protein is expressed in retina and brain of Drosophila[J].J Neurogenet,1990,7:15-29.
[2]Gundersen CB,Umbach JA.Suppression cloning of the cDNA for a candidate subunit of a presynaptic calcium channel[J].Neuron,1992,9(3):527-537.
[3]Braun JE,Scheller RH.Cysteine string protein,a DnaJ family member,is present on diverse secretory vesicles[J].Neurophar macology,1995,34:1361-1369.
[4]Chamberlain LH,Burgoyne RD.Identification of a novel cysteine string protein variant and expression of cysteine string proteins in non-neuronal cells[J].The Journal of biological chemistry,1996,271(13):7320-7323.
[5]Mastrogiacomo A,Parsons SM,Zampighi GA,et al.Cysteine string proteins:a potential link between synaptic vesicles and presynaptic Ca2+channels[J]. Science,1994,263:981-982.
[6]Gundersen CB,Kohan SA,Souda P,et al.Cysteine string protein β is prominently associated with nerve terminals and secretory organelles in mouse brain[J].Brain Research,2010,1332:1-11.
[7]Fernandez-Chacon R,Wolfel M,Nishimune H,et al. The synaptic vesicle protein CSP alpha prevents presynaptic degeneration[J]. Neuron,2004,42:237-251.
[8]Evans GJ,Morgan A,Burgoyne RD.Tying everything together: the multiple roles of cysteine string protein (CSP)in regulated exocytosis[J].Traffic, 2003,4(10):653-659.
[9]Chamberlain LH,Burgoyne RD.Activation of the ATPase activity of heat-shock proteins Hsc70/Hsp70 by cysteinestring protein[J]. The Biochemical journal,1997,322(Pt 3):853-858.
[10]Chamberlain LH, Burgoyne RD.The molecular chaperone function of the secretory vesicle cysteine string proteins[J]. The Journal of biological chemist ry,1997,272(50):31420-31426.
[11]Robert D. Burgoyne AM. Cysteine string protein (CSP) and its role in preventing neurodegeneration[J]. Seminars in Cell& Developmental Biology,2015,40:153-159.
[12]Zinsmaier KE, Eberle KK, Buchner E,et al.Paralysis and early death in cysteine string protein mutants in Drosophila[J]. Science,1994,263:977-980.
[13]Umbach JA,Zinsmaier KE, Eberle KK,et al.Presynaptic dysfunction in Drosophila csp mutants[J].Neuron.1994,13(4):899-907.
[14]Chen S,Zheng X,Schulze KL,et al.Enhancement of presynaptic calcium current by cysteine string protein[J].The Journal of physiology,2002,538(Pt 2):383-389.
[15]Miller LC,Swayne LA,Kay JG,et al.Molecular determinants of cysteine string protein modulation of N-type calcium channels[J].Journal of cell science,2003,116(Pt 14):2967-2974.
[16]Ruiz R,Casanas JJ,Sudhof TC,et al.Cysteine string protein-alpha is essential for the high calcium sensitivity of exocytosis in a vertebrate synapse[J].Eur J Neurosci,2008,27:3118-3131.
[17]Dawson-Scully K,Bronk P,Atwood HL,et al. Cysteinestring protein increases the calcium sensitivity of neurotransmitter exocytosis in Drosophila[J]. The Journal of neuroscience: the official journal of the Society for Neuroscie nce,2000,20(16):6039-6047.
[18]Bronk P,Wenniger JJ,Dawson-Scully K,et al. Drosophila Hsc70 4 is critical for neurotransmitter exocytosis in vivo[J].Neuron,2001,30:475-488.
[19]Terada K,Kanazawa M,Bukau B, et al.The human DnaJ homologue dj2 facilitates mitochondrial protein import and luciferase refolding[J].The Journal of cell biology,1997,139(5):1089-1095.
[20]Tobaben S,Thakur P,Fernandez-Chacon R,et al.A trimeric protein complex functions as a synaptic chaperone machine[J]. Neuron,2001,31:987-999.
[21]Chamberlain LH,Burgoyne RD.The cysteine-string domain of the secretory vesicle cysteine-string protein is required for membrane targeting[J].The Biochemical journal, 1998,335(Pt 2):205-209.
[22]Zhang H,Kelley WL,Chamberlain LH,et al.Mutational analysis of cysteine-string protein function in insulin exocytosis[J].Journal of cell science,1999,112(Pt 9):1345-1351.
[23]Graham ME,Burgoyne RD.Comparison of cysteine string protein (Csp) and mutant a-SNAP overexpression reveals a role for Csp in late steps of membrane fusion in Dense-Core granule exocytosis in adrenal chromaffin cells[J]. J Neurosci,2000,20:1281-1289.
[24]Sutton RB,Fasshauer D,Jahn R,et al.Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution[J].Nature,1998,395(6700):347-353.
[25]Nie Z,Ranjan R,Wenniger JJ,et al.Overexpression of cysteine string protein in Drosophila reveals interactions with syntaxin[J].J Neurosci,1999,19:10270-10279.
[26]Zhang YQ,Henderson MX,Colangelo CM,et al. Identification of CSPalpha clients reveals a role in dynamin 1 regulation[J].Neuron,2012,74(1):136-150.
[27]Schmitz F,Tabares L,Khimich D,et al.CSPalpha-deficiency causes massive and rapid photoreceptor degeneration[J].Proc Natl Acad Sci USA,2006,103:2926-2931.
[28]Rozas JL,Gómez-Sánchez L,Mircheski J,et al.Motorneurons require cysteine string protein-alpha to maintain the readily releasable vesicular pool and synaptic vesicle recycling[J]. Neuron,2012,74:151-165.
[29]Kashyap SS,Johnson JR,McCue HV,et al. Caenorhabditis elegans dnj-14,the orthologue of the DNAJC5 gene mutated in adult onset neuronal ceroid lipofuscinosis, provides a new platform for neuroprotective drug screening and identifies a SIR-2.1-independent action of resveratrol[J]. Human molecular genetics,2014,23(22):5916-5927.
[30]Noskova L,Stranecky V,Hartmannova H,et al.Mutations in DNAJC5,encoding cysteine-string protein alpha,cause autosomal-dominant adult-onset neuronal ceroid lipofuscinosis[J].American journal of human genetics,2011,89(2):241-252.
[31]Benitez BA,Cairns NJ,Schmidt RE,et al.Clinically earlystage CSPα mutation carrier exhibits remarkable terminal stage neuronal pathology with minimal evidence of synaptic loss[J].http://doi.org/10.1186/s40478-015-0256-5.2015-11-26.
[32]Tiwari SS,d’ Orange M,Troakes C,et al.Evidence that the presynaptic vesicle protein CSPalpha is a key player in synaptic degeneration and protection in Alzheimer’s disease[J]. http://doi.org/10.1186/s13041-015-0096-z.2015-08-06.
[33]Issa NP,Hudspeth AJ.The entry and clearance of Ca2+at individual presynaptic active zones of hair cells from the bullfrog's sacculus[J].Proc Natl Acad Sci USA,1996,93(18):9527-9532.
[34]Seal RP,Akil O,Yi E,et al.Sensorineural Deafness and Seizures in Mice Lacking Vesicular Glutamate Transporter 3[J].Neuron,2008,57:263-275.
[35]Eybalin M,Renard N,Aure F,et al.Cysteine-string protein in inner hair cells of the organ of Corti: synaptic expression and upregulation at the onset of hearing[J].The European journal of neuroscience,2002,15(9):1409-1420.
[36]Liu H,Pecka JL,Zhang Q,et al.Characterization of transcriptomes of cochlear inner and outer hair cells[J].The Journal of neuroscience, 2014,34(33):11085-11095.
