林蛙油蛋白水解产物对小鼠抗疲劳的作用及其生理机制
2017-03-29李志刚
李志刚,王 昶
(东北师范大学体育学院,吉林 长春 130024)
运动性疲劳是指机体在生理过程中不断继续在特定水平上进行或整个机体不能维持预定的运动强度[1]。研究表明[2]:长期的耐力训练能够诱发机体产生运动性疲劳。关于运动性疲劳产生机制以及如何促进运动性疲劳的恢复是当前体育科学领域面对的重大课题。耐力训练导致的运动性疲劳的生理机制是一个极其复杂的问题,众多学者对运动性疲劳产生的原因以及其中的相关机制的研究存在诸多争议,形成了较多的假说。其中较为共识的一种说法是:在进行长期的大强度耐力训练时,体内自由基产生就会增多,导致体内原有的自由基产生与清除之间的平衡被破坏,结果自由基浓度超过了伤害的“阈值”,进而引起了大量的细胞和组织损伤并导致多种疾病与絮乱[3]。因此,有必要在运动员耐力训练后,及时对机体自由基进行清理,避免耐力训练打破身体氧化系统和抗氧化系统之间的平衡。活性自由基的积累使机体处于氧化应激状态,攻击大分子和细胞器官,给身体造成伤害。关于对机体自由基进行清理的研究,有研究者认为[4]:肌肉细胞含有复杂的内源性细胞防御机制来清除活性氧(如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT))及抵抗其他运动性氧化应激损伤。而有学者质疑:仅凭肌肉细胞内的内源性细胞防御机制来清除自由基并不能起到抗疲劳的效果。但有研究发现[5]:外源性膳食抗氧化剂还可以减少运动性氧化应激的影响并提高动物的生理状态。原因可能是外源性抗氧化剂可以与内源性抗氧化剂相互作用或促进,形成抗氧化细胞网络。然而,其机制尚未完全阐明。关于外源性膳食抗氧化剂的提取,众多研究者都做了相关的研究,在一些植物中,诸如:红曲米、雪莲组织培养提取物、锡兰发柄花中都发现含有内源性抗氧化剂的存在。耿进霞等人发现[6]:雪莲可能具有增强运动耐力、抗疲劳、抗体力性疲劳和消除疲劳的作用,但是雪莲中的内源性抗氧化剂含量极少,只有通过大剂量的雪莲才能起到抗疲劳的作用。但是这一发现,促进了更多学者去探索某种饮食对抗疲劳的作用及效果,以便去提取更多的天然抗氧化成分,既可以减少氧化损伤和对抗疲劳,又没有其他抗疲劳药物产生的副作用。
随着研究的不断深入和发展,众多研究表明[7]:林蛙油可以有效促进蛋白质的合成,抑制氨基酸和蛋白质分解,提高运动训练大鼠血红蛋白和糖原的储备。林蛙油来自于晒干的雌林蛙输卵管,也称为蛤蟆油。更早的研究已表明林蛙油主要由蛋白质构成,占50%或更多,主要分布在中国东北。作为最有名及价值极高的东方食品和药物,中医认为蛤蟆油能滋阴、润肺和补肾精。林蛙油虽然对机体运动性疲劳具有较好的恢复效果,但是始终未能清晰林蛙油抗疲劳和抗氧化的生理机制。基于此,本研究试图探讨林蛙油水解产物(ORPH)的抗氧化和抗疲劳作用,通过3种蛋白水解酶来制备ORPH,通过观察ORPH对机体生理指标的影响及变化,总结ORPH对运动性疲劳恢复的生理机制,为药物临床研究提供有力支持。
1 材料与方法
1.1 材料 林蛙油来源于中国棕色成熟期雌蛙(中国吉林省白头山中国林蛙养殖场)。中性蛋白酶、木瓜蛋白酶和碱性蛋白酶购自上海凯阳生物技术有限公司。肝糖原(LG)、腓肠肌糖原(MG)、血浆乳酸(BLA)、血尿素氮(BUN)等试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 ORPH提取方法
1.2.1.1 林蛙油预处理 去除林蛙筋膜,压碎、40目筛过滤得林蛙油粉。将林蛙油粉倒入石油醚,脱脂3次。室温蒸发溶剂,在烘箱中于35℃干燥林蛙油。
1.2.1.2 ORPH的提取 1)分离林蛙油蛋白粉。将林蛙油剪碎,与PBS(0.01mol/L)缓冲液按照1∶10的比例混合,利用超声波破碎细胞15min,将破碎的细胞液置于冰浴下间歇冷却(30s∶30s),再将破碎的细胞液置于4℃的气温下,按照8000r/min离心20min后,吸取上清液,将固体硫酸铵缓慢加入上清液,至其饱和度达到95%。再将其置于4℃的气温下,按照8000r/min离心20min后,收集沉淀,透析真空,冷冻干燥[8]。2)采用中性蛋白酶、碱性蛋白酶和木瓜蛋白酶消化林蛙油蛋白。使用搅拌器将林蛙油蛋白粉与水(1∶10m/v)混合。将混合物置于恒温水浴10h,使用NaOH(0.05mol/L)调节pH,接着将混合物加热到100℃,保持10min,使酶失活。3种混合物冷却至室温后,将pH值调节为中性。3种混合物按照8000r/min离心20min,收集清澈上清液。然后,根据自由基清除能力选择最合适的蛋白酶。
1.2.1.3 ORPH的制备 采用软件设计正交实验,然后根据对自由基的清除能力选择最佳的水解条件。

表1 正交实验设计(L9(34))
1.2.2 ORPH抗氧化性的测定 由于用于抗氧化能力评估的自由基系统可能显著影响结果,普遍提倡使用不同的自由基系统来评估这种能力[9]。蛋白水解产物的抗氧化性是通过对羟基自由基和DPPH自由基的清除能力来确定的。具体做法是通过添加不同剂量的蛋白质水解产物(2、4、6、8、10mg/ml)测定其清除能力,进而评价蛋白水解产物的抗氧化性。
ORPH属于蛋白水解产物,对ORPH抗氧化性的测定采取不同自由基系统来评估,为了能最大效度地发挥ORPH抗氧化性,通过木瓜蛋白酶、碱性蛋白酶和中性蛋白酶3种蛋白酶制备了3种ORPH,并分别对3种ORPH进行测定,选择对自由基清除能力最强的ORPH水解条件。1.2.2.1 对羟基自由基清除能力的测定 测定羟基自由基清除能力[10],将2.0ml FeSO4(9.0mmol/L)、2.0ml水杨酸-乙醇溶液(9.0mmol/L)混合物与不同浓度的样品溶液混合。然后加入2.0mlH2O2(0.01%)混匀。混合物在37℃孵育30min,测510nm处吸光度(UV754,中国上海先健科学仪器有限公司),采用2.0ml蒸馏水作为对照,重复3次。
采用如下公式:
羟基自由基清除能力(%)=[(A0-A1)/A0]×100%A0:使用蒸馏水的空白溶液吸光度;A1:样品吸光度。
1.2.2.2 对DPPH自由基清除能力的测定 测定DPPH自由基清除能力[11]。2.0ml不同浓度的样品溶液与2.0ml含有0.10mmol/L DPPH-纯乙醇的溶液混合。使用搅拌器(QT-1搅拌器,中国上海天辰科技有限公司)用力振摇混合物,置阴暗处30min。测定最终溶液在517nm处的吸光度。采用2.0ml蒸馏水作为对照,重复3次。
采用如下公式计算清除能力:
对DPPH自由基的清除能力(%)=[(A2-A1)/A0]×100%
A0:混合有蒸馏水DPPH吸光度;A1:混合有纯乙醇样品溶液吸光度;A2:混合有DPPH-纯乙醇样品溶液吸光度。
1.2.2.3 对超氧阴离子清除能力的测定 测定超氧阴离子清除能力[12]。4.0mlTris-HCl(pH8.2,50.0mM)与2.0ml不同浓度的样品溶液混合物与1.0ml焦棓酚(25.0mM)混合,25℃培养20min。加50μl浓烟酸(10M)终止反应。测定最终溶液在420nm处的吸光度。采用2.0ml蒸馏水作为对照。重复3次。
采用如下公式计算清除能力:超氧阴离子清除能力(%)=[1-(A2-A1)/A0]×100 %A0:无样品的焦酚吸光度.A1:无焦酚的样品吸光度A2:有样品的焦酚吸光度。
1.2.3 实验设计
1.2.3.1 动物和饮食 5周大雄性昆明小鼠购自中国吉林大学药理学实验中心。小鼠按下列条件饲养:环境温度23±1℃、相对湿度55±10%、换气速率每小时10次、12:12h明暗周期。动物任意摄取市售标准小鼠饮食和水。所有实验均获得批准,并按照《动物护理和使用指南》(中国动物伦理委员会,根据美国营养学会AIN-93)实施,食物和水任意供给。1周适应期后,40只体重为20±2g的小鼠随机分为5个实验组:对照组和ORPH 50、100、500、1000mg/kg剂量组,每天游泳训练前下午3:00灌胃给药,持续4周。
1.2.3.2 训练计划 采用专门游泳训练模型。小鼠置于游泳水槽(50cm×40cm×40cm),水深30cm,灌胃给予ORPH后,在25±1℃水温下进行游泳训练,训练持续4周。在第1周,小鼠每天游泳10min。从第2至第4周,小鼠分别游泳15、20、25min。
1.2.3.3 力竭游泳测试 本研究采用力竭游泳测试(力竭时间定义为小鼠7s后不能浮出水面呼吸的时间[13])评估ORPH抗疲劳作用。4周后,每组取8只小鼠进行测试。简单来说,最后一次使用ORPH或蒸馏水治疗后,小鼠分开放置于游泳水槽(50cm×40cm×40cm),注水至水深30cm,水温控制在25±1℃。每只小鼠尾根部系上铅锤(体重的10%)。力竭定义为小鼠在10s内不能浮出水面。立即记录游泳时间。将小鼠从泳池取出,用纸巾擦干,放回原来的笼子。每个环节完毕后更换池水。
1.2.3.4 测量疲劳相关的生化指标 游泳能力测试结束后,力竭动物用10%水合氯醛(3.5ml/kg体重,腹腔注射)立即麻醉。采用肝素化管从腹主动脉收集血液样品。于4℃200×g分离血清10min,保存在-80℃深冻冰箱待分析。快速切开肝和腓肠肌肌肉,用冰冷的盐溶液清洗。然后将样品冷冻在-80℃的液氮中,直到分析糖原含量。使用购买的试剂盒,用比色法测定生化指标,包括肝糖原(LG)、腓肠肌肌糖原(MG)、血浆乳酸(BLA)。使用蒽酮试剂在620nm处测定LG和MG含量。采用氯化硝基四氮唑蓝试剂在530nm处测定BLA。采用谷氨酸脱氢酶耦合酶方法通过尿素酶评估BUN。
1.2.3.5 脂质过氧化测定 通过硫代巴比妥酸反应产物(TBARS)水平测定脂质过氧化[14]。采用分光光度法,通过TBARS浓度测定肝脏和腓肠肌丙二醛(MDA)。TBARS结果表示为nmol/mg蛋白质。每组样品在10mmol/L冰冷磷酸缓冲液中匀浆,然后与8.1%十二烷基硫酸钠、20%乙酸和0.75%2-硫代巴比妥酸溶液完全混匀。混合溶液于95°C烘箱加热30min。冷却后,3 500rpm离心15min去除凝絮。采用分光光度计在532nm处测定上层吸光度,并与制备好的1,1,3,3-四甲氧基丙烷标准曲线比较。根据Lowry的方法使用牛血清作为标准品测定样品蛋白含量[15]。
1.2.3.6 SOD活性试验 采用SOD活性试剂盒-WST(日本熊本同仁化学实验室)测定总SOD活性。简单而言,样品进行匀浆,使用Bradford方法[16]分析上清液的蛋白浓度。上清液采用黄嘌呤、黄嘌呤氧化酶和水溶性四唑盐WST-1的分析试剂培养。在黄嘌呤氧化酶作用下,由黄嘌呤底物生成的超氧化自由基将WST-1还原成WST-1二甲,在450nm处吸光度最大。胚胎中的SOD抑制WST-1还原,因为它可催化超氧化离子的歧化作用,生成分子氧和过氧化氢。采用分光光度计在450nm处测定WST-1的还原。
1.2.4 统计分析 数据用平均值±标准差(n=8)表示。使用方差分析与Tukey’s HSD事后检验测定平均值差异,用Spss20.0分析。P<0.05表示具有统计学意义。
2 结 果
2.1 ORPH抗氧化能力的测定结果
2.1.1 对羟基自由基清除能力的测定 如图1所示,所有蛋白酶均显示有清除羟基自由基的能力,其中中性蛋白酶水解产物和木瓜蛋白酶水解产物活性最大。水解产物的羟基自由基清除能力范围为14.82%~39.33%。中性蛋白酶水解产物的羟基自由基清除率比木瓜蛋白酶水解产物稍高。中性蛋白酶水解产物的清除率显著高于与碱性蛋白酶水解产物。3种蛋白酶水解产物的羟基自由基清除率随着浓度增加而增加。当蛋白水解产物浓度为10mg/ml,清除率达39.33%。考虑到自由基的生物学影响,这些结果具有生理学意义。
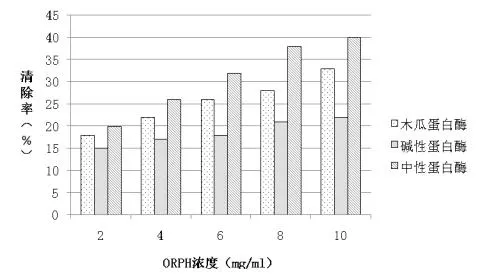
图1 羟基自由基清除能力
2.1.2 对DPPH自由基清除能力的测定 如图2所示,所有水解产物均能清除DPPH自由基。水解产物清除DPPH自由基的能力范围为23.86%~47.00%。3种酶中,中性蛋白酶作用的水解产物清除DPPH自由基的能力最高,清除率可达到47%。碱性蛋白酶作用下的蛋白水解产物随着浓度增加,清除自由基的能力稍微增加,该变化太小而难以看出,可能是由于碱性蛋白酶需要的碱性环境影响或破坏林蛙油的抗氧化剂。

图2 清除DPPH自由基的能力
2.1.3 对超氧阴离子清除能力的测定 如图3显示,由3种酶水解的蛋白水解产物中,由中性蛋白酶制备的蛋白水解产物清除超氧化阴离子的能力最强。3种蛋白酶水解产物清除超氧化阴离子的能力随着浓度增加而增加。当蛋白水解产物浓度为10mg/ml,清除率可达到32.61%。

图3 不同林蛙油蛋白水解产物对O2的清除能力
采用3种蛋白酶制备蛋白水解产物。根据这些结果,由中性蛋白酶制备的蛋白水解产物清除羟基自由基、超氧化阴离子、DPPH自由基的清除率均非常高。因此,后面实验选择中性蛋白酶。
2.1.4 正交实验结果 从正交结果来看,A2B2C2D2是最佳的水解组合。温度(A)为50℃,pH值(B)为7.5,酶剂量(C)为4%,水解时间(D)为10h。C的极值R意味着水解酶剂量是影响水解的主要因素。D、B、A依次下降表示水解影响因素的程度大小排列为:C>D>B>A。考虑到成本,C2是最佳选择。A2的平均值高于A1和A3,因此A2是最佳水解水平。同样地,B2和D2是最佳水平。因此A2B2C2D2确定为最佳水解条件。我们另外进行实验证实正交结果,水解产物的羟基自由基清除率达到39.35%,高于最大正交清除测试组,表明正交实验结果是真实的。
2.2 ORPH对小鼠游泳能力的影响 力竭游泳的测定可直接客观地反映个体的抗疲劳能力。表3显示,与对照组相比,蛋白水解产物中,高及最高剂量组的小鼠游泳时间显著增加。中剂量组和对照组之间有显著差异(P<0.05),高和最高剂量组与对照组相比均有非常显著的差异(P<0.01)。但低剂量组和对照组之间无显著差异(P<0.05)。证实蛋白水解产物可显著提高小鼠游泳时间,结果提示蛋白水解产物有明显的抗疲劳作用。
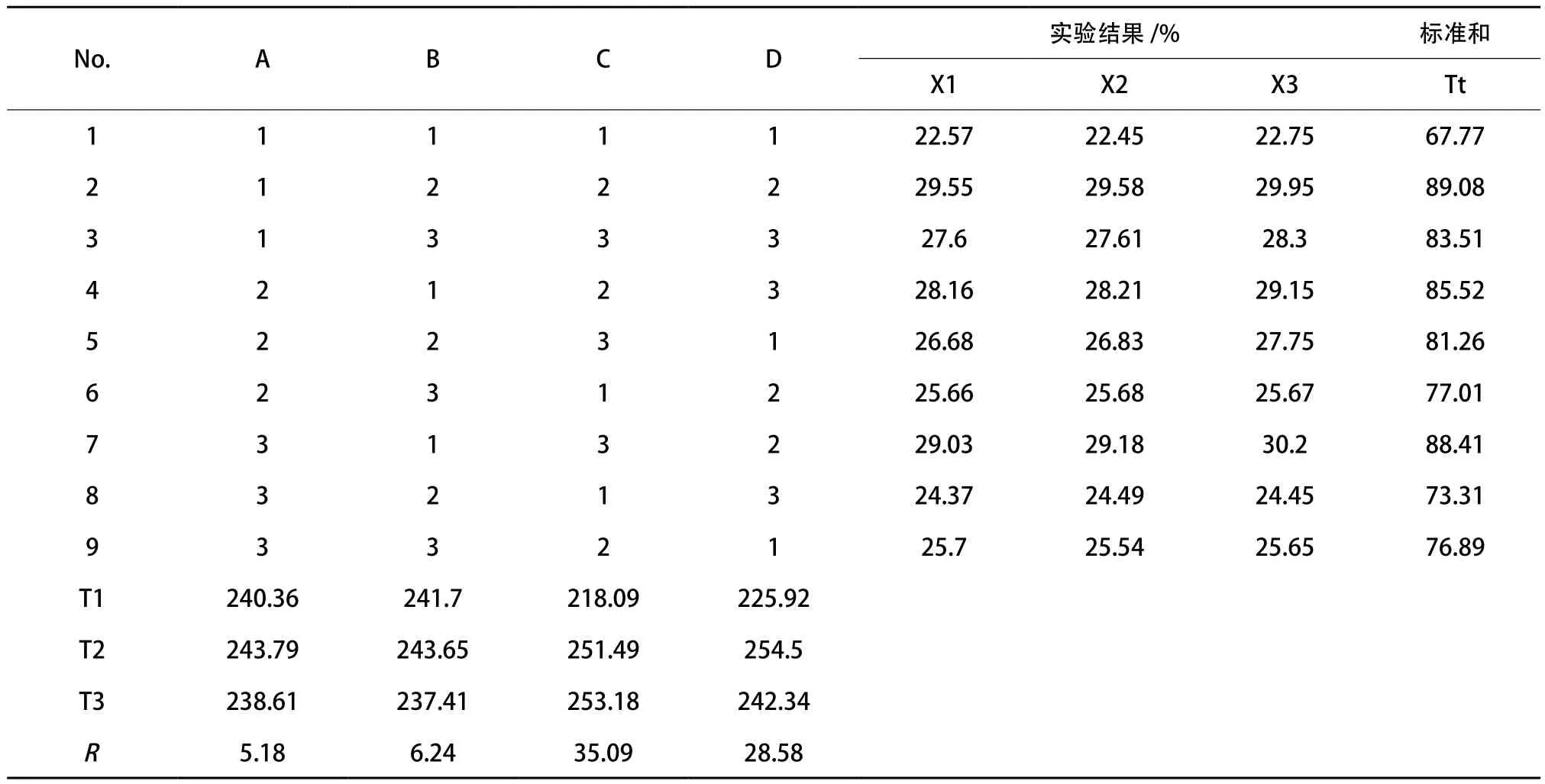
表2 正交实验设计和结果

表3 林蛙油酶解水解产物对游泳时间的影响
2.3 ORPH对小鼠疲劳相关生化指标的影响
2.3.1 ORPH对小鼠LG和MG的影响 随着运动负荷量的增加,脂肪酸代谢增大,肝糖原(LG)和肌糖原(MG)比率减少。肝糖原和肌糖原是影响疲劳形成的重要因素。表4(见下页)显示,林蛙油蛋白治疗组运动后肝糖原和肌糖原含量比对照组高。这些数据表明林蛙油蛋白治疗显著增加小鼠游泳后肝糖原和肌糖原的水平(P<0.05)。
2.3.2 ORPH对小鼠BLA和BUN的影响 血浆乳酸(BLA)和血尿素氮(BUN)是判断疲劳程度的重要指标。表5显示(见下页),游泳练习后,林蛙油蛋白治疗组的乳酸和血尿素氮水平低于对照组。林蛙油蛋白治疗组的乳酸水平分别下降8%、20%、39%和42%。此外,林蛙油蛋白治疗组的血尿素氮水平分别下降13%、18%、34%和45%。与对照组相比,林蛙油蛋白治疗组显著减少血浆乳酸和血尿素氮水平,并呈剂量依赖性(P<0.05)。
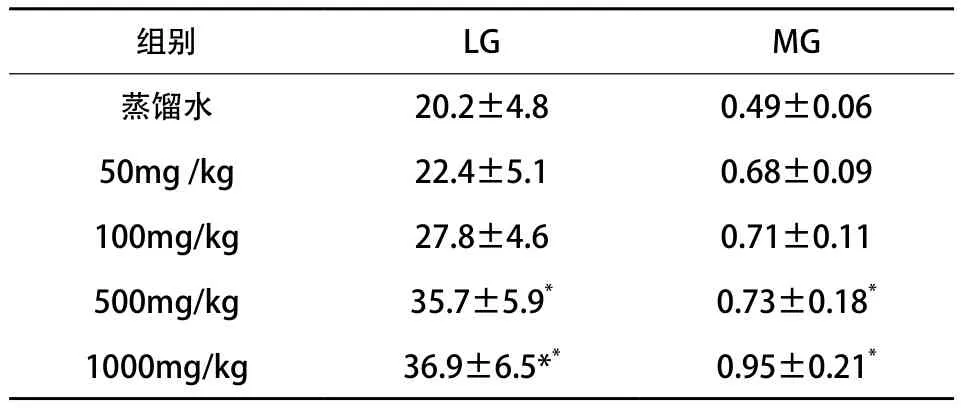
表4 林蛙油蛋白对小鼠LG和MG的影响

表5 林蛙油蛋白对BLA和BUN的影响
2.4 ORPH对肝脏MDA含量和SOD活性的影响 丙二醛水平(MDA)是脂质过氧化的终产物。表6显示,50、100、500、1000mg/kg林蛙油蛋白治疗组的MDA浓度与对照组相比分别下降4%、5%、17%和22%。500、1000mg/kg治疗组与对照组相比肝脏内MDA浓度显著降低(P<0.05)。

表6 林蛙油蛋白对肝脏MDA含量和SOD活性的影响
肝蛋白(SOD)属于生命体的活性物质。表6显示,对照组SOD活性为9.5±0.59。林蛙油蛋白治疗组SOD活性分别为10.1±0.76、10.9±0.64、12.5±0.72和11.6±0.98单位/mg蛋白。林蛙油蛋白治疗组肝脏内SOD活性与对照组相比显著增加(P<0.05)。此外,50和100mg/kg林蛙油蛋白治疗组与对照组相比无显著差异。
2.5 ORPH对腓肠肌内MDA含量和SOD活性的影响 表7显示,50、100、500、1000mg/kg林蛙油蛋白治疗组的MDA浓度与对照组相比分别下降10%、26%、19%和31%。500、1000mg/kg治疗组与对照组相比腓肠肌内MDA浓度显著降低(P<0.05)。

表7 林蛙油蛋白对腓肠肌内SOD活性和MDA含量的影响
表7显示,对照组SOD活性为5.9±0.25。林蛙油蛋白治疗组SOD活性分别为6.3±1.25、7.4±0.24、7.9±0.72和9.2±0.98单位/mg蛋白。林蛙油蛋白治疗组腓肠肌的SOD活性与对照组相比显著增加(P<0.05)。此外,50和100mg/kg林蛙油蛋白治疗组与对照组相比无显著差异。
3 讨论与分析
运动性疲劳指高强度运动后机体运动能力暂时性抑制[17]。在充足的休息和调节后,身体恢复作业能力。如果运动员在上次疲劳完全恢复之前诱发新的疲劳,累积疲劳最终会导致过度疲劳。过度疲劳会影响一个人的整体健康和运动能力。如果采取干涉措施消除或减少疲劳并促进体力全面恢复,可持续满足机体的能量需求,且可保持甚至增加锻炼强度,具有明确的运动益处。在高强度运动中,能量损耗和肌肉疲劳可能限制运动能力。通过注射蛋白或氨基酸来补充运动后的营养是加快疲劳恢复的关键[18]。与蛋白质相比,蛋白水解产物可快速轻松地被吸收。通过羟基自由基清除能力测定、DPPH自由基清除能力测定以及超氧化阴离子清除能力测定证明ORPH的抗氧化作用。
本研究证实蛋白水解产物可显著增加小鼠游泳时间,结果说明蛋白水解产物具有明显的抗疲劳作用。本文探讨了从林蛙油提取的蛋白水解产物是否能改善运动性疲劳。为评估林蛙油蛋白水解产物可能的作用机制,通过分析及测定小鼠的肝脏和血尿素氮(BUN)及乳酸水平,评估疲劳小鼠的肝脏和肌糖原。结果显示由中性蛋白酶消化制备的蛋白水解产物不仅在体外有抗氧化作用,而且在小鼠体内有抗氧化作用。本研究结果显示,大量运动诱导氧化应激,但林蛙油蛋白水解产物可通过抗氧化作用缓解疲劳。目前正在进行的实验可更深入地了解保健产品对预防小鼠因大量运动引起的氧化应激损伤的有用性、安全性及有效性,但未来仍需进行更多的研究。
4 结 论
中性蛋白酶制备ORPH最佳水解条件为:温度为50℃,pH值为7.5,酶剂量为4%,水解时间为10h。ORPH对游泳耐力训练大鼠运动性疲劳的恢复具有良好的作用,ORPH通过增加SOD活性改善酶抗氧化系统,从而达到抗疲劳、延长运动训练时间的作用,其生理机制可能是通过补充肝糖原和肌糖原,消除血乳酸、血尿素氮和肝脏、腓肠肌丙二醛,以及增强抗氧化酶的活性来实现的。
[1] 杨贻让.实用运动生理学[M].北京:北京体育大学出版社,1994.
[2] 钱华伟.大学生在健美运动中使用运动营养补剂的实验研究:以厦门大学嘉庚学院为例[J].中国学校体育(高等教育),2017(2):88-92.
[3] 刘军.Ebselen对大强度耐力训练大鼠自由基代谢和部分组织细胞形态学影响的实验研究[D].西安:陕西师范大学,2005.
[4] 丁进峰,苏秀榕,李妍妍,等.海蜇胶原蛋白肽的免疫活性的研究[J].水产科学,2011,30(6):359-361.
[5] 刘仁杰,陈光.林蛙油蛋白小钛抗氧化活性比较[J].食品工业,2016,37(8):158-160.
[6] 耿进霞,王沛,白芬兰,等.雪莲对小鼠抗疲劳的影响[J].环境与职业医学,2005(1):21-24.
[7] 娄春善,曹建民,郭娴,等.林蛙油对运动训练大鼠睾酮含量、物质代谢及抗运动疲劳能力的影响[J].中国实验方剂学杂志,2014,20(3):34-38.
[8] 郭淼,汪涛,崔梨,等.林蛙油蛋白酶水解物的免疫促进功能与抗氧化活性[J].食品科技,2014,39(3):211-214.
[9] 叶长林,王晓慧.运动对血浆游离DNA水平的影响、机制及意义[J].生理科学进展,2017,48(2):151-156.
[10] 黄晓东,蔡建秀,戴聪杰,等.桐花树叶醇提取物乙酸乙酯部位对大鼠皮肤抗氧化与抗衰老能力的影响[J].植物科学学报,2015,33(4):536-544.
[11] 赵玉红,刘瑞颖,张立钢.巴氏杀菌对黑加仑果汁特性和DPPH自由基清除能力的影响[J].食品工业科技,2016,37(15):140-144.
[12] 高维,张志强,张志勇,等.不同生长年限铁皮石斛提取物的抗氧化活性及其水溶液性质的研究[J].保鲜与加工,2016,16(3):67-70.
[13] 肖锦山,张玲.厚朴酚对力竭运动小鼠心肌肥厚及PPARγ和NF-κB表达的影响[J].沈阳体育学院学报,2016,35(4):94-99.
[14] 祁红学,刘秀萍,安静.硫代巴比妥酸法测定鱼体肌肉中脂质过氧化物含量的方法优化[J].安徽农业科学,2017,45(10):91-92.
[15] 卫辰,骆鹏,王丽婵,等.两种Lowry法检测百日咳疫苗原液蛋白含量的比较[J].中国生物制品学杂志,2017,30(5):519-523.
[16] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Ana.biochem,1976,72(2):248-254.
[17] 董煜.抗疲劳小麦肽运动能量胶的研发及作用分析[J].食品研究与开发,2017,38(5):148-151.
[18] 马月群,李洪.白灵菇运动饮料研制及其抗运动性疲劳功能研究[J].食品研究与开发,2017,38(3):109-112.
