脑卒中患者血清CHIL1、AnnexinA1与颈动脉粥样硬化斑块的关系及洛伐他汀干预效果
2017-03-21李永军杜明
李永军,杜明
(秦皇岛市第四医院检验科,河北 秦皇岛 066000)
脑卒中患者血清CHIL1、AnnexinA1与颈动脉粥样硬化斑块的关系及洛伐他汀干预效果
李永军,杜明
(秦皇岛市第四医院检验科,河北 秦皇岛 066000)
目的 探讨脑卒中患者血清几丁酶样蛋白1(CHIL1)、膜联蛋白A1(AnnexinA1)与颈动脉粥样硬化斑块的关系及洛伐他汀干预效果。方法选取2014年6月至2015年6月本院综合内科收治的168例首发脑卒中患者(脑卒中组),另选取160例身体健康体检者为对照组,应用颈动脉彩色多普勒超声检查两组颈动脉内-中膜厚度(IMT),应用全自动化生化分析仪测定两组甘油三脂(TG)、总胆固醇(TC)、低密度蛋白(LDL-C)、高密度蛋白(HDL-C)水平,应用酶联免疫法测定两组血清CHI3L1、AnnexinA1水平,胶体金法测定两组C反应蛋白(CRP)。应用Pearson单因素分析脑卒中患者IMT与血脂水平及血清CHIL1、AnnexinA1水平的关系。应用Logistic多因素分析脑卒中发生危险因素,对脑卒中患者给予洛伐他汀干预,20 mg/次,1次/d,共干预6个月,观察其干预效果。结果脑卒中组患者的IMT、血清TG、TC、LDL-C、CHIL1及CRP水平均高于对照组,而HDL-C、AnnexinA1水平低于对照组,差异均有统计学意义(P<0.05);经Pearson相关性分析显示,IMT与TG、TC、LDL-C、CHIL1、呈正相关(P<0.05),而与AnnexinA1 HDL-C呈负相关(P<0.05);经Logistic多因素分析显示,IMT、LDL-C、CHIL1、是脑卒中发生的独立危险因素(P<0.05),而AnnexinA1 HDL-C是脑卒中发生的保护因素(P<0.05)。经洛伐他汀干预3个月、6个月后脑卒中患者IMT、血清TG、TC、LDL-C、CHIL1及CRP水平较治疗前显著下降,血清AnnexinA1 HDL-C水平较治疗前升高,差异均有统计学意义(P<0.05)。结论IMT、LDL-C、CHIL1是脑卒中发生的独立危险因素,而HDL-C是脑卒中发生的保护因素。洛伐他汀可通过抑制IMT形成,降低血脂及CHIL1、CRP水平,预防脑卒中复发。
脑卒中;几丁酶样蛋白1;膜联蛋白A1;颈动脉粥样硬化斑块;洛伐他汀
颈动脉粥样硬化斑块形成、破溃、出血等病理过程可激活机体凝血系统,促使血栓形成,引起脑血管栓塞是导致脑血管疾病发生的重要机制之一[1]。目前大量研究指出,炎症在动脉粥样斑块形成、发展、破溃及斑块出血过程中起到重要的作用[2-3]。血清C反应蛋白(C-reactive protein,CRP)是机体炎症反应重要标记物,同时也是脑卒中发生的危险因素[4]。几丁酶样蛋白1(chitinase-like protein,CHIL1)主要由血管平滑肌细胞、上皮细胞、脂肪细胞、软骨细胞、巨噬细胞等分泌的细胞,在机体急、慢性炎症反应中起到重要的作用,同时可影响斑块稳定性,导致斑块破溃、出血[5]。膜联蛋白A1(AnnexinA1)是机体重要炎症调控细胞,在抑制炎症代谢产物生成、内皮细胞与中性粒细胞黏附过程中起到重要的作用[6]。洛伐他汀能有效抑制机体炎症反应、抑制血小板聚集、抑制粥样硬化区血栓形成,抑制平滑肌增生,能有效稳定及缩小颈动脉硬化斑块[7]。本研究将分析脑卒中患者血清CHIL1、AnnexinA1、CRP与颈动脉粥样硬化斑块的关系及应用洛伐他汀干预的效果,旨在为脑出血患者临床预防及治疗提供指导。
1 资料与方法
1.1 一般资料 选取2014年6月至2015年6月本院综合内科收治的168例首发脑卒中患者。纳入标准:①患者均符合全国第4次脑血管疾病会议中对脑卒中的诊断标准;②均经头部MRI或CT确诊;③均签署知情同意书。排除标准:①肝肾功能不全、恶性肿瘤、急性颅脑损伤、急性感染、血液系统性疾病、有出血史、消化道溃疡史患者;②入组前已经进行过抗凝、抗血栓治疗者。168例患者中男性82例,女性86例;年龄45~75岁,平均(56.3±3.2)岁;患者发病至送院时间为0.5~12 h,平均(5.5±0.7)h;合并高血压82例,合并高血脂42例,合并糖尿病32例。另选取160例身体健康体检者为对照组,患者经影像学检查、实验室检查排除相关病变,其中男性84例,女性76例;年龄48~80岁,平均(57.2±3.8)岁。两组受检者的性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 颈动脉内-中膜厚度测定 分别于脑卒中患者入院当天及对照组体检当天采用美国飞利浦D5型高频彩色多普勒超声诊断仪,检查时受试者取头后仰卧位,头部偏向对侧45°,探头频率为10~15 MHz,扫描范围为双侧颈总动脉分叉处,测定双侧颈总动脉IMT。IMT为颈总动脉中膜与后壁内膜上缘厚度之和。
1.2.2 血液样本制备 分别于脑卒中患者入院第2天及对照组体检当天各抽取静脉血6 mL,以3 000 r/min速度,离心半径为5 cm离心处理样本,并留取上清液。各自将上清液分装于两支试管中,分别为A、B试管,其中A试管用于测定血脂水平,B试管用于测定血清CHIL1、AnnexinA1、CRP水平。
1.2.3 血脂水平测定 应用HITACHI7080全自动生化分析仪测定两组血清TG、TC、LDL-C、HDL-C水平。
1.2.4 血清CHIL1、AnnexinA1、CRP水平 应用酶联法测定两组血清CHIL1、AnnexinA1水平,CHIL1试剂盒购于北京方程生物科技有限公司,AnnexinA1试剂盒购于上海武昊经贸有限公司,CRP试剂盒购于上海博研生物科技有限公司,操作过程严格按照试剂盒说明书进行操作。
1.2.5 洛伐他汀干预 对脑卒中患者行神经内科常规治疗,如抗凝、抗血小板、积极控制血压、活血化瘀,同时给予患者低脂饮食,加强患者体育运动,减轻患者体重,在此基础上给予患者洛伐他汀(厂家:黑龙江肇东华富药业有限责任公司;生产批号:201405823)干预,20 mg/次,1次/d,共治疗6个月,期间对患者进行随访,所有患者均获得随访。分别于治疗3个月、治疗6个月测定各组IMT、血清TG、TC、LDL-C、HDL-C、CHI3L1、AnnexinA1及CRP水平。
1.3 统计学方法 应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用重复测量方差分析,应用Pearson相关性分析脑卒中患者IMT与血脂水平及血清CHI3L1、AnnexinA1水平的关系,应用多因素Logistic回归分析脑卒中发生危险因素,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组受检者的IMT、血脂、CHIL1、AnnexinA1及CRP水平比较 脑卒中组患者的IMT、血清TG、TC、LDL-C、CHIL1及CRP水平均高于对照组,而HDL-C、AnnexinA1水平低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组受检者的IMT、血脂、CHIL1、AnnexinA1及CRP水平比较(±s)
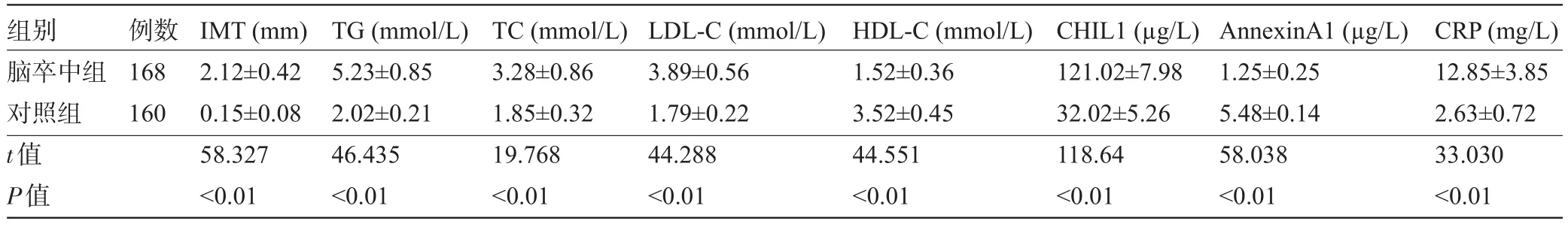
表1 两组受检者的IMT、血脂、CHIL1、AnnexinA1及CRP水平比较(±s)
组别脑卒中组对照组t值P值例数168 160 IMT(mm) 2.12±0.42 0.15±0.08 58.327<0.01 TG(mmol/L) 5.23±0.85 2.02±0.21 46.435<0.01 TC(mmol/L) 3.28±0.86 1.85±0.32 19.768<0.01 LDL-C(mmol/L) 3.89±0.56 1.79±0.22 44.288<0.01 HDL-C(mmol/L) 1.52±0.36 3.52±0.45 44.551<0.01 CHIL1(µg/L) 121.02±7.98 32.02±5.26 118.64<0.01 AnnexinA1(µg/L) 1.25±0.25 5.48±0.14 58.038<0.01 CRP(mg/L) 12.85±3.85 2.63±0.72 33.030<0.01
2.2 脑卒中患者IMT与血脂、CHIL1、AnnexinA1及CRP的关系 经Pearson相关性分析显示,IMT与TG、TC、LDL-C、CHIL1、CRP呈正相关(P<0.05),而与AnnexinA1、HDL-C呈负相关(P<0.05),见表2。

表2 脑卒中患者IMT与血脂、CHIL1、AnnexinA1及CRP的关系
2.3 影响脑卒中发生的多因素Logistic回归分析 以脑卒中发生为因变量,以影响脑卒中发生的相关因素为自变量行多因素Logistic回归分析,结果显示,IMT、LDL-C、CHIL1是脑卒中发生的独立危险因素(P<0.05),而AnnexinA1、HDL-C是脑卒中发生的保护因素(P<0.05),见表3。
2.4 脑卒中患者经洛伐他汀干预前后相关指标的变化 经洛伐他汀干预3个月、6个月后,脑卒中患者IMT、血清TG、TC、LDL-C、CHIL1、CRP水平较治疗前明显下降,血清HDL-C、AnnexinA1水平较治疗前明显升高,差异均有统计学意义(P<0.05),见表4。
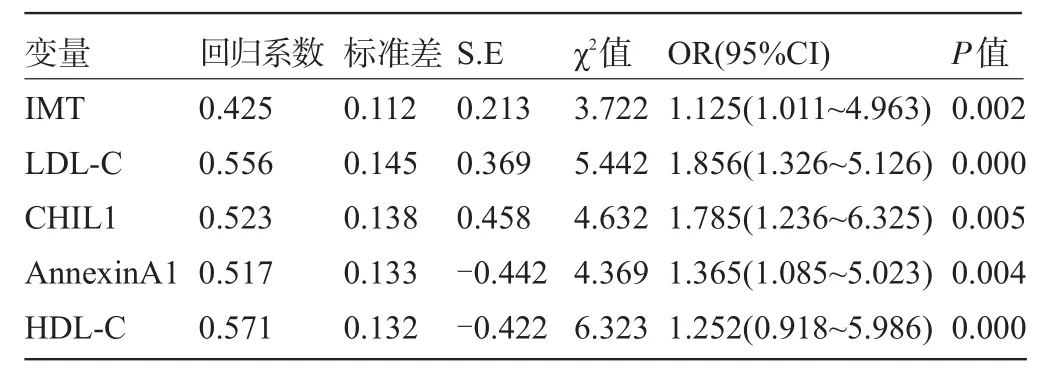
表3 影响脑卒中发生的Logistic多因素分析
表4 脑卒中患者经洛伐他汀干预前后相关指标的变化(±s)
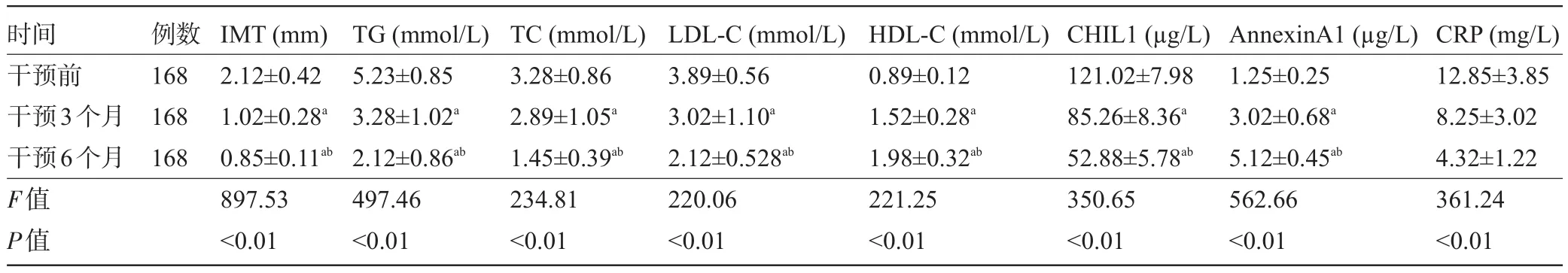
表4 脑卒中患者经洛伐他汀干预前后相关指标的变化(±s)
注:与干预3个月比较,aP<0.05;与干预6个月比较,bP<0.05。
时间干预前干预3个月干预6个月F值P值例数168 168 168 IMT(mm) 2.12±0.42 1.02±0.28a0.85±0.11ab897.53<0.01 TG(mmol/L) 5.23±0.85 3.28±1.02a2.12±0.86ab497.46<0.01 TC(mmol/L) 3.28±0.86 2.89±1.05a1.45±0.39ab234.81<0.01 LDL-C(mmol/L) 3.89±0.56 3.02±1.10a2.12±0.528ab220.06<0.01 HDL-C(mmol/L) 0.89±0.12 1.52±0.28a1.98±0.32ab221.25<0.01 CHIL1(µg/L) 121.02±7.98 85.26±8.36a52.88±5.78ab350.65<0.01 AnnexinA1(µg/L) 1.25±0.25 3.02±0.68a5.12±0.45ab562.66<0.01 CRP(mg/L) 12.85±3.85 8.25±3.02 4.32±1.22 361.24<0.01
3 讨 论
近年普遍认为慢性炎症反应与颈动脉斑块的形成有密切的关系[8],颈动脉粥样硬化斑块形成及发展过程均有炎症因素参与,且存在炎症级联免疫反应。炎症因素尤其是内皮细胞与单核细胞粘附、迁移是颈动脉斑块硬化形成及进展的关键因素。
AnnexinA1属于脂蛋白相关磷脂酶A2(LP-PLA2)家族中的一员,可抑制LP-PLA2生成,从而起到抗炎作用。此外,AnnexinA1抗炎作用还体现在它可抑制单核细胞及中性粒细胞迁移及聚集,并可激活甲酰基肽受体(FPR)、L-选择素(L-Selectin)[9]。近年,Makani等[10]研究指出,AnnexinA1可激活中性粒细胞FPR而抑制对内皮细胞的损伤作用。Hughes等[11]认为,AnnexinA1可与血管细胞粘附分子-1竞争性结合整合素,抑制血管内皮细胞与单核细胞粘附,从而参与早期炎症反应调节。此外,AnnexinA1也可抑制相关参与炎症反应的酶表达,如环氧化酶-2、一氧化氮合酶等,从而发挥抗炎作用。本研究结果显示,脑卒中患者血清AnnexinA1水平显著低于正常对照组,且与IMT呈负相关,经Logistic多因素分析可知,AnnexinA1是脑卒中发生的保护因素,表明AnnexinA1水平下降与机体炎症反应发生有密切的关系。CHIL1是新近发现的炎症因子,可在血管平滑肌细胞、脂肪细胞、上皮细胞、巨噬细胞等多种细胞中表达,且与冠状动脉狭窄病变程度有密切的关系。Hinsinger等[12]应用免疫组织化学法测定脑卒中患者颈动脉硬化斑块中CHIL1表达水平,结果表明,与正常人群相比,脑卒中患者斑块中CHIL1阳性表达强度显著高于正常人群,且可导致斑块不稳定,并促进斑块破裂出血。CRP是心脑血管疾病发生的独立危险因素,可促使单核细胞聚集、促进单核细胞组织因子释放,并激活补体系统,介导内皮细胞损伤,可促进巨噬细胞进入血管内皮,促进血管炎症反应及血栓形成,并介导粘附分子释放[13]。本研究中脑卒中患者血清CHIL1、CRP水平显著高于正常对照组,且与颈动脉斑块形成有密切的关系,是脑卒中发生的独立危险因素,表明血清CHIL1、CRP异常表达可增加脑卒中发生的风险。
多项研究指出,他汀类药物在降低血脂及心血管事件中有良好的预防作用[14-15]。本研究结果显示,对脑卒中患者洛伐他汀干预6个月能明显降低患者TG、TC、LDL-C水平,抑制IMT形成。相关资料显示,IMT形成与LDL-C有关,且与HDL-C呈负相关[16],表明血脂水平在IMT形成及发展过程起到重要的作用。其可能机制为氧化低密度脂蛋白是动脉粥样硬化的危险因子,可促进血管平滑肌增殖及分化,而洛伐他汀可促进低密度脂蛋白降解,阻止LDL-C氧化分解,抑制血管平滑肌增殖及分化,因此能有效改善脑卒中患者颈动脉粥样斑块硬化。此外,本研究结果显示,洛伐他汀能有效抑制CHIL1、CRP生成,促进AnnexinA1产生及分泌,从而起到抗炎作用。
综上所述,IMT、LDL-C、CHIL1是脑卒中发生的独立危险因素,而AnnexinA1 HDL-C是脑卒中发生的保护因素。洛伐他汀可通过抑制IMT形成,降低血脂及CHIL1、CRP水平,预防脑卒中复发。
[1]申丽红,梁小乐,高旭光,等.急性脑梗死患者微栓子与颈动脉粥样硬化斑块的相关性研究[J].中华老年心脑血管病杂志,2014,16 (3):237-239.
[2]王燕嬉.急性脑梗死患者血清内脂素、高敏C反应蛋白及血栓前体蛋白与颈动脉粥样硬化斑块的相关性[J].中国老年学杂志,2016, 36(12):2908-2909.
[3]李凤,朱余友,杨孙凤,等.血清五聚素3、超敏C反应蛋白、脂蛋白相关磷脂酶A2水平以及微栓子信号与大动脉粥样硬化型急性脑梗死患者颈动脉粥样硬化斑块稳定性的相关研究[J].临床神经病学杂志,2016,29(2):95-100.
[4]朱卫香,刘彦敏,韩亚军,等.缺血性脑卒中患者血清基质金属蛋白酶-9、超敏C反应蛋白水平与颈动脉粥样硬化的相关性[J].疑难病杂志,2014,2(11):1111-1113.
[5]李祥波,吴成稳,王耀磊,等.人颈动脉粥样硬化斑块中几丁质酶样3蛋白1及基质金属蛋白酶-9的表达[J].中华实验外科杂志,2015, 32(12):3016-3019.
[6]王春梅,王成钢,聂绍平,等.血清膜联蛋白A1与冠状动脉狭窄程度的相关性研究[J].中国全科医学,2015,18(36):4408-4411.
[7]孙丽静,白丽华,赵惠,等.不同剂量洛伐他汀治疗冠心病伴高脂血症的临床观察[J].临床合理用药杂志,2014,7(4):31-32.
[8]Liu JH,Feng D,Zhang YF,et al.Chloral hydrate preconditioning protects against ischemic stroke via upregulating annexin A1[J].CNS Neurosci Ther,2015,21(9):718-726.
[9]Zhao B,Wang J,Liu L,et al.Annexin A1 translocates to nucleus and promotes the expression of pro-inflammatory cytokines in a PKC-dependent manner after OGD/R[J].Sci Rep,201,18(6):27028-27030.
[10]Makani V,Sultana R,Sie KS,et al.Annexin A1 complex mediates oxytocin vesicle transport[J].J Neuroendocrinol,2013,25(12): 1241-1254.
[11]Hughes EL,Cover PO,Buckingham JC,et al.Role and interactions of annexin A1 and oestrogens in the manifestation of sexual dimorphisms in cerebral and systemic inflammation[J].Br J Pharmacol, 2013,169(3):539-553.
[12]Hinsinger G,Galéotti N,Nabholz N,et al.Chitinase 3-like proteins as diagnostic and prognostic biomarkers of multiple sclerosis[J]. Mult Scler,2015,21(10):1251-1261.
[13]黄晓芸,徐安定,梅志忠,等.炎症因子与急性动脉粥样硬化性脑梗死及其预后的关系[J].广东医学,2015,2(19):2994-2997.
[14]侯卫静,王庆胜,张晶.他汀类药物对低密度脂蛋白胆固醇正常的动脉粥样硬化人群的干预作用[J].医学综述,2016,22(6): 1141-1144.
[15]赖诚民,陈勇.他汀类药物对老年冠心病患者动脉粥样硬化程度的影响[J].中国老年学杂志,2015,2(16):4507-4509.
[16]徐刚,袁涛,韩增雷,等.冠心病患者颈动脉IMT及斑块总积分与冠脉Gensini积分的关系[J].中国临床研究,2013,26(11):1153-1154.
Relationship between serum CHIL1,annexin A1 and carotid atherosclerotic plaques in patients with stroke and the interventional effect of lovastatin.
LI Yong-jun,DU Ming.Department of Clinical Laboratory,the Fourth Hospital of Qinhuangdao,Qinhuangdao 066300,Hebei,CHINA
Objective To investigate the relationship between serum chitinase like protein 1(CHIL1),annexinA1 and carotid artery atherosclerotic plaques in patients with stroke and the interventional effect of lovastatin.MethodsA total of 168 patients of stroke,who admitted to Department of General Cardiology of our hospital from June 2014 to June 2015,were selected as the stroke group,and 160 healthy volunteers were selected as the control group during the same time.The carotid intima-media thickness(IMT)of the two groups was measured by ultrasound with carotid color Doppler.The levels of triglyceride(TG),total cholesterol(TC),low-density protein(LDL-C),and high density protein (HDL-C)of the two groups were identified with fully automated biochemistry analyzer.The levels of CHIL1,ANXA1 were measured with enzyme-linked immunosorbent assay(ELISA).The levels of C-reactive protein(CRP)of the twogroups were evaluated with the colloidal gold method.The relationships between IMT and the levels of serum lipid, CHIL1,ANXA1 in patients with stroke were analyzed by Pearson single factor.Logistic multivariate analysis was used to analyze the risk factors of stroke.Lovastatin was given to patients with stroke at the dose of 20 mg once a day for 6 months,and the intervention effect was observed.ResultsThe levels of IMT,serum TG,TC,LDL-C,CHI3L1 and CRP of the stroke group were significantly higher than those of the control group(P<0.05),while the levels of annexin A1,HDL-C of the stroke group were significantly lower than those of the control group(P<0.05).Pearson's single factor analysis showed that IMT were positively correlated with TG,TC,LDL-C,CHIL1(P<0.05)and negatively correlated with annexin A1,HDL-C(P<0.05).Logistic multivariate analysis showed that IMT,LDL-C,CHIL1 were the independent risk factors of stroke,while annexin A1,HDL-C was the protective factors of stroke(P<0.05).After three and six months of lovastatin intervention,the levels of IMT,serum TG,TC,LDL-C,CHIL1,and CRP in patients with stroke were significantly lower than before the lovastatin intervention,while the level of annexin A1,HDL-C was significantly higher than before the lovastatin intervention(P<0.05).ConclusionIMT,LDL-C,CHIL1 are the independent risk factors of stroke,while annexin A1,HDL-C are the protective factor of stroke.Lovastatin can prevent the recurrence of stroke by inhibiting the formation of IMT and reducing the levels of serum lipids and CHIL1,and CRP.
Stroke;Chitinase like protein 1(CHIL1);AnnexinA1;Carotid atherosclerotic plaque;Lovastatin
R743.3
A
1003-6350(2017)04-0540-04
10.3969/j.issn.1003-6350.2017.04.007
2016-09-06)
李永军。E-mail:liyongjunqh@163.com
