低温快速成型3D打印磁性纳米复合人工骨的性能测定
2017-03-21黄江鸿熊建义王大平丁文斌尤微刘威王大明陈洁琳段莉朱伟民
黄江鸿,熊建义,王大平,丁文斌,尤微,刘威,王大明,陈洁琳,段莉,朱伟民
(1.深圳市第二人民医院国家重点骨科,广东 深圳 518035;2.深圳市组织工程重点实验室,广东 深圳 518035;3.深圳市数字骨科技术工程实验室,广东 深圳 518035)
低温快速成型3D打印磁性纳米复合人工骨的性能测定
黄江鸿1,2,3,熊建义1,2,3,王大平1,2,3,丁文斌1,2,3,尤微1,2,3,刘威1,2,3,王大明1,2,3,陈洁琳1,2,3,段莉1,2,3,朱伟民1,2,3
(1.深圳市第二人民医院国家重点骨科,广东 深圳 518035;2.深圳市组织工程重点实验室,广东 深圳 518035;3.深圳市数字骨科技术工程实验室,广东 深圳 518035)
目的 利用低温快速成型技术的可控性、三维多孔立体结构的优点,制备骨组织修复材料磁性纳米多孔复合人工骨支架材料(n-HA/PLLA/Fe2O3),并检测其力学和降解性能。方法低温快速成型仪分别制备不同成分比例的n-HA/PLLA/Fe2O3,再通过乙醇浸泡法测定支架孔隙率,采用电子试验机通过检测抗弯,抗压,弹性模量评价支架力学性能,通过电镜观察支架超微结构,浸泡磷酸盐缓冲液(PBS)进行降解试验,观察降解液的pH值变化,材料力学性能的变化。结果n-HA和Fe2O3的比例增加,复合支架材料的拉伸强度减弱,弯曲强度在n-HA和Fe2O3的质量分数为10%时达到峰值(111.9 MPa),弹性模量随着n-HA和Fe2O3质量分数的增加而增大。在n-HA和Fe2O3含量为5%时出现大量的韧窝,孔隙率为83%;在n-HA和Fe2O3含量为10%断裂表面凹凸不平,孔隙率达到90%以上;在n-HA和Fe2O3含量为15%以上时断口又变得越来越平整,孔隙率在80%左右。随着降解时间的延长,支架材料的力学性能也一定程度的衰减。结论复合人工骨支架材料的制备比例中,通过不同组分的筛选和测定,设定最佳的组分配比来制备出性能优良的支架材料。当n-HA和Fe2O3成分为10%时,该磁性纳米多孔复合人工骨支架材料具有更好的生物力学性能以及可降解性能。
低温快速成型;3D打印;磁性纳米;人工骨
目前,人工骨组织工程材料在生物医用材料领域里研究日益兴起。而单一的骨移植相关材料因各自的缺点不能完全满足人工骨组织材料的要求,因此复合材料在骨组织工程中被认为是修复骨缺损的较好方法之一[1]。聚乳酸(PLLA)具有良好的生物学性能,而纳米羟基磷灰石(n-HA)又有骨传导性能的优点,使两者常被研究及作为制备骨组织工程的复合支架材料。乳酸分子通过共聚形成PLLA,在体内最终代谢产物为水、CO2,表现出良好的生物相容性,动物实验体内研究其也具有良好的降解性[2],PLLA目前临床材料应用包括骨折内固定可吸收螺钉、缝合线及药物缓释载体等[3-4],并取得一定的治疗效果。n-HA与人体内骨组织成分相近,生物力学性能、相容性以、骨传导性能良好。但其缺点为降解性能低。超顺磁性纳米粒子Fe2O3在外界恒定磁场的作用可下表现出良好的磁响应性和超顺磁性,即定向聚集和定位。在交变磁场下吸收电磁波产热。磁性纳米铁粒子保留其作为纳米级别材料的生物活性,与细胞表面偶联的能力强,这就使在外加磁场的条件下控制和调节细胞的功能成为可能[5]。
低温快速成型技术主要有熔融沉积法、选择性激光烧结、三维打印等,可形成三维结构可控的材料[6]。低温快速成型通过结合相分离法为基础,计算机程序辅助设定参数来生产支架材料,具有良好的可控性,同时低温环境下也良好保持材料生物学活性,在目前的骨折骨组织工程支架的的研究制备的应用良好[7]。
本实验采用低温快速成型技术制备磁性纳米复合人工骨支架材料,并进行表征,以此制备的新型复合人工骨支架材料不仅能在三维多孔立体结构上具有一定的生物力学性能,同时也能保存各成分材料的生物学活性,作为骨组织工程移植材料,为种植的种子细胞提供良好的生物学支撑,以促进增殖及功能表达,本研究旨在为磁性纳米复合人工骨支架材料作为骨缺损修复材料提供一定的实验支持。
1 材料与方法
1.1 主要实验材料、试剂及仪器 PLLA、n-HA、磁性纳米Fe2O3(广东省深圳市欣城生物科技有限公司),低温快速成型仪(中国科学院深圳先进技术研究院),扫描电子显微镜、三思电子万能试验机(深圳清华大学研究院)。
1.2 复合材料制备 将n-HA、PLLA、Fe2O3材料按一定的质量比例混匀成液态,制备成磁性纳米多孔复合支架材料(n-HA/PLLA/Fe2O3)(25 mm×25 mm×25 mm) (图1)。此次制备的支架材料按n-HA和Fe2O3所含不同的质量比例分为5组,复合材料具体制备的实验步骤如下:

图1 磁性纳米多孔n-HA/PLLA/Fe2O3材料
先将PLLA溶解于溶剂1,4-二氧六环,60℃水浴中,搅拌混匀,得到一定浓度的PLLA/1,4-二氧六环均相溶液;按一定质量比将n-HA、Fe2O3加入上述溶液中,震荡15 min,电磁搅拌12 h,使得n-HA,Fe2O3完全分散均匀。得到的复合材料液-4℃条件下低温快速成型,RIPF工艺成形,形成具有一定间距的材料框架;将配置好的不同浓度的生物复合材料填充上述平行排列的框架中,均匀交叉排列,重复以上步骤。成形后的冰与生物复合材料混合体冷藏风干,后得到的复合人工支架材料具有一定孔隙率。样品真空条件下冷冻,干燥2 d,使机溶剂升华。根据不同质量比的各组样品行力学性能测试检测、电镜观察,并观察其降解性。
1.3 复合材料性能测试表征 力学性能测试:将不同配比的复合材料试样应用三思电子万能试验机CTM4 000进行测定,主要测定其拉伸强度、弯曲强度、弯曲模量,用三点抗弯曲法测定,跨距为20 mm,加载速率5.00 mm/min。显微结构观察:电镜横断面扫描支架材料横截面,得到二次电子图像及背散射电子图像,观察分析试样横断面的微观形态和组织特征。孔隙率测定:乙醇介质法浸泡测定如下,先测得干燥状态下复合材料总体积(V)及质量m1;乙醇浸泡饱和后测得支架总质量m2,计算孔隙率:θ= (m2-m1)/ρ乙醇V。体外降解试验:复合材料试样在真空干燥条件下至恒重(W0),人工降解液(磷酸盐缓冲液,PBS)浸泡,(37±1)℃,第2、4、6、8、10周取出,测定降解液pH,干燥后测定样品重量(Wt),并再次进行力学检测。主要观察指标:复合材料的生物力学性能(拉伸强度、抗弯曲模量及弯曲强度),微观横断面的电镜形态,三维结构层面上的孔径和孔隙率,降解过程中pH值和合力学性有无能衰减情况。
1.4 统计学方法 应用SPSS13.0统计软件进行数据分析,分析方法用Graphpad Prism 5.0 One-way ANOVA进行,计量数据以均数±标准差(±s)表示,多组计量资料比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 复合材料力学性能比较 表1结果表明:①随n-HA和Fe2O3含量的增大,复合材料的拉伸强度呈线性下降;②复合材料的弯曲强度因n-HA和Fe2O3含量的增加而增大,当n-HA与Fe2O3微粒的质量分数为10%时出现弯曲强度峰值(约111.9 MPa),质量分数大于15%时磁性纳米多孔n-HA/PLLA/Fe2O3复合材料的弯曲强度逐渐降低,且低于聚合物各成分的弯曲强度;③弯曲模量随着n-HA和Fe2O3微粒质量分数的升高而增大。
表1 磁性纳米多孔n-HA/PLLA/Fe2O3复合材料力学性能比较(±s,n=10)
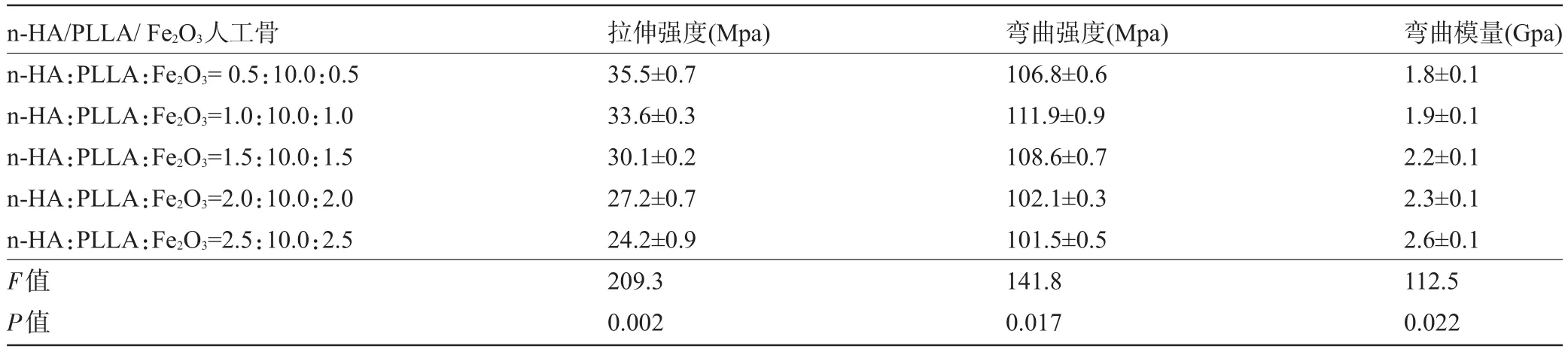
表1 磁性纳米多孔n-HA/PLLA/Fe2O3复合材料力学性能比较(±s,n=10)
n-HA/PLLA/Fe2O3人工骨n-HA:PLLA:Fe2O3=0.5:10.0:0.5 n-HA:PLLA:Fe2O3=1.0:10.0:1.0 n-HA:PLLA:Fe2O3=1.5:10.0:1.5 n-HA:PLLA:Fe2O3=2.0:10.0:2.0 n-HA:PLLA:Fe2O3=2.5:10.0:2.5 F值P值拉伸强度(Mpa) 35.5±0.7 33.6±0.3 30.1±0.2 27.2±0.7 24.2±0.9 209.3 0.002弯曲强度(Mpa) 106.8±0.6 111.9±0.9 108.6±0.7 102.1±0.3 101.5±0.5 141.8 0.017弯曲模量(Gpa) 1.8±0.1 1.9±0.1 2.2±0.1 2.3±0.1 2.6±0.1 112.5 0.022
2.2 复合材料横断面的电镜观察 当在PLLA材料中填充5%的n-HA粒子和5%的Fe2O3粒子时,复合材料的横断面出现大量的凹陷,并可见明显的粗糙断裂面(图2A)和因张力过大而出现的角度大孔洞,孔隙率达83%,孔径3~5 μm。当n-HA和Fe2O3含量分别为10%时,n-HA粒子填充紧密,横断面表现为凹凸不平,并有较多的凹陷形成,无机相张力较高,出现表面崩裂、撑开,表面可形成陷窝(图2B)和被破坏的n-HA粒子,孔隙率达到90%以上,孔径3~5 μm。当n-HA粒子和Fe2O3粒子含量超过15%后复合材料的横断面逐渐平整,大量聚集的n-HA和Fe2O3粒子被强行脱离而形成较为光滑的小凹陷(图2C),横断表面较多小凹陷。当n-HA和Fe2O3粒子含量超过20%以上(图2D、2E),复合材料的横断面更加平滑,韧窝很少,表现为脆性断裂的特征,孔隙率在80%左右,孔径2~3 μm。
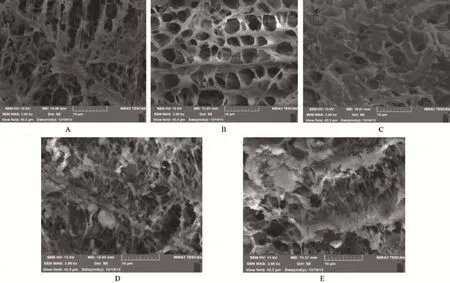
图2 磁性纳米多孔n-HA/PLLA/Fe2O3的扫描电镜结果(5 000×):多孔网状结构,内壁粗糙、间微孔相通
2.3 复合材料的孔径及孔隙率 磁性纳米多孔n-HA/PLLA/Fe2O3复合材料中,当n-HA和Fe2O3的含量为10%时具有最大的孔径376 μm及最佳的孔隙率91%,见表2。
2.4 复合支架材料降解过程中的pH值变化 在前8周的时间内,降解液的pH值是逐渐降低的。当复合支架材料中的n-HA的质量分数增加时,pH值的下降速度逐渐减缓(图3)。第8至10周内,降解液的pH值有所增大。
2.5 复合材料降解过程中生物力学性能变化 降解时间延长,复合材料的拉伸强度、弯曲强度、弯曲模量逐渐所衰减。因降解时间的延长,降解介质向材料的内部渗透,材料的界面受到了破坏,导致材料力学性能逐渐减弱,见图4~图6。
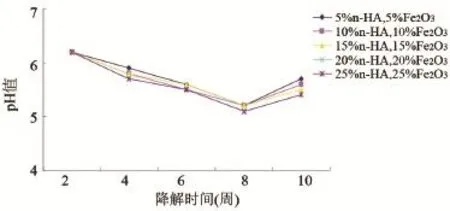
图3 降解液pH值随降解时间的变化

图4 支架材料拉伸强度与降解时间的关系
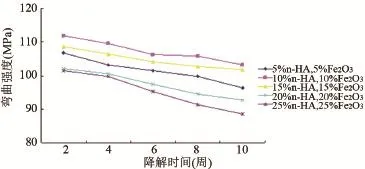
图5 支架材料弯曲强度与降解时间的关系
表2 磁性纳米多孔n-HA/PLLA/Fe2O3复合材料孔径及孔隙率大小比较(±s,n=10)
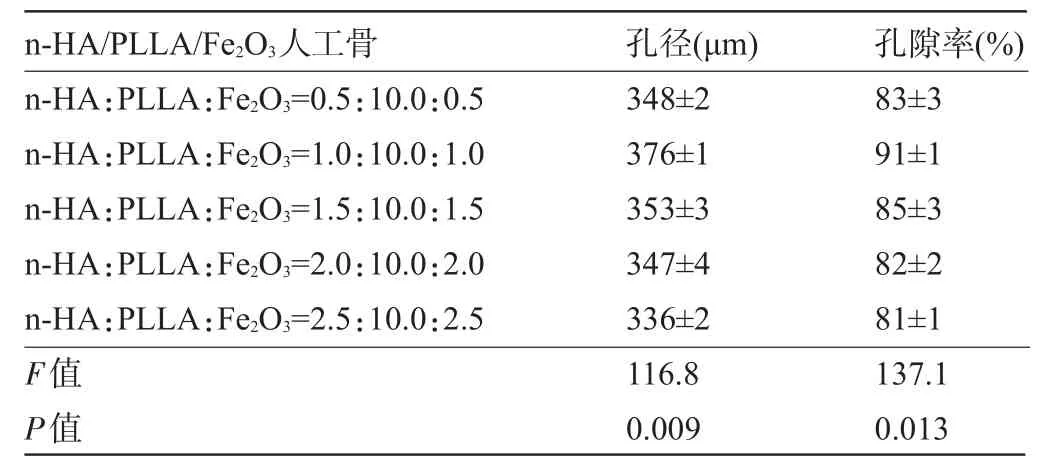
表2 磁性纳米多孔n-HA/PLLA/Fe2O3复合材料孔径及孔隙率大小比较(±s,n=10)
n-HA/PLLA/Fe2O3人工骨 孔径(μm)孔隙率(%) n-HA:PLLA:Fe2O3=0.5:10.0:0.5 n-HA:PLLA:Fe2O3=1.0:10.0:1.0 n-HA:PLLA:Fe2O3=1.5:10.0:1.5 n-HA:PLLA:Fe2O3=2.0:10.0:2.0 n-HA:PLLA:Fe2O3=2.5:10.0:2.5 F值P值348±2 376±1 353±3 347±4 336±2 116.8 0.009 83±3 91±1 85±3 82±2 81±1 137.1 0.013
3 讨 论
3.1 利用低温快速成型技术制备磁性纳米多孔复合人工骨支架材料 创伤、肿瘤等原因形成的骨缺损,缺损部位常常是不规则的,常规的植骨往往填充效果差,骨折愈合率偏低,难以满足手术要求。传统方法是通过静电纺丝法、固液相分离法、溶盐法等进行材料的加工、分离、成形等步骤,并通过特定的模具进行加工裁剪而形成,形成三维立体结构形状受限较多,与要求的样品往往在结构及精度上有一定差距,操作步骤复杂,因此一定程度上限制手术应用[8]。本实验采用的低温快速成型技术是一种新型快速成型技术,目前应用已经较多,不仅在材料上进行更新,同时结合了计算机辅助技、数控技术及相分离技术等,通过计算机编程软件,将原材料进行快速的三维成型,符合制备的要求。余东等[9]利用此种方法精确制备出山羊标准颅骨,具有相同弯曲弧度。低温快速成型技术包括以下几个方面:影像学扫描(高精度CT、MRI)骨缺损部位,获取的计算机三维立体模型,或者事先设计好所需要的模型,计算机进行二维层面数据分解,以此得到喷头扫描路径;在低温成型操作平台上先打印出底层二维结构,通过三维喷头进行逐层打印,形成具有特殊结构的三维形状[10]。成型过程是可控的,主要包括成型支架的外形、支架厚度、三维孔隙等方面。通过控制喷头的支架来调控喷射出材料细丝的直径和长度,以此调控三维支架的外形;通过调节二维平面喷头X、Y的扫描次数(N值)及纵相喷头(Z值)调控成型支架高度,同时可调节喷头打印的间距来调节所需的孔隙率。除此之外,低温快速成型技术在材料处理过程中,是在低温环境下进行,不同于传统的熔融沉积制造、选择性激光烧结[11],在成型过程不影响材料的化学成分,保持原有材料的生物化学。
为了保证实验准确性和适用性,其所需要的磁性纳复合人工骨支架模型提前通过计算机设计好,而通过利用低温快速成型技术的方法聚成的骨制备三维立方体状支架材料,实验结果显示精度较高,继而制备得到多孔的磁性纳米复合人工骨支架材料(n-HA/ PLLA/Fe2O3)。为了克服聚乳酸在高温的环境下容易费解的缺点,在实验中采用了异于传统方法的低温快速成型技术,以保证其良好的生物学活性。由于实验组制备得到的为复合人工骨支架其材料特性均一,且未加入骨诱导生长因子,所以在低温快速成型技术条件下加入热敏感生长因子(如骨形态形成蛋白)成为可能,即可认为可以可形成具有促进骨组织生长能力的组织工程骨支架。
3.2 磁性纳米多孔复合人工骨支架材料的孔径、孔隙率和力学性能 有假设认为理想生物骨支架材料的孔径对影响种子细胞的粘附和迁移具有影响,大部分学者认为其孔径范围在200~500 μm为宜,不仅可促进种子细胞黏附而且可促进骨组织形成[12-14];孔隙率越高、孔径越小细胞时,生物相容性越好,并且利于种子细胞的粘附[15]。相比其他传统工艺制备技术(支架孔径200 μm以下),本实验采用的低温快速成型技术,制备过程中调节喷头设定参数,将孔径控制在百微米范围内[16]。针对本实验中不同比例的n-HA/ PLLA/Fe2O3复合材料,可以满足不同范围内的孔隙率要求,所制备的多孔材料的孔隙率均在80%以上。当n-HA和Fe2O3的含量为10%时复合材料具有最大的孔径376 μm及最佳的孔隙率91%。
理想三维支架材料的生物力学性能应该能与人体骨的力学相符,保证骨修复早期的力学支撑[17]。孔隙率增加及孔径越小对种子细胞的粘附和增殖有促进作用,即高孔隙率,但同时也降低了其作为骨组织支架材料的力学性能;因此高孔隙率的材料往往导致人工骨支架的力学性能降低。实验利用低温快速成型技术制备的n-HA/PLLA/Fe2O3磁性纳米多孔复合材料力学强度在110 Mpa左右,较人体松质骨低;通过微观显微电镜观察到复合材料的孔隙间部分有裂痕,也一定程度上降低了其力学性能。实验过程中需要设定合适的喷头移动速度和材料喷出速度度,才能保证原材料的形成均匀,避免孔隙的过度填充闭塞或者填充失败[18],在这一过程中材料成型参数尤为重要,也就是本实验的目的及意义之一。实验通过实验对照原则,来求得n-HA/PLLA/Fe2O3各个原材料成型的最佳参数。由于材料比例将影响成型参数,因此,需进一步进行实验研究,寻找更为适合的各种原材料进行参数设定,提高精细度。
3.3 磁性纳米多孔复合人工骨支架材料的降解性能 医用植入材料需要同时具备可降解性和可吸收性,对体内无明显异物反应,不影响组织的正常生理代谢,同时能够保留各组分材料的生物活性和复合产品的新性能[19]。生物可降解性指材料在生物体内,受到内外环境的影响进行物理和化学反应,内部的共价键或者分子键进行锻炼,发生的裂解等反应,形成较多的小分子片段进行降解的过程,降解物通过新陈代谢作用排出体外。
本实验制备复合支架材料过程中,通过羟基磷灰石粒子的掺入,成功的提高了聚乳酸降解过程中的PH值,为以后复合支架材料在体内实验过程中减小无菌性炎症发生率,提高支架材料的生物相容性;同时,通过体外的一个磁疗仪的作用,磁性粒子Fe2O3在体内的释放也会将促进骨缺损的修复。复合支架材料的降解初期的降解率较低,因此n-HA/PLLA/Fe2O3复合多孔支架材料可以维持在较满意的力学强度,为种子细胞的增殖和分化提供良好的力学的支撑。降解后期,n-HA/PLLA/Fe2O3纳米多孔复合材料降解逐渐加速,有利于新生骨组织的长入,适应骨组织形态修复过程。因此,通过低温快速成型技术制备的磁性纳米多孔n-HA/PLLA/Fe2O3复合材料具有广泛的应用和研究价值。
以低温快速成型技术支架材料(n-HA/PLLA/ Fe2O3),支架材料的孔径及孔隙率达到预期值,对支架材料进行检测,其力学性能和降解性能要求,具有良好的骨缺损修复潜能,本实验研究认为,在各组比例中,n-HA与Fe2O3的比例为10%时n-HA/PLLA/Fe2O3多孔复合材料具有最佳的生物支架材料性能。成型参数的选择也是磁性纳米多孔复合支架材料的关键因素之一,因此需要进一步研究成型参数与各个比例的复合材料性能的关系,找到一种最佳的成型参数,同时需要通过动物实验评价磁性纳米多孔复合支架材料的骨缺损修复效果。
[1]Wang T,Chow LC,Frukhtbeyn SA,et al.Improve the strength of PLA/HA composite through the use of surface initiated polymerization and phosphonic acid coupling agent[J].J Res Natl Inst Stand Technol,2011,116(5):785-796.
[2]Shive MS,Anderson JM.Biodegradation and biocompatibility of PLA and PLGA microspheres[J].Adv Drug Deliv Rev,1997,28(1): 5-24.
[3]Park JS,Kang SK.A study on surface,Thermal and mechanical properties of absorbable PLGA plate[J].Int J Control Autom,2013,6(6): 73-82.
[4]Makadia HK,Siegel SJ.Poly Lactic-co-Glycolic acid(PLGA)as biodegradable controlled drug delivery carrier[J].Polymers(Basel)Polymers,2011,3(3):1377-1397.
[5]Wu Y,Jiang W,Wen X,et al.A novel calcium phosphate ceramic-magnetic nanoparticle composite as a potential bone substitute[J]. Biomed Mater,2010,5(1):15001.
[6]张建明,张西正,李瑞欣,等.快速成型方法制备组织工程支架的研究和应用[J].中国组织工程研究,2013,17(8):1435-1440.
[7]Liu YY,Fang SH,Han ZZ,et al.Study on low-temperature deposition manufacturing process parameters of three-dimensional Chitosan scaffold[J].Key Eng Mater,2012,522:97-102.
[8]Jang JH,Castano O,Kim HW.Electrospun materials as potential platforms for bone tissue engineering[J].Adv Drug Deliv Rev,2009,61 (12):1065-1083.
[9]余东,雷华,唐晓军,等.低温快速成形人工骨的敷贴植骨实验研究[J].中国美容医学,2008,17(1):75-79.
[10]Xu M,Li Y,Suo H,et al.Fabricating a pearl/PLGA composite scaffold by the low-temperature deposition manufacturing technique for bone tissue engineering[J].Biofabrication,2010,2(2):025002.
[11]Liu L,Xiong Z,Yan Y,et al.Porous morphology,porosity,mechanical properties of poly(alpha-hydroxy acid)-tricalcium phosphatecomposite scaffolds fabricated by low-temperature deposition[J].J Biomed Mater ResA,2007,82(3):618-629.
[12]Mehdizadeh H,Sumo S,Bayrak ES,et al.Three-dimensional modeling of angiogenesis in porous biomaterial scaffolds[J].Biomaterials, 2013,34(12):2875-2887.
[13]Kuboki Y,Jin Q,Kikuchi M,et al.Geometry of artificial ECM:sizes of pores controlling phenotype expression in BMP-induced osteogenesis and chondrogenesis[J].Connect Tissue Res,2002,43(2-3): 529-534.
[14]Karageorgiou V,Kaplan D.Porosity of 3D biomaterial scaffolds and osteogenesis[J].Biomaterials,2005,26(27):5474-5491.
[15]Carletti E,Motta A,Migliaresi C.Scaffolds for tissue engineering and 3D cell culture[J].Methods Mol Biol,2011,695:17-39.
[16]Kai H,Wang X,Madhukar KS,et al.Fabrication of a two-level tumor bone repair biomaterial based on a rapid prototyping technique [J].Biofabrication,2009,1(2):025003.
[17]Panetta NJ,Gupta DM,Longaker MT.Bone regeneration and repair [J].Curr Stem cell Ther,2010,5(2):122-128.
[18]Liu YY,Fang SH,Han ZZ,et al.Pneumatic feeding system for lowtemperature deposition manufacturing based on systemidentification [J].Virt Phys Protot,2013,8(1):3-9.
[19]Wright-Charlesworth DD,King JA,Miller DM,et al.In vitro flexural properties of hydroxyapatite and self-reinforced poly(L-lactic acid) [J].J Biomed Mater ResA,2006,78(3):541-549.
Performance of magnetic nanocomposite artificial bone scaffolds prepared by low-temperature rapid prototyping 3D printing.
HUANG Jiang-hong1,2,3,XIONG Jian-yi1,2,3,WANG Da-ping1,2,3,DING Wen-bin1,2,3,YOU Wei1,2,3,LIU Wei1,2,3, WANG Da-ming1,2,3,CHEN Jie-lin1,2,3,DUAN Li1,2,3,ZHU Wei-min1,2,3.1.National Key Orthopedic Department,Shenzhen Second People's Hospital,Shenzhen 518035,Guangdong,CHINA;2.Shenzhen Tissue Engineering Key Laboratory,Shenzhen 518035,Guangdong,CHINA;3.Shenzhen Digital Orthopaedic Engineering Laboratory,Shenzhen 518035,Guangdong, CHINA
ObjectiveTo prepare porous magnetic nanocomposite artificial bone scaffolds(n-HA/PLLA/ Fe2O3)using a low-temperature rapid prototyper,and to characterize the properties of the scaffold.MethodsA low-temperature rapid prototyper was applied to fabricate the porous magnetic nanocomposite scaffolds with different mass ratios of n-HA/PLLA/Fe2O3.The medium(ethanol)immersion assay was used to examine the scaffold porosity.Mechanical tests,including bending,compression and elastic modulus,were performed to investigate the scaffold mechanical properties.A scanning electron microscope was used to observe the scaffold microstructures.Phosphate buffer solution (PBS)soaking was performed to study the scaffold degradation behavior by monitoring the changes of pH value and the scaffold mechanical properties.ResultsWith the increase of the n-HA and Fe2O3content,the tensile strength of scaffold gradually decreased,while the elastic modulus increased.The bending strength reached the maximum(111.9 MPa) when the mass fraction of n-HA and Fe2O3was 10%,at which time the scaffold with a porosity of 90%showed a rough fracture surface.The scaffold had a porosity of 83%when the mass fraction of n-HA and Fe2O3was 5%,with a large number of dimples being observed.If the mass fraction increased to 15%,a porosity of 80%was obtained and the facture surface became relatively smooth.In the degradation study,the pH value of the medium decreased with time and the scaffold mechanical properties had certain attenuation.ConclusionThe scaffold of 10%n-HA and Fe2O3obtained better mechanical properties and degradation behavior,which would facilitate the selection of the porous magnetic nanocomposite artificial bone scaffold with best performance.
Low temperature rapid prototyping;3D printing;Magnetic nanocomposite;Artificial bone scaffold
R68
A
1003-6350(2017)04-0525-06
10.3969/j.issn.1003-6350.2017.04.003
2016-09-19)
广东省深圳市科技研发资金项目(编号:CXZZ20140813160132596)
王大平。E⁃mail:dapingwang1963@qq.com
