银杏内酯B抑制高糖诱导内皮细胞凋亡及机制研究
2017-03-17陈北冬赵艳阳齐若梅
陈 坤,张 明,陈北冬,赵艳阳,吴 伟,齐若梅
(北京医院/北京老年医学研究所,国家老年医学中心,卫生部老年医学重点实验室,北京 100730)
银杏内酯B抑制高糖诱导内皮细胞凋亡及机制研究
陈 坤,张 明,陈北冬,赵艳阳,吴 伟,齐若梅
(北京医院/北京老年医学研究所,国家老年医学中心,卫生部老年医学重点实验室,北京 100730)
目的 探讨银杏内酯B对高糖诱导的内皮细胞凋亡的影响及相关的分子机制。方法 使用脐静脉血管内皮细胞作为细胞模型,分为对照组、高糖组、银杏内酯B处理组。用Transwell实验检测内皮细胞迁移,Annexin Ⅴ试剂盒检测细胞凋亡,荧光试剂盒检测活性氧(reactive oxygen species,ROS)水平,Western blot 检测Bax, Bcl-2, caspase-3的表达以及p53的磷酸化。结果 高糖(30 mmol·L-1)处理组内皮细胞迁移数量明显降低,迁移率为(66.6±15.6)%,而银杏内酯B(0.6 g·L-1)处理增加了内皮细胞的迁移数量,迁移率为(94.8±11.4)%。高糖处理导致内皮细胞ROS水平增高2.75倍,与高糖处理组比较,0.6 g·L-1银杏内酯B完全抑制了高糖诱导的ROS产生。流式细胞仪分析表明,高糖刺激内皮细胞凋亡率为(53.8±2.6)%,银杏内酯B处理组内皮细胞凋亡率为(44.0±3.1)%。对凋亡相关蛋白的分析表明,高糖组Bax、caspase-3表达增加,Bcl-2表达降低,银杏内酯B处理抑制了Bax、caspase-3表达,并增加了Bcl-2表达。此外,高糖处理增加了内皮细胞p53表达及磷酸化,而银杏内酯B抑制高糖刺激的p53活化。结论 银杏内酯B能抑制高糖诱导的内皮细胞凋亡,改善内皮细胞迁移功能,对高糖引起的内皮细胞损伤具有保护作用。
银杏内酯B;高糖;人脐静脉内皮细胞;ROS;细胞凋亡;p53
糖尿病在我国发病率逐年增高,其心血管并发症是造成患者致死致残的主要原因。高糖(high glucose, HG)能够损伤内皮细胞, 导致多种炎症蛋白表达增加及血管炎症反应[1-2],但其机制尚不完全清楚。
细胞凋亡是由基因控制的细胞程序性死亡,是细胞为适应微环境变化而激活的死亡过程。参与细胞凋亡这一过程的蛋白主要有Caspase家族、Bax、Bcl-2以及p53。其中Bax可以促进细胞凋亡,而Bcl-2则抑制细胞凋亡,它们都可以通过Caspase发挥调控细胞凋亡的作用[3]。研究表明,高糖诱导细胞凋亡与线粒体功能失调,DNA损伤以及ROS产生过多相关[4]。对糖尿病小鼠的研究表明,细胞内能量与应激感受器AMPK具有抑制ROS介导的细胞凋亡的作用[5]。尽管研究已经证实高糖能够诱导细胞凋亡,但分子机制尚未完全阐明。
银杏内酯B(ginkgolide B,GB)是银杏叶提取物,是血小板活化因子(PAF)受体的拮抗剂[6]。我们以及其他学者的研究表明,银杏内酯B能够抑制血小板聚集和炎症因子释放[7],能够减轻氧化低密度脂蛋白诱导的内皮细胞炎症反应[8-9]。还有研究显示,银杏内酯B能够通过调节Bcl-2/Bax的比例来抑制神经细胞凋亡,发挥神经保护作用[10-11]。然而,银杏内酯B是否能够抑制高糖诱导的内皮细胞凋亡尚不清楚。本研究观察了银杏内酯B对高糖引起的内皮细胞迁移变化、ROS产生以及细胞凋亡的影响,并分析相关的分子机制。
1 材料与方法
1.1 药品和试剂 银杏内酯B购自江苏大观园商贸公司,纯度为95% (批号:BAT2007115)。Ⅰ型胶原酶、明胶购自Sigma公司;胰蛋白酶、特级胎牛血清购自Hyclone公司;Medium 199培养基购自Gibco(Invitrogen公司);葡萄糖购自Amresco公司;抗Bax、Bcl-2、caspase-3、phospho-p53、p53、β-actin抗体购自Santa Cruz公司;辣根过氧化物酶标记的山羊抗兔二抗、山羊抗小鼠二抗、兔抗山羊二抗购自北京中杉金桥公司。Transwell小室购自Corning公司;Annexin Ⅴ、FITC凋亡试剂盒购自Dojindo公司;活性氧检测试剂盒(S0033)购自碧云天生物科技有限公司。
1.2 人脐静脉内皮细胞的分离与培养 取新鲜脐带,用Ⅰ型胶原酶(1 g·L-1)灌注到脐静脉20 min,收集灌注液离心。将内皮细胞在含20%特级胎牛血清的M199培养基中培养,加入100 kU·L-1青霉素和100 kU·L-1链霉素,在含5% CO2的37℃培养箱中培养,细胞传至3代供实验使用。
1.3 Western blot 方法检测蛋白表达 将细胞分为对照组、高糖组(30 mmol·L-1)、银杏内酯B(0.2、0.4、0.6 g·L-1)处理组。实验前换用含0.5%胎牛血清的培养基同步化处理内皮细胞12 h,然后分别加入0.2、0.4、0.6 g·L-1银杏内酯B孵育1 h,加入30 mmol·L-1葡萄糖孵育细胞6 h。弃培养基,加入蛋白裂解液,收集蛋白。用BCA法测定蛋白浓度,取20 μg蛋白样品,经SDS-PAGE电泳、转膜。用含5%的牛血清白蛋白封闭,室温,1 h,洗膜。分别加入稀释的特异性的抗体(1 ∶1 000),4℃孵育过夜。用含0.5% Tween 20的PBS洗膜3次,每次5 min,加二抗(1 ∶10 000),室温孵育2 h。洗膜3次,加入ECL发光液,用化学发光凝胶成像仪成像。
1.4 人脐静脉内皮细胞迁移实验 将细胞分为对照组、高糖组、银杏内酯B(0.6 g·L-1)处理组。用Fibronectin 包被Transwell小室滤膜, 37℃,1 h。分别在Transwell小室内加入100 μL、小室外加入600 μL细胞培养基,在培养箱中平衡1 h。去除小室内培养基,接种100 μL细胞悬液(4×108·L-1)培养24 h。实验前换用含0.5%胎牛血清的培养基同步化处理内皮细胞12 h,用0.6 g·L-1银杏内酯B孵育细胞1 h,高糖刺激细胞12 h。用PBS洗小室3次。用4%多聚甲醛固定10 min,0.5%结晶紫染色30 min,PBS洗3次。取下滤膜,置于载玻片上。在显微镜下观察内皮细胞,用CCD成像,每组随机选5个视野,进行细胞计数。
1.5 Annexin Ⅴ-FITC试剂盒检测细胞凋亡 将细胞分为对照组、高糖组、银杏内酯B(0.6 g·L-1)处理组。用0.1%胰酶消化内皮细胞,加入20%胎牛血清,用PBS洗2遍,制成细胞悬液,调整细胞浓度为5×107·L-1,将2 mL细胞悬液加入到6孔培养板,培养24 h。用银杏内酯B(0.6 g·L-1)孵育1 h,用葡萄糖(30 mmol·L-1)处理细胞6 h,收集细胞。将待测细胞调整为1×109·L-1,加入5 μL FITC-Annexin Ⅴ和5 μL PI,轻轻混匀,室温避光15 min。再加入400 μL Binding buffer悬浮细胞,用流式细胞仪(BD, FACSCalibur)检测各组细胞凋亡。
1.6 活性氧(ROS)测定 将细胞分为对照组、高糖组、银杏内酯B(0.2、0.4、0.6 g·L-1)处理组。于6孔板中培养内皮细胞,实验前同步化处理细胞12 h。然后分别加入0.2、0.4、0.6 g·L-1银杏内酯B孵育1 h,加入葡萄糖(30 mmol·L-1)刺激细胞6 h。使用荧光探针DCFH-DA(1 ∶1 000)孵育内皮细胞,37℃,30 min,洗涤内皮细胞3次。用CARY Eclipse 荧光分光光度计在激发波长为488 nm,发射波长为525 nm下测定细胞内的荧光强度。
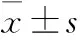
2 结果
2.1 银杏内酯B对高糖诱导的内皮细胞迁移的影响 本研究评价了高糖对内皮细胞迁移,以及银杏内酯B对其作用的影响。Transwell的结果显示,高糖(30 mmol·L-1)处理组内皮细胞的迁移数量明显减少,迁移率为(66.6±15.6)%,银杏内酯B组的内皮细胞迁移率为(94.8±11.4)%,二组比较差异有显著性(P<0.05)(Fig 1)。表明银杏内酯B可以改善高糖引起的内皮细胞迁移功能损伤。
2.2 银杏内酯B对高糖诱导内皮细胞ROS产生的影响 为了探讨高糖诱导内皮细胞的氧化应激反应,我们分析了高糖诱导的内皮细胞ROS产生。结果显示,30 mmol·L-1高糖刺激组ROS产生增加了2.75倍,与对照组比较差异有显著性(P<0.05)。银杏内酯B(0.2、0.4、0.6 g·L-1)以剂量依赖的方式抑制高糖诱导的内皮细胞ROS产生(Fig 2)。0.6 g·L-1银杏内酯B完全抑制了高糖增加的ROS产生,与高糖组比较二者差异有显著性(P<0.05)。
2.3 银杏内酯B对高糖诱导内皮细胞凋亡的影响 我们使用免疫荧光观察了高糖和银杏内酯B对内皮细胞凋亡的影响。结果显示,高糖处理组细胞凋亡明显增加,凋亡率为(211.6±25.9)%,而银杏内酯B(0.6 g·L-1)处理抑制了高糖诱导的细胞凋亡,凋亡率为(137.1±29.3)%,二组比较差异具有统计学意义(P<0.05)。进而使用流式细胞仪分析了细胞凋亡率,利用Annexin Ⅴ、PI标记凋亡细胞。结果显示,高糖 (30 mmol·L-1)刺激组细胞凋亡率为(53.8±2.6)%,而银杏内酯B(0.6 g·L-1)处理组细胞凋亡率为(44.0±3.1)%,两组差异具有统计学意义(P<0.05)(Fig 3)。

Fig 1 Effect of ginkgolide B on cell transmigrationin high glucose-treated HUVECs
A:Ginkgolide B recovered the transmigration in high glucose-treated HUVECs(×400);B:Analysis of HUVECs transmigration(n=3).#P<0.05vscontrol group;*P<0.05vshigh glucose-treated cells

Fig 2 Effect of ginkgolide B on ROSgeneration in high glucose-treated HUVECs
The level of ROS was measured by fluorescence spectrophotometer. Ginkgolide B inhibited high glucose-induced ROS production(n=3).#P<0.05vscontrol group;*P<0.05,**P<0.01vshigh glucose-treated cells

Fig 3 Effect of ginkgolide B on apoptosisin high glucose-treated HUVECs
A:Ginkgolide B inhibited apoptosis in high glucose-treated HUVECs(Green fluorescence labeled apoptotic cells); B:Apoptosis was measured by flow cytometry;C:Analysis of apoptosis by immunofluorescence;D:Analysis of apoptosis by flow cytometry(n=3).#P<0.05vscontrol group;*P<0.05vshigh glucose-treated cells.
2.4 银杏内酯B对高糖诱导内皮细胞凋亡相关蛋白Bax、Bcl-2、caspase-3表达的影响 利用Western blot 方法分析Bax、Bcl-2、caspase-3表达。结果显示,在使用高糖(30 mmol·L-1)刺激内皮细胞后,Bax增加了34.7%,而Bcl-2表达降低了36.4%。银杏内酯B处理抑制了Bax表达,并增加Bcl-2表达,统计学处理显示二组之间有明显差异(P<0.05)。对caspase-3的分析表明,高糖刺激内皮细胞caspase-3表达增加了两倍, 而银杏内酯B (0.6 g·L-1)完全抑制了高糖诱导的caspase-3表达,与高糖组比较二者差异有显著性(P<0.05)(Fig 4)。
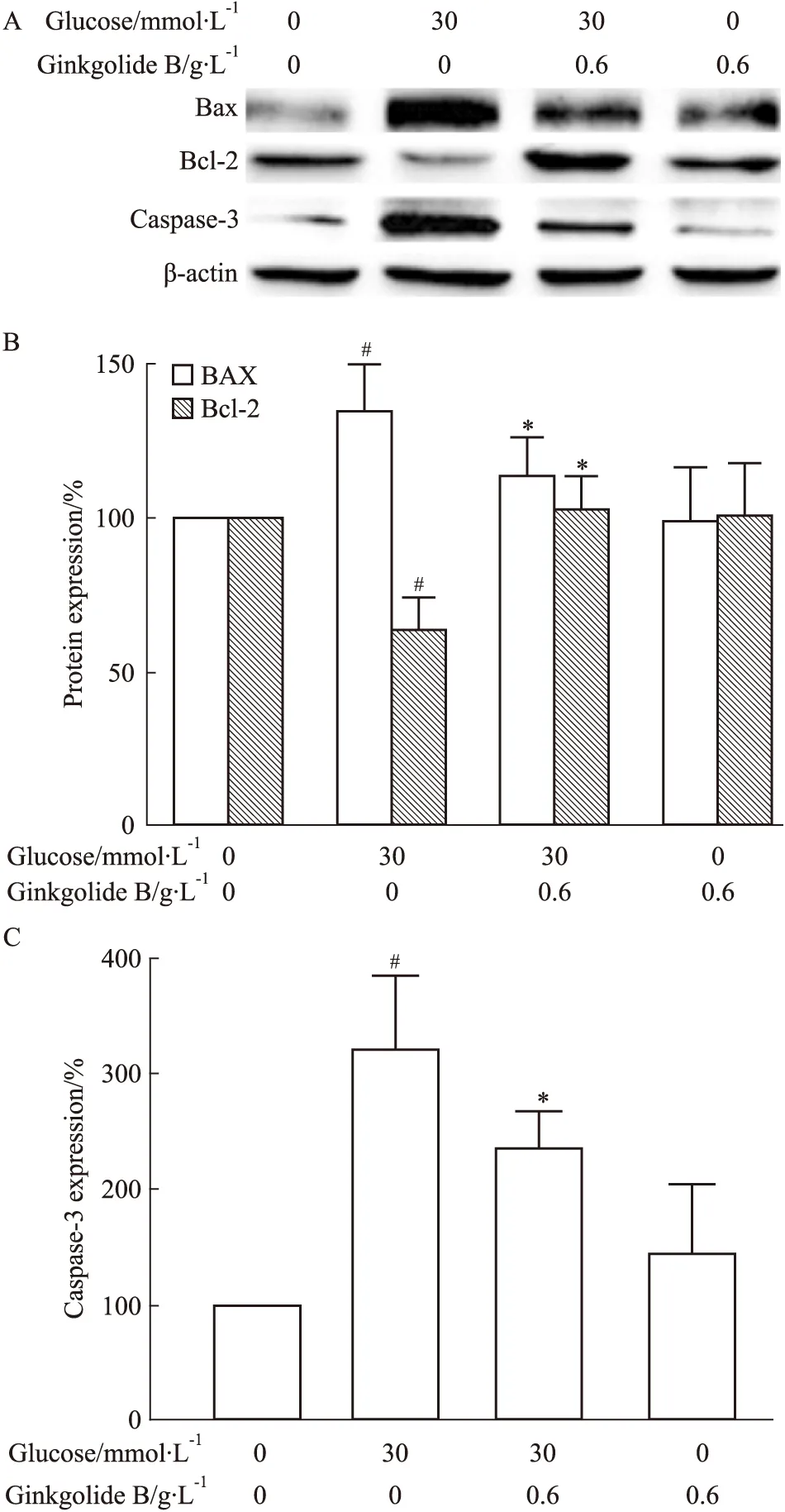
Fig 4 Effect of ginkgolide B on Bax,Bcl-2 and caspase-3 expressions in high glucose-treated HUVECs
A:Bax,Bcl-2 and Caspase-3 expressions were detected by Western blot;B,C:Density analysis of protein expression(n=3).#P<0.05vscontrol group;*P<0.05vshigh glucose-treated cells
2.5 银杏内酯B对高糖诱导内皮细胞p53的影响 研究表明p53参与调控细胞凋亡,为了评价银杏内酯B抑制高糖诱导的细胞凋亡是否与p53相关,我们分析了p53的表达和磷酸化。结果表明,高糖(30 mmol·L-1)处理的内皮细胞p53蛋白表达量增加了23.2%,其磷酸化水平增加了两倍,而银杏内酯B(0.6 g·L-1)完全抑制了高糖刺激的p53表达及磷酸化(Fig 5),两组比较差异具有统计学意义(P<0.05)。

Fig 5 Effect of ginkgolide B on expression andphosphorylation of p53 in high glucose-treated HUVECs
A:Ginkgolide B suppressed the expression and phosphorylation of p53 induced by high glucose;B:Density analysis of p53 expression;C:Density analysis of p53 phosphorylation(n=3).#P<0.05vscontrol group;*P<0.05vshigh glucose-treated cells
3 讨论
血管内皮细胞损伤是糖尿病血管合并症的重要病理变化[12]。血糖升高可以导致血管内皮细胞功能损伤[13]。但到目前为止,高糖诱导内皮细胞损伤的机制并不完全清楚。有文献指出内皮细胞功能损伤与细胞氧化代谢产物聚积和线粒体功能紊乱相关[14],也有研究认为糖尿病导致的血管慢性炎症状态是血管稳态失衡的重要原因[15]。
银杏内酯B是银杏叶提取物,具有抗炎、抗血栓等多种生物保护作用[2]。我们先前的研究已经证实[16],银杏内酯B能够抑制高糖诱导的内皮细胞炎症蛋白表达。但银杏内酯B能否改善高糖引起的内皮细胞迁移抑制和细胞凋亡还不清楚。本研究首先观察了高糖损伤内皮细胞功能的现象,发现正常状态下内皮细胞具有较好的迁移能力,但是高糖处理损伤了内皮细胞的迁移功能,表现为内皮细胞迁移数量减少,而银杏内酯B逆转了这种现象,表明银杏内酯B具有改善内皮细胞迁移功能的作用。
活性氧(reactive oxygen species,ROS)是细胞内氧化应激的代谢产物,在某些特定情况下可以反映细胞氧化应激水平。它在生理条件下可以参与细胞代谢,作为第二信使参与维持细胞功能。但在病理条件下,ROS的产生过多则会导致细胞的氧化损伤[17]。本研究发现,高糖刺激内皮细胞之后,ROS水平明显增高,0.2 g·L-1的银杏内酯B有效地抑制高糖诱导的ROS产生,0.6 g·L-1银杏内酯B处理则完全抑制了高糖诱导的ROS产生,表明高糖刺激引起了细胞氧化应激反应,而银杏内酯B具有较好的抗氧化作用。
细胞凋亡是能够反映细胞损伤的一种重要表现形式。本研究发现,高糖能够明显增加内皮细胞凋亡,而使用银杏内酯B能够抑制高糖诱导的细胞凋亡。Bax、Bcl-2是Caspase上游分子,参与调节细胞凋亡。生理状态下Bcl-2/ Bax保持相对平衡。病理条件下当Bax上调、Bcl-2下调则会促进细胞凋亡[3]。本研究结果显示,高糖刺激下内皮细胞凋亡率明显增加,凋亡相关蛋白Bax表达增高、Bcl-2表达降低,而银杏内酯B逆转了这一现象。
Caspase-3是参与细胞凋亡过程中的信号分子,它的活化可以被Bcl-2阻断,从而产生抑制凋亡的作用[3]。本研究结果也证实高糖增加了caspase-3表达,而银杏内酯B抑制了其表达。大量研究显示[18],p53在凋亡中起到了重要的调控作用。研究表明,野生型p53是抑癌基因,其功能在于促进肿瘤细胞凋亡和抑制持续性的细胞增殖,它可以激活Bcl-2家族中的促凋亡蛋白Bax的表达,从而起到调控细胞凋亡的作用。我们的结果也发现高糖处理增加了p53的表达和磷酸化,提示p53可能参与高糖诱导的内皮细胞凋亡,而银杏内酯B对内皮细胞凋亡的抑制作用可能与抑制p53活化相关。
综上所述,银杏内酯B能够抑制高糖诱导的ROS产生和细胞凋亡,其分子机制与调节Bcl-2/Bax、抑制caspase-3表达以及p53活化相关。银杏内酯B对高糖诱导的内皮细胞损伤具有保护作用,这些结果对于糖尿病血管病变的防治具有重要意义。
(致谢:本文在北京老年医学研究所免疫室完成,在此对参与此工作的研究人员加以致谢!)
[1] Uusitupa M,Schwab U.Diet,inflammation and prediabetes-impact of quality of diet[J].CanJDiabetes,2013,37:327-31.
[2] 孙文佳,孙 杰,陈北冬,等.银杏内酯B抑制高糖诱导内皮细胞TLR4及炎症蛋白表达[J].中国药理学通报,2015,31(5):636-40.
[2] Sun W J,Sun J,Chen B D,et al. Effect of ginkgolide B on TLR4 and inflammatory protein expression in high glucose treated human umbilical vein endothelial cells[J].ChinPharmalcolBull,2015,31(5):636-40.
[3] Chao D T,Korsmeyer S J. BCL-2 family: regulators of cell death[J].AnnuRevImmunol,1998,16:395-419.
[4] Yang L,Wu L,Du S,et al.1,25(OH)2D3 inhibits high glucose-induced apoptosis and ROS production in human peritoneal mesothelial cells via the MAPK/P38 pathway[J].MolMedRep,2016,14(1):839-44.
[5] Duan P,Hu C,Quan C,et al. 4-Nonylphenol induces apoptosis, autophagy and necrosis in Sertoli cells: Involvement of ROS-mediated AMPK/AKT-mTOR and JNK pathways[J].Toxicology,2016,341-3:28-40.
[6] Touvay C,Vilain B,Taylor J E,et al. Proof of the involvement of platelet activating factor(paf-acether) in pulmonary complex immune systems using a specific paf-acether receptor antagonist: BN 52021[J].ProgLipidRes,1986,25(1-4):277-88.
[7] Liu X,Yan Y,Bao L,et al. Ginkgolide B inhibits platelet release by blocking Syk and p38 MAPK phosphorylation in thrombin-stimulated platelets[J].ThrombRes,2014,134(5):1066-73.
[8] Shu Z M,Shu X D, Li H Q,et al. Ginkgolide B protects against ischemic stroke Via modulating microglia polarization in mice[J].CNSNeurosciTher,2016,22(9):729-39.
[9] Zhou T,You W T,Ma Z C,et al. Ginkgolide B protects human umbilical vein endothelial cells against xenobiotic injuries via PXR activation[J].ActaPharmacolSin,2016,37(2):177-86.
[10]Gu J H,Ge J B,Li M,et al. Inhibition of NF-kappaB activation is associated with anti-inflammatory and anti-apoptotic effects of Ginkgolide B in a mouse model of cerebral ischemia/reperfusion injury[J].EurJPharmSci,2012,47(4):652-60.
[11]Song Y,Zeng Z,Jin C,et al. Protective effect of ginkgolide B against acute spinal cord injury in rats and its correlation with the Jak/STAT signaling pathway[J].NeurochemRes,2013,38(3):610-9.
[12]Johnstone M T,Creager S J,Scales K M,et al. Impaired endothelium-dependent vasodilation in patients with insulin-dependent diabetes mellitus[J].Circulation,1993,88(6):2510-6.
[13]Lontchi-Yimagou E,Sobngwi E,Matsha T E,et al. Diabetes mellitus and inflammation[J].CurrDiabRep,2013,13(3):435-44.
[14]Roberts A C,Porter K E.Cellular and molecular mechanisms of endothelial dysfunction in diabetes[J].DiabVascDisRes,2013,10(6):472-82.
[15]Uusitupa M,Schwab U. Diet, inflammation and prediabetes-impact of quality of diet[J].CanJDiabetes,2013,37(5):327-31.
[16]马丽娜,陈北冬,赵艳阳,等.银杏内酯B对内皮细胞的保护作用及分子机制研究 [J].中国药理学通报,2013,29(2):189-93.
[16]Ma L N,Chen B D,Zhao Y Y,et al. Protective effect of ginkgolide B on ox-LDL stimulated endothelial cells[J].ChinPharmalcolBull,2013,29(2):189-93.
[17]Lassegue B,San Martin A, Griendling K K. Biochemistry, physiology, and pathophysiology of NADPH oxidases in the cardiovascular system[J].CircRes,2012,110(10):1364-90.
[18]Kruiswijk F,Labuschagne C F,Vousden K H. p53 in survival, death and metabolic health: a lifeguard with a licence to kill[J].NatRevMolCellBiol,2015,16(7):393-405.
Ginkgolide B inhibits apoptosis in high glucose-stimulated human umbilical vein endothelial cells
CHEN Kun,ZHANG Ming,CHEN Bei-dong,ZHAO Yan-yang,WU Wei,QI Ruo-mei
(TheMOHKeyLaboratoryofGeriatrics,BeijingHospital/BeijingInstituteofGeriatrics,NationalCenterofGerontology,Beijing100730,China)
Aim To investigate the effect of ginkgolide B on apoptosis in high glucose-treated endothelial cells.Methods Human umbilical vein endothelial cells(HUVECs) were used in the present study. The level of transmigration of HUVECs was analyzed by Transwell experiment. Apoptosis was detected by flow cytometry. Reactive Oxygen Species(ROS) was measured by immunofluorescence kit. The protein expression was analyzed by Western blot.Result High glucose treatment resulted in a reduction in transmigration of HUVECs and ginkgolide B recovered the phenomenon in glucose-treated endothelial cells. The level of ROS generation was increased in high glucose-treated group, whereas ginkgolide B inhibited ROS generation. Immunofluorescence data showed high glucose increased apoptosis, whereas ginkgolide B inhibited apoptosis in high glucose-treated HUVECs. Moreover, the expressions of Bax and caspase-3 were increased and Bcl-2 was reduced in high glucose-treated group. In contrast, ginkgolide B abolished the expressions of Bax and caspase-3 and increased Bcl-2 expression. Moreover, high glucose enhanced the expression and phosphorylation of p53, while ginkgolide B suppressed the expression and phosphorylation of p53 induced by high glucose.Conclusions Ginkgolide B can inhibit apoptosis and improve transmigration function in high glucose-treated HUVECs. Ginkgolide B has protection against high glucose-induced endothelial cell injury.
ginkgolide B;glucose;HUVECs;ROS;apoptosis;p53
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.034.html
2016-10-24,
2016-12-05
国家自然科学基金资助项目(No 81471051,81270379,81070231)
陈 坤(1991-),男,硕士,研究方向:心血管疾病基础,Tel:010-58115047,E-mail:chenkunbut@163.com; 齐若梅(1957-),女,博士,研究员,博士生导师,研究方向:动脉粥样硬化、血栓学的分子机制,通讯作者,Tel:010-58115047,E-mail:ruomeiqi@163.com
10.3969/j.issn.1001-1978.2017.03.017
A
1001-1978(2017)03-0378-06
R284.1;R322.123;R329.25;R341;R587.1;R977.6
