冬眠心肌的能量代谢与线粒体解偶联蛋白2的调控作用
2017-03-17宋海英王培利刘剑刚王承龙
宋海英,王培利, 刘剑刚,王承龙
(中国中医科学院西苑医院心血管病中心,心血管病研究所,北京 100091)
◇讲座与综述◇
冬眠心肌的能量代谢与线粒体解偶联蛋白2的调控作用
宋海英,王培利, 刘剑刚,王承龙
(中国中医科学院西苑医院心血管病中心,心血管病研究所,北京 100091)
冬眠心肌是处于低灌注、低功能状态的一种自我保护心肌,心肌在低灌注状态下建立了心肌产能和耗能的平衡以维持心肌的存活性。冬眠心肌广泛存在于冠心病患者中,其底物代谢模式由脂肪酸代谢为主转变为以糖酵解为主的代谢模式,脂肪酸氧化、三羧酸循环、电子传递链相关酶均减低,活性氧簇(reactive oxygen species,ROS)生成增多,解偶联蛋白(uncoupling protein 2,UCP2)表达增高,能量代谢出现障碍,其中UCP2是位于线粒体内膜的质子转运体,是一种“质子漏”,即质子不经过ATP合成酶(adenosine triphosphate synthase,ATP)而直接经过UCP2进入线粒体基质,导致的氧化磷酸化的解偶联,引起ATP生成 的减少,能量代谢的障碍导致了心肌收缩功能减低。UCP2的表达受因上游蛋白、脂肪酸、ROS、嘌呤核苷酸的调控。通过调控UCP2可以增加冬眠心肌的产能,影响冬眠心肌的能量代谢。
冠心病;存活心肌;冬眠心肌;能量代谢;线粒体;解偶联蛋白2
冠心病出现左心室收缩功能不全的病理生理机制的关键在于受损心肌收缩功能不全,经缺血事件后,功能受损但保留有活性的心肌称为存活心肌(viable myocardium,VM),包括冬眠心肌(hibernating myocardium,HM)、顿抑心肌(stunned myocardium,SM)。冬眠心肌是指处于低灌注、低功能状态的存活心肌,在持续缺血的条件下,冬眠心肌通过降低心肌收缩力、改变能量代谢方式以从缺血中确保其存活。冬眠心肌在各类慢性心脏病中广泛存在,如慢性不稳定性心绞痛,心肌梗死、心力衰竭等。
目前,HM的发生机制尚不清楚,心肌细胞内Ca2+明显减少,能量代谢发生障碍,无氧代谢明显增加,而心肌缺血后可引起糖代谢及高能磷酸物质的衰竭,尤其能量代谢的障碍可能与HM有关。线粒体是进行能量代谢的重要场所,而线粒体内外膜蛋白在能量代谢中发挥着重要作用,通过调节这些线粒体膜蛋白能起到减少线粒体缺血损伤,对心肌细胞的存活起到有效的保护作用,并维持心肌细胞形态稳定和功能的正常,本文就近年来HM的能量代谢和线粒体解偶联蛋白2调控作用的相互关系研究做一综述。
1 冬眠心肌概念的提出
1978年,Diamond等[1]首先提出心肌冬眠这个概念,认为心肌冬眠是冠心病患者的一种持续心室壁运动异常,而当冠状动脉血液恢复正常供给后,这种心肌收缩机能的异常是可逆的。
Rahimtoola等[2]提出了“smart heart”假说,即由于冠状动脉狭窄引起的、持续的亚急性或者慢性心肌缺血会使心脏抑制心肌代谢和心肌收缩力,认为心肌在低灌注状态下建立了心肌产能和耗能的平衡以维持心肌的存活性。同样的,学者认为,在持续缺血的条件下,冬眠心肌细胞通过降低心肌收缩力及心肌代谢而在缺血状态中确保其存活,这是对慢性缺血的适应性改变,这种适应性改变增强了缺血心肌抗氧化应激的能力。不同于顿抑心肌的“灌注-收缩不匹配”,即在正常灌注时收缩功能低下,冬眠心肌的特点为“灌注-收缩匹配”[3],即低灌注,低功能、灌注改善,功能改善。冬眠心肌与顿抑心肌常同时存在于缺血心脏,但是从心肌结构改变角度看,与顿抑心肌相比,冬眠心肌的结构改变更重,有学者认为,心肌冬眠是由于反复的心肌顿抑引起的[4]。
2 冬眠心肌细胞的病理形态改变
心肌灌注不足导致缺血后,其心肌结构发生变化,在光学显微镜下,冬眠心肌可见心肌细胞直径增大,细胞核密度减低,心肌组织肌小节减少,电子显微镜下超微结构可见破碎的肌小节,肌浆网排列紊乱、减少,线粒体变小,不同程度的嵴减少,严重的可出现空泡现象和染色质凝结成块现象,并且伴有心肌糖原的累积、间质胶原增多、心肌细胞凋亡等病理改变。
3 冬眠心肌的能量代谢特性
正常心肌能量的60%~90%由脂肪酸β氧化供能[5],冬眠心肌的代谢模式由脂肪酸为主转变为以葡萄糖代谢为主的模式,即从脂肪酸有氧代谢转变为无氧糖酵解[6]。灌注/代谢可用于鉴别心肌,冬眠心肌的特点为“灌注-代谢不匹配”,利用201TI心肌灌注断层显像示冬眠心肌灌注减低,但18F-FDG 正电子发射型计算机断层显像(positron emission computed tomography,PET)显示该区域心肌糖摄取增高[7],这可能与葡萄糖转运蛋白(glucose transporter,GLUT)有关,心肌葡萄糖转运主要依靠其GLUT4[8],在冬眠心肌中p38 MAPK通路激活,使GLUT4增高[9]。一系列的研究表明,冬眠心肌中有关代谢、凋亡、细胞骨架、转录及翻译、细胞分化与增殖、收缩、离子转运、应激蛋白、收缩蛋白类、热休克蛋白、信号转导等方面的蛋白表达与正常心肌有明显区别[10],如三羧酸循环(苹果酸脱氢酶、延胡索酸酯酶、琥珀酰辅酶连接酶的β亚基、α-酮戊二酸)、脂肪酸代谢(肉碱棕榈酰转移酶1、丙酰CoA羧化酶β链、CoA脱氢酶)以及氨基酸代谢(异戊酰CoA脱氢酶、甲基丙二酸半醛脱氢酶)酶类明显减低,无氧代谢糖酵解和糖原生成酶类含量增高。
4 冬眠心肌线粒体的变化
线粒体是能量产生的主要场所,也是缺血时主要受累的细胞器,如前所述,冬眠心肌的细胞存活是以心肌收缩功能减低为代价的,这可能是与有氧代谢减低及电子传递链酶类表达及活性减低有关,存活心肌中提取的线粒体氧化能力减低,活性氧簇(reactive oxygen species,ROS)生成增多,抗氧化应激能力减低。高效液相色谱法检测显示,与正常心肌相比,冬眠心肌内的三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)和总腺苷酸水平明显降低,另外缺血导致了冬眠心肌的氧摄取减低、ATP消耗减慢、线粒体呼吸控制率减低、电子传递链酶类减低、ATP合成酶减低、解偶联蛋白2(uncoupling protein 2,UCP2)的表达增高[11],说明在冬眠心肌中存在着线粒体呼吸功能及氧化磷酸化功能的异常。冬眠心肌产能减少,收缩功能下降与底物氧化模式的改变参与产能的酶类的减少以及UCP2增高密切相关。
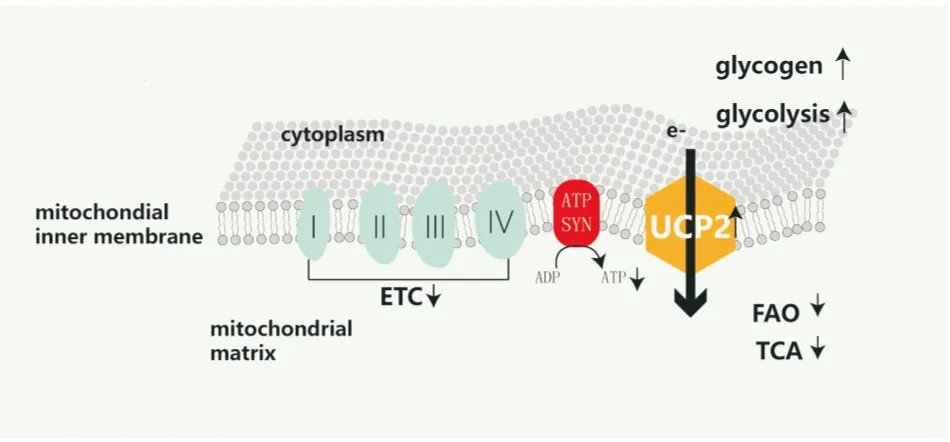
Fig 1 Metabolic change of hibernating myocardium
ETC:electron transport chain; ATP SYN:ATP synthase; UCP2:uncoupling protein 2; FAO:fat acid oxidation; TCA:tricarboxylic cacid cycle
4.1 线粒体能量代谢与解偶联蛋白 哺乳动物表达的解偶联蛋白有5种,分布于不同的组织当中,UCP1是第一个被发现的解偶联蛋白,是主要分布在棕色脂肪(brown adipose tissue,BAT),UCP1参与产热以保持体温,人类UCP2广泛分布于多种组织中,如心肌、胰腺、中枢神经系统、视网膜、肾脏、脾脏等细胞中。UCP3 主要分布与肌肉组织与棕色脂肪中,也分布于心肌中,UCP4 和UCP5主要分布与脑组织中。
4.2 线粒体氧化磷酸化与解偶联蛋白 线粒体是细胞产生能量的主要细胞器,参与能量代谢、氧化应激、细胞运动、细胞凋亡等过程,线粒体使用细胞摄取的90%氧气以介导氧化磷酸化(oxidative phosphorylation,OXPHOS),偶联底物氧化与ATP生成。氧化磷酸化过程中由还原型辅酶I(reduced nicotinamide adenine dinucleotide,NADH)和还原型黄素二核苷酸(reduced flavin adenine dinucleotide,FADH2)释放的电子沿着呼吸链即电子传递链(electron transport chain, ETC)传递,最终与分子氧结合。呼吸链复合物主要分布在线粒体嵴,由细胞色素C和辅酶Q及4个蛋白质组成:NADH开始的主呼吸链由复合物Ⅰ(NADH脱氢酶)、复合物 Ⅲ(细胞色素C还原酶)和复合物Ⅳ(细胞色素C氧化酶)构成,由FADH2开始的次呼吸链由复合物Ⅱ(琥珀酸脱氢酶)、复合物 Ⅲ、复合物 Ⅳ构成。Peter Mitchell提出,电子传递伴随着质子由线粒体基质释放到膜间隙,这种质子梯度驱使质子的移动,质子经F0F1 ATP合成酶转运回线粒体基质,此时F0F1 ATP合成酶将ADP磷酸化为ATP。解偶联蛋白介导跨线粒体内膜的质子流,被形容为“质子漏”(proton leak),通过ETC进入线粒体膜间隙的质子通过UCP进入线粒体基质,而不通过F0F1 ATP合成酶,也就是不经过ATP合成酶氧化磷酸化进入线粒体,使呼吸链与ATP产生解偶联,成为了线粒体膜电位(mitochondrial membrane potential,MMP)、线粒体呼吸功能、ROS的关键调节蛋白。
4.3 解偶联蛋白2的调控 不同于其他的解偶联蛋白,UCP2存在于多种组织的线粒体内膜中,参与了不同的病理生理过程,如动脉粥样硬化、免疫反应、代谢、肿瘤等过程, 多数与氧化应激、能量代谢有关。UCP2 的表达受饮食、药物、脂肪酸、甲状腺素、去甲肾上腺素、ATP 、ADP、 GDP、 GTP、 ROS 水平、上游蛋白调控等多种因素的影响,其调节可发生在转录、翻译及翻译后水平等多个层面。
4.3.1 过氧化物酶体增殖物激活受体 过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)是一组核激素受体,可被过氧化物酶体增殖物激活,主要调控细胞的糖代谢、脂代谢、能量调控、炎症、动脉粥样硬化、细胞增殖分化,可被游离脂肪酸(free fat acid,FFA)或降脂药物激活。PPAR包括3个亚型,PPARα、PPARδ(即PPARβ)和PPARγ。PPARα主要表达于脂肪酸氧化活跃的细胞,如肝、心脏、骨骼肌细胞等,PPARδ广泛表达于组织细胞,PPARγ主要表达于脂肪细胞。PPARα 的激活可以增加 UCP2 及其他自由基清除剂的表达,而 PPARγ 可能通过影响 UCP3 的基因转录间接调节 UCP2 的表达[12]。当脂肪酸的分解代谢活跃时,PPARα活性增高,伴随着UCP2水平的提高[13],另一项研究通过醋酸上调脂肪酸氧化酶,PPARα水平增高同时伴随着UCP2表达增高,但AMPKα2亚基缺如的细胞中,没有观察到上述改变[14],且AMPK 可以激活PPARα 对 UCP2 的上调作用[15],可以上调内皮细胞的 UCP2 蛋白水平,说明PPAR上游可能是受AMPK调控。
4.3.2 过氧化物酶体增殖物受体1共激活因子 过氧化物酶体增殖物受体1共激活因子1α(peroxisome-proliferator-activated receptor co-activator-1α, PGC-1α)是一种转录共激活因子,调控线粒体生成、代谢、线粒体抗氧化应激等,PGC-1α可以与UCP2启动子区的甲状腺激素反应元件(thyroid hormone response elements ,TRE)共同作用,提高UCP2的表达。向小鼠脑内注射PGC-1α 小分子RNA,96 h后通过Western blot和 RT-PCR测得大脑内PGC-1α浓度增高,同时UCP2、线粒体DNA、ATP含量增高[16],说明PGC-1α可促进线粒体的合成代谢、抗氧化应激损伤,ATP含量增高可能与线粒体合成增多有关。在耐力运动鼠模型中发现,AMPK调控UCP2的活性,可能是通过增加PGC-1α含量[17],与PPARs相似,PGC-1α上游可能也是受AMPK调控。
4.3.3 活性氧簇 线粒体是ROS产生的主要细胞器,线粒体呼吸链传递电子的同时伴随着活性氧的产生,主要有复合物I和III产生。ROS的产生与线粒体质子梯度密切相关,当线粒体呼吸功能增强时电子传递链释放的质子增多,质子梯度升高,ROS产生增多。UCP2是线粒体氧化应激的感受器,当ROS水平升高时UCP2表达增高,以抵抗氧化应激,ROS介导UCP2的质子内流,使膜电位降低,减少ROS释放[18]。研究表明[19],当线粒体ROS水平和氧化还原反应维持在正常水平时,UCP2谷胱甘肽化,功能减低,但是当ROS水平轻微上升,UCP2脱谷胱甘肽化被激活,形成负反馈环。
4.3.4 脂肪酸 有大量的研究已经表明,脂肪酸可以上调UCP2的功能,脂肪酸可以通过激活PPAR,使UCP2表达增高。Rupprecht等[20]制作了由UCP1、UCP2构成的生物膜和UCP1、UCP2及不饱和脂肪酸构成的膜并进行比较,结果提示解偶联蛋白在有游离脂肪酸的条件下可以减低线粒体膜电位。已知过氧化产物与UCP2之间存在负反馈反应,学者认为UCP2同样使多不饱和脂肪酸的脂质过氧化产物生成减少[21]。脂质过氧化产物 4-羟基壬烯醛(4-hydroxynonenal,HNE)是一种不饱和羟烯,具有抗氧化损伤的作用,HNE可作为一个信号分子可以促进UCP2引起质子内流[22],外源性HNE同样可以导致解偶联蛋白导致的质子漏,减低氧化磷酸化,且呈浓度依赖性[23]。HNE可能是通过引起解偶联单蛋白构象的改变,使质子通过通道回流到线粒体基质,且HNE导致的质子内流以高线粒体膜电位为条件。
4.3.5 嘌呤核苷酸 在体和体外研究表明嘌呤核苷2、3磷酸可以抑制解偶联蛋白的质子漏。鸟嘌呤和腺嘌呤呈现出对脂肪酸导致的解偶联蛋白解偶联作用持续的抑制效应,且以GTP 、 ATP、GDP、ADP、 GMP、 AMP顺序递减[24]。Berardi等[25]发现GDP对UCP2的作用可能与两者的高亲和力有关,GDP可以与UCP2内通道结合,抑制质子流入从膜间隙流入线粒体基质。
5 冬眠心肌的临床治疗
对冬眠心肌治疗的关键在于恢复缺血心肌的正常血供,血运重建为目前临床最广泛[26]的治疗手段,主要包括外科冠脉旁路移植术、激光心肌血管成形术及经皮穿刺冠状动脉内成形术等。内科治疗可用药物如β受体阻滞剂如美托洛尔,α、β阻滞剂卡维地洛[27],改善心肌代谢药物如曲美他嗪[28]、辅酶Q10[29]。另外尚处于研究阶段的治疗方法有干细胞[30]等,呈现出良好的疗效,有待于进一步探索。
总之,冬眠心肌广泛存在于心脏各类缺血事件中,此部分心肌可视为心功能的“仓库”,当冬眠心肌“苏醒”时心功能可以得到改善,冬眠心肌的能量代谢主要与线粒体的功能相关,受线粒体的呼吸链复合物、ATP合成酶、解偶联蛋白2等的影响,通过调控上述蛋白,改善线粒体功能,进而增加冬眠心肌ATP的生成,使其产能与功能形成新的平衡,也是药物研发的方向。
[1] Diamond G A,Forrester J S,de Luz P L,et al.Post-extrasystolic potentiation of ischemic myocardium by atrial stimulation[J].AmHeartJ,1978,95(2):204-9.
[2] Rahimtoola S H. A perspective on the three large multicenter randomized clinical trials of coronarybypass surgery for chronic stable angina[J].Circulation, 1985,72:V123-35.
[3] Patel P, Ivanov A, Ramasubbu K. Myocardial viability and Revascularization: current understanding and future directions[J].CurrAtherosclerRep,2016,18: 32.
[4] Shah B N, Khattar R S,Senior R. The hibernating myocardium: current concepts, diagnostic dilemmas, and clinical challenges in the post-STICH era[J].EurHeartJ, 2013,34(18):1323-36.
[5] Akhmedov A T,Rybin V, Marin-García J. Mitochondrial oxidative metabolism and uncoupling proteins in the failing heart[J].HeartFailRev,2015,20:227-49.
[6] Lee M S, Park H S, Lee B C,et al. Identification of angiogenesis rich-viable myocardium using RGD dimer based SPECT after myocardial infarction[J].SciRep,2016,6:27520.
[7] Zhang X, Schindler T H, Prior J O, et al.Blood flow, flow reserve, and glucose utilization in viable and nonviable myocardium in patients with ischemic cardiomyopathy [J].EurJNuclMedMolImaging, 2013,40(4): 532-41.
[8] 洪海棉,谢秀利,洪桂祝,等.大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响[J].中国药理学通报,2015,31(11):1569-75.
[8] Hong H M, Xie X L, Hong G Z.Activation of AMPK and PPARγ by emodin influences glucose uptake in 3T3-L1 adipocyte[J].ChinPharmacolBull,2015,31(11):1569-75.
[9] McFalls E O, Hou M, Bache R J, et al. Activation of p38 MAPK and increased glucose transport in chronic hibernating swine myocardium[J].AmJPhysiolHeartCircPhysiol, 2004,287(3):1328-34.
[10]Qu J, Young R, Page B J,et al. Reproducible ion-current-based approach for 24-plex comparison of the tissue proteomes of hibernating versus normal myocardium in swine models[J].JProteomeRes, 2014,13(5):2571-84.
[11]Christopher T, Cayla M, Tammy A,et al.Expression of uncoupling protein-2 remains increased within hibernating myocardium despite successful coronary artery bypass grafting at 4 weeks post-revascularization[J].JSurgRes, 2015, 193(1):15-21.
[12]Chuang Y C, Lin T K, Huang H Y, et al. Peroxisome proliferator-activated receptors gamma/mitochondrial uncoupling protein 2 signaling protects against seizure-induced neuronal cell death in the hippocampus following experimental status epilepticus[J].JNeuroinflammation, 2012, 9:184.
[13]Patterson A D, Shah Y M, Matsubara T, et al. Peroxisome proliferator-activated receptor alpha induction of uncoupling protein 2 protects against acetaminopheninduced liver toxicity[J].Hepatology, 2012,56:281-90.
[14]Kondo T, Kishi M, Fushimi T, et al.Acetic acid upregulates the expression of genes for fatty acid oxidation enzymes in liver to suppress body fat accumulation[J].JAgricFoodChem, 2009,57:5982-6.
[15]Donadelli M, Dando I, Fiorini C, et al. UCP2, a mitochondrial protein regulated at multiple levels[J].CellMolLifeSci. 2014, 71(7): 1171-90.
[16]You Y, Hou Y, Zhai X,et al. Protective effects of PGC-1α via the mitochondrial pathway in rat brains after intracerebral hemorrhage[J].BrainRes, 2016,1646:34-43.
[17]Calegari V C, Zoppi C C, Rezende L F,et al. Endurance training activates AMP activated protein kinase, increases expression of uncoupling protein 2 and reduces insulin secretion from rat pancreatic islets[J].JEndocrinol,2011,208:257-64.
[18]Mailloux R J, Harper M E.Uncoupling proteins and the control of mitochondrial reactive oxygen species production[J].FreeRadicBiolMed, 2011,51:1106-15.
[19]Mailloux R J, Adjeitey C N, Xuan J Y, et al .Crucial yet divergent roles of mitochondrial redox state in skeletal muscle vs. brown adipose tissue energetics[J].FASEBJ, 2012,26:363-75.
[20]Rupprecht A, Sokolenko E A, Beck V, et al.Role of the transmembrane potential in the membrane proton leak[J].BiophysJ,2010,98(8):1503-11.
[21]Brand M D. Uncoupling to survive? The role of mitochondrial inefficiency in ageing[J].ExpGerontol, 2000,35:811-20.
[22]Echtay K S, Esteves T C, Pakay J L, et al. A signalling role for 4-hydroxy-2-nonenal inregulation of mitochondrial uncoupling[J].EMBOJ, 2003,22:4103-10.
[23]Woyda-Ploszczyca A, Jarmuszkiewicz W. Hydroxynonenal-stimulated activity of the uncoupling protein in Acanthamoebacastellanii mitochondria under phosphorylating conditions[J].BiolChem,2013,394:649-58.
[24]Woyda-Ploszczyca A, Jarmuszkiewicz W .Ubiquinol(QH(2)) functions as a negative regulator of purine nucleotide inhibition of Acanthamoeba castellanii mitochondrial uncoupling protein[J].BiochimBiophysActa,2011,1807:42-52.
[25]Berardi M J, Shih W M, Harrison S C,et al. Mitochondrial uncoupling protein 2 structure determined by NMRmolecular fragment searching[J].Nature,2011,476:109-13.
[26]Camici P G, Prasad S K, Rimoldi O E. Stunning, hibernation, and assessment of myocardial viability[J].Circulation, 2008,117(1):103-14.
[27]Schwarz E R, Gupta R, Diep T P,et al.Carvedilol improves myocardial contractility compared with metoprolol in patients with chronic hibernating myocardium after revascularization[J].JCardiovascPharmacolTher, 2005,10(3):181-90.
[28]Bertomeu-Gonzalez V, Bouzas-Mosquera A, Kaski JC.Role of trimetazidine in management of ischemic cardiomyopathy[J].AmJCardiol, 2006,98(5A):19J-24J.
[29]Holley C,Long E K,Crampton M,et al.Myocardial inflammation is reduced by coenzyme Q10 supplementation after CABG in a swine model of hibernating myocardium[J].JAmCollSurg, 2014, 219(3):S34.
[30]Weil B R,Suzuki G, Leiker M M,et al.Comparative efficacy of intracoronary allogeneic mesenchymal stem cells and cardiosphere-derived cells in swine with hibernating myocardium[J].CircRes, 2015,117(7): 634-44.
Metabolism of hibernating myocardium and regulation of uncoupling protein 2
SONG Hai-ying,WANG Pei-li,LIU Jian-gang,WANG Cheng-long
(CenterforCardiovascularDiseases,DepartmentofCardiology,XiyuanHospital,ChinaAcademyofChineseMedicalSciences,Beijing100091,China)
HM(hibernating myocardium) is an adaptive phenomenon of myocardium against sustained ischemia, which maintains its tissue vitality through balancing energy supply and demand. It widely exists in patients suffering from coronary heart disease. HM has its own metabolic pattern, instead of regular FAO(fatty acid β-oxidation)-based metabolism, glycolysis became main procedure. Reduction of FAO,TCA (tricarboxylic cacidcycle), ETC(electron transport chain) enzyme has been observed, ROS(reactive oxygen species) and UCP2(uncoupling protein 2) have been up-regulated.UCP2, which promotes proton leak across inner membrane of mitochondrial and leads to ATP reduction, has emerged as an important regulator of the energy production. It is regulated by up-stream proteins such as AMPK, PPARs, PGC-1α,and other factors like FFA(free fat acid),ROS and purine nucleotide. HM has potential function of ischemic myocardium, which can improve cardiac function through reasonable intervention. Modulation of UCP2 can optimize energy production, and is essential to HM metabolism.
coronary heart disease; viable myocardium; hibernating myocardium; cardiac metabolism; mitochondria; UCP2
时间:2017-3-4 11:49
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1149.002.html
2016-10-17,
2016-12-22
国家自然科学基金面上项目(No 81473528, 81173384,81273934)
宋海英(1989-),女,博士,研究方向:中西医结合心血管病,E-mail:songsonghy@sina.com; 王承龙(1964-),男,博士,主任医师,博士生导师,研究方向:中西医结合心血管病,通讯作者,E-mail:wcl796@163.com; 刘剑刚(1964-),男,副研究员,研究方向:中西医结合心脑血管病的基础和临床,通讯作者,E-mail:liujiangang2002@sina.com
10.3969/j.issn.1001-1978.2017.03.001
A
1001-1978(2017)03-0297-04
R341;R349.1;R541.4;R543.3
