以Nrf2为靶点防治肾脏疾病的研究进展
2017-03-17曹思思张毕奎蒋云生樊新荣
曹思思,颜 苗,张毕奎,蒋云生,樊新荣
(中南大学 1.药学院、2.湘雅二医院药学部、3.临床药学研究所、4.湘雅二医院肾内科,湖南 长沙 410011;5.中国中医科学院,北京 100700)
以Nrf2为靶点防治肾脏疾病的研究进展
曹思思1,2,3,颜 苗2,3,张毕奎2,3,蒋云生4,樊新荣5
(中南大学 1.药学院、2.湘雅二医院药学部、3.临床药学研究所、4.湘雅二医院肾内科,湖南 长沙 410011;5.中国中医科学院,北京 100700)
核因子Nrf2是调控机体内源性抗氧化信号通路的核心转录因子,其调控一系列抗氧化酶、Ⅱ相解毒酶和III相转运体的表达,维持机体氧化还原平衡。而且,Nrf2还能调控炎症反应。近年来,研究证实Nrf2在肾脏疾病的防治中具有重要生理学作用,激活Nrf2能提高细胞或组织的抗氧化应激和抗炎能力,减轻机体损伤。因此,该文综述了Nrf2对各种肾脏疾病的保护作用,探讨以Nrf2为靶点防治肾脏疾病的可能性。
Nrf2;氧化应激;NF-κB;肾缺血/再灌注;急性肾毒性;慢性肾脏疾病;糖尿病肾病
氧化应激和炎症介导多种肾脏疾病的发生发展。氧化应激是由于机体活性氧自由基(reactive oxygen species,ROS)生成增加,抗氧化能力减弱,引起脂质、蛋白和DNA等分子发生损伤。为维持氧化还原平衡,机体启动主要由内源性抗氧化酶组成的抗氧化防御机制。大多数抗氧化酶的表达受抗氧化反应元件调控,由核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)激活。此外,Nrf2活化还能抑制炎症介质的生成。近10年的研究充分证实了Nrf2在减轻多种肾脏疾病中的重要作用,Nrf2活化能减轻肾脏疾病引起的氧化应激和炎症,但Nrf2缺失会放大这些致病通路并导致自身免疫性肾炎的发生。因此,以Nrf2为靶标,补充Nrf2诱导剂可能成为多种肾脏疾病的新型治疗策略。
1 Nrf2-Keap1-ARE通路与氧化应激
正常情况下,机体代谢过程产生的ROS受自身抗氧化防御系统制约。但是,当ROS生成过度,超过抗氧化防御系统清除能力时,ROS能通过攻击、使变性或修饰结构性和功能性分子,激活氧化还原敏感的转录因子和信号传导通路,引起组织损伤、坏死、凋亡、炎症、纤维化等疾病的发生。ROS生成过量是多数肾脏疾病的共性,导致疾病及其并发症的发生发展。Nrf2是机体调控氧化还原平衡的重要因子,在肝脏、肾脏、皮肤、肺和消化道等器官高度表达。正常生理条件下,Nrf2与胞质中负性调控因子Kelch样ECH 联合蛋白1(Kelch-like ECH-associated protein 1,Keap1)结合,Nrf2活性受抑制,表达较低。当机体受到氧化应激因子或亲电物质刺激后,Nrf2与Keap1解偶联,Nrf2转移入核,与核内Maf蛋白结合形成异二聚体后识别并结合启动子区域抗氧化反应元件(antioxidant response element,ARE),引起内源性抗氧化和细胞保护性蛋白上调[1]。Nrf2-Keap1-ARE系统是对抗氧化应激的主要细胞防御通路,调控包括编码抗氧化酶、Ⅱ相解毒酶和III相药物转运体的基因,如过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、葡萄糖醛酸转移酶、NAD(P)H:醌氧化还原酶[NAD(P)H:quinone oxidoreductase 1,NQO1]、血红素氧合酶-1(hemeoxygenase-1,HO-1)、谷氨酸半胱氨酸连接酶(glutamate-cysteine ligase,GCL)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)、谷酰胺半胱氨酸连接酶催化亚单位(glutamate-cysteine ligase catalytic subunit,GCLC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、硫氧还蛋白和多药耐药相关蛋白(multidrug resistance-associate proteins,MRPs)等,对加速自由基的清除和抑制肾脏疾病的发展具有重要作用。
2 Nrf2与炎症
Nrf2活化能明显抑制核转录因子-κB(nuclear factor-kappa B,NF-κB),在炎症反应中发挥保护作用。NF-κB是氧化还原敏感的转录因子,调控促炎细胞因子、趋化因子和细胞粘附分子等的表达。有活性的NF-κB是一个由p65和p50两个亚基组成的二聚体,静息状态下,NF-κB与抑制性蛋白(inhibitor kappa B,IκB)结合组成三聚体p50-p65-IκB,受到炎症因子、生长因子、免疫受体、神经毒素、细菌和病毒等应激刺激时,IκB蛋白丝氨酸残基迅速被IκB激酶磷酸化,导致NF-κB释放并转运入核,与相应基因的调控区发生特异性结合,促进炎症因子等基因的表达。研究发现,与野生型小鼠相比,Nrf2敲除模型小鼠肾组织,NF-κB活化增加、炎症因子和白细胞粘附分子表达增加[2]。NF-κB结合位点位于Nrf2基因的启动子区域,激活Nrf2抗氧化通路能通过减少IκB磷酸化,减少应激敏感的NF-κB的表达,继而减轻炎症反应[3]。同时,Nrf2与NF-κB通路相互制约。NF-κB的p65亚基能干扰胞质内Nrf2与抑制性分子Keap1的解离,影响Nrf2与细胞核内抗氧化反应元件结合,从而在转录水平抑制Nrf2信号[4]。
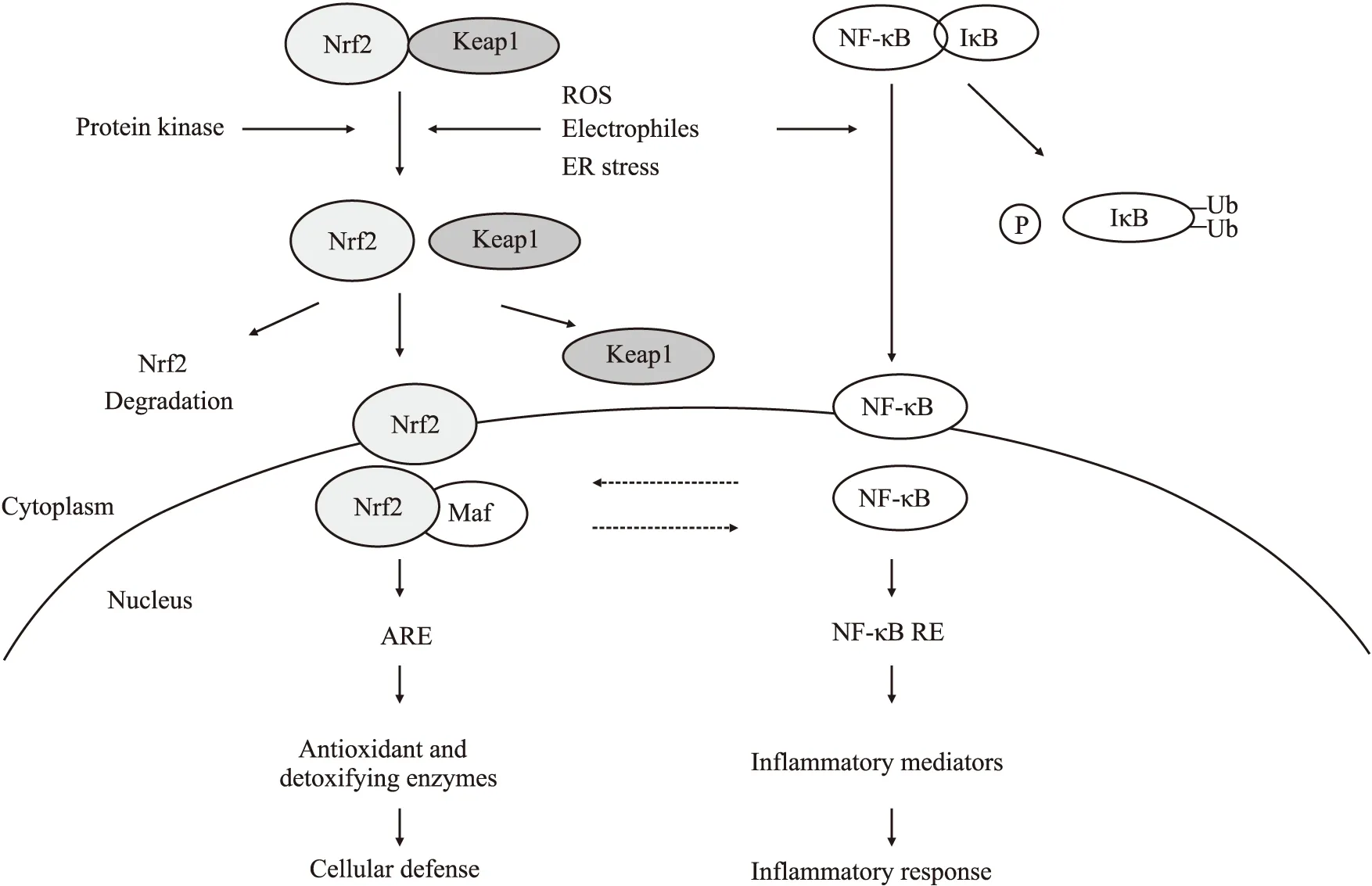
Fig 1 Schematic diagram of Nrf2 and NF-κB activation[5]
3 天然Nrf2诱导剂
大量体内外实验模型都证实Nrf2诱导剂具有拮抗氧化应激和炎症的作用,尤其是天然Nrf2诱导剂,受到广泛关注,包括吲哚类、二萜类、香豆素和内酯类。食物来源的Nrf2诱导剂主要为含硫化合物和酚类抗氧化剂。十字花科植物富含的莱菔硫烷和异硫氰酸苯乙酯为含硫的Nrf2诱导剂,通过修饰Keap1特异性半胱氨酸,使Nrf2与Keap1解离,Nrf2活化。白藜芦醇、姜黄素、肉桂醛和槲皮素属酚类抗氧化物,具有亲电子的α,β-不饱和羰基,与Keap1的半胱氨酸残基具有高反应性,使Keap1发生构象变化。此外,近年来,以齐墩果酸为基础进行结构修饰后形成的一系列衍生物(CDDO-Me、CDDO-Im和RAT dh404)被证实能激活Nrf2抗氧化通路,抑制炎症反应通路中的NF-κB,发挥抗氧化、抗炎和抗肿瘤等多种生理活性,引起国内外学者的广泛关注。
4 Nrf2在肾脏疾病中的作用
Nrf2诱导剂对抑制肾脏疾病的发生发展具有重要作用,Nrf2活化能上调肾组织抗氧化蛋白如硫氧还蛋白、HO-1和GCL的表达,从而清除过量ROS。此外,在清除外源性物质产生的亲电子基、环氧化合物和醌类代谢物时,Ⅱ相解毒酶与膜转运体如MRPs发挥协同作用,加速代谢产物的清除。同时,Nrf2能通过调控NF-κB,抑制肾组织炎症介质,如细胞因子、趋化因子、粘附分子、基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)、环氧合酶-2(cyclooxygenase-2,COX-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,从而发挥肾脏保护作用。
4.1 肾缺血/再灌注 肾缺血/再灌注是急性肾衰竭的主要诱因。研究发现,大鼠肾缺血/再灌注期间,血清肌酐和尿素氮浓度升高,肾组织发生明显损伤,NF-κB活性增加,iNOS、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和IL-8水平升高,血清SOD活性降低,脂质过氧化物丙二醛(malonaldehyde,MDA)含量升高,抗氧化基因Nrf2、HO-1和γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase,γ-GCS)的mRNA表达降低。对缺血/再灌注肾组织进行基因芯片研究发现,乙醛脱氢酶、NQO1和GST等抗氧化基因表达上调,同时,核因子Nrf2明显上调[6]。进一步研究发现,与野生型小鼠相比,Nrf2敲除小鼠结扎肾动脉后再灌注,其肾功能、组织学、血管通透性、存活率都较差,促炎细胞因子和趋化因子的表达上调,提示Nrf2缺失会加重小鼠肾缺血/再灌注损伤[7]。Liu等[8]研究表明,野生型小鼠肾缺血/再灌注损伤后补充Nrf2诱导剂CDDO-Im,肾小管缺失减少,促炎因子和趋化因子生成减少,Nrf2靶向抗氧化基因(GCLC、NQO1和HO-1)上调,但补充CDDO-Im对Nrf2敲除小鼠肾缺血/再灌注损伤后的生存率、肾功能、组织学、促炎细胞因子和抗氧化基因的表达无明显改善作用,提示CDDO-Im通过活化Nrf2信号通路发挥保护作用。此外,金樱子果总黄酮和齐墩果酸也能通过激活Nrf2抗氧化通路,发挥抗氧化和抗炎作用,防治肾缺血/再灌注损伤[9-10]。
4.2 急性肾毒性 顺铂广泛用于治疗各种实体瘤,但严重的肾毒性限制了其临床应用,尽管临床上采取水化利尿等防护措施,肾毒性发生率仍高达20%~30%[11]。体内外研究表明,氧化应激参与顺铂肾毒性形成[12]。顺铂进入细胞或机体后,超氧化物歧化酶阴离子、过氧化氢、羟基自由基和脂质过氧化物等过量产生,同时抗氧化酶活性受抑制,引起肾组织氧化性损伤。大量信号通路,尤其是Nrf2信号通路活化能降低自由基和亲电子基蓄积。研究发现,与野生型小鼠相比,Nrf2敲除小鼠顺铂给药后肾损伤加重,中性粒细胞浸润增加,同时p65 NF-κB结合增加,炎症介质mRNA水平升高。野生型小鼠而非Nrf2敲除小鼠的细胞保护性基因(NQO1、HO-1、GCLC)和外排转运体(MRP2、MRP4)的mRNA和蛋白表达升高。进一步研究发现,Nrf2诱导剂CDDO-Im能剂量依赖性降低野生型小鼠腹腔注射顺铂引起的肌酐和尿素氮升高,缓解肾组织近曲小管变性和坏死,但Nrf2敲除小鼠补充CDDO-Im后,肾损伤未明显减轻,表明CDDO-Im通过Nrf2发挥肾保护作用[13]。有研究发现[14-15],五味子乙素能抑制顺铂诱导的HK-2细胞内ROS水平升高,诱导Nrf2核转位,增加其下游靶基因NQO1、GCLC和HO-1的mRNA表达,从而减轻顺铂所致肾细胞的氧化应激损伤。此外,褪黑素和香菇多糖等也能降低顺铂所致血清肌酐、尿素氮和近曲小管细胞损伤,其作用机制与增加Nrf2核转运及其下游基因的表达,同时降低NF-κB及炎症因子的表达有关[16-17]。
4.3 慢性肾脏疾病 慢性肾脏疾病(chronic renal disease,CKD)的特征为渐进性肾功能下降,氧化应激和炎症是导致CKD病理损伤的重要因素。CKD患者血浆MDA和氧化型低密度脂蛋白含量明显升高,抗氧化基因SOD、CAT和谷胱甘肽(glutathione,GSH)活性降低,外周血单核细胞NF-κB上调,同时Nrf2和NQO1表达下调[18]。大量实验证据表明Nrf2活化对CKD具有保护作用。有学者发现,5/6肾切除CKD模型大鼠残余肾组织NF-κB活化增加,NAD(P)H氧化酶上调,出现肾小球硬化、间质纤维化和炎症,Nrf2及其靶基因的表达明显下降。补充低剂量RAT dh404能增加Nrf2及其靶基因的表达,抑制NF-κB活化和纤维化通路,减少肾小球硬化、间质纤维化和炎症[19-20]。有研究证实,霉酚酸酯和姜黄素能减少5/6肾切除CKD大鼠引起的肾功能改变,恢复肾组织抗氧化能力,减少肾脏炎性细胞浸润,上调Nrf2-Keap1-ARE通路[21]。Jimenez-Osorio等[22]和Saldanha等[23]发现,CKD患者补充Nrf2激动剂姜黄素(320 mg·d-1)8周或补充白藜芦醇(500 mg·d-1)4周,患者耐受性好,无不良反应发生,但统计学分析表明,补充姜黄素或白藜芦醇对外周血单核细胞中的Nrf2和NF-κB的表达无明显影响,可能是因为姜黄素或白藜芦醇的剂量和给药时间仍不足以使机体炎症和氧化应激状态缓解。
4.4 糖尿病肾病 糖尿病肾病是终末期肾衰竭的主要原因。高血糖引起蛋白质、脂类发生改变,增加细胞内氧化应激,激活NADPH氧化酶,导致ROS过量产生,损伤细胞结构,ROS还可使细胞内NF-κB活化,诱导多种炎症因子如单核细胞趋化因子-1(monocyte chemoattractant protein 1,MCP-1)、TNF-α和IL-1等表达,进一步加重组织损伤。Nrf2对减轻糖尿病肾病至关重要。糖尿病肾病患者肾小球处于氧化应激状态,Nrf2及其介导的抗氧化和抗炎反应通路上调。在链霉素诱导的糖尿病小鼠模型中,Nrf2敲除小鼠肾组织产生的ROS较野生型小鼠更多,氧化型DNA损伤和肾损伤更广泛[24]。给予Nrf2诱导剂莱菔硫烷或肉桂醛能明显改善野生型小鼠而非Nrf2敲除小鼠的肾功能,减轻常见的代谢异常症状和肾小管病理学改变,减少氧化损伤,表明莱菔硫烷或肉桂醛通过特异性激活Nrf2通路减轻小鼠糖尿病肾病[25]。据报道,强效Nrf2诱导剂叔丁基对苯二酚(tert-butylhydroquinone,tBHQ)能减轻糖尿病小鼠肾脏及高糖诱导的肾小球系膜细胞氧化应激损伤,其作用机制与激活Nrf2信号通路有关[26-27]。此外,木犀草素和霉酚酸酯能介导Nrf2活化,通过抗氧化和抗炎效应,改善糖尿病引起的代谢异常和肾损伤[28-29]。值得关注的是,CDDO-Me成为首个进入临床研究的治疗肾脏疾病的Nrf2诱导剂。在Ⅱ期随机安慰剂对照临床试验中,补充CDDO-Me的2型糖尿病肾病患者,肾小球滤过率明显增加。但在Ⅲ期大规模临床试验时,由于心衰发生率增加而被停止。
5 展望
尽管第一个基于Nrf2诱导剂的治疗糖尿病肾病的Ⅲ期临床试验因不良反应暂时被停止,但鉴于Nrf2活化在神经系统、心血管系统、肝脏和肾脏保护中的重要地位,Nrf2仍有希望成为多种疾病的治疗靶标,对天然和合成Nrf2诱导剂的研究呈复苏趋势。其中,植物来源的具有抗氧化抗炎作用的Nrf2诱导剂如白藜芦醇和姜黄素已使用多年,人体安全性好,可能是潜在的减轻各种肾脏疾病的有效药物,受到广泛关注。鉴于氧化应激和炎症参与多种肾脏疾病的发生发展,深入研究Nrf2调控的抗氧化与抗炎通路与肾脏疾病的关系,将为临床治疗肾脏疾病提供新思路和治疗策略。
[1] 曹玲娟, 龚 慧, 颜 苗,等. Nrf2-ARE信号通路参与肝脏疾病病理机制研究进展[J]. 中国药理学通报, 2015, 31(8): 1057-61.
[1] Cao L J, Gong H, Yan M, et al. Research progress on Nrf2-ARE signaling pathway involved in liver disease pathological mechanism[J].ChinPharmacolBull, 2015, 31(8): 1057-61.
[2] Jin W, Wang H, Yan W, et al. Disruption of Nrf2 enhances upregulation of nuclear factor-kappaB activity, proinflammatory cytokines, and intercellular adhesion molecule-1 in the brain after traumatic brain injury[J].MediatorsInflamm, 2008, 2008: 725174.
[3] Chen X L. Activation of Nrf2/ARE pathway protects endothelial cells from oxidant injury and inhibits inflammatory gene expression[J].AmJPhysiolHeartCircPhysiol, 2006, 290(5): H1862-70.
[4] Pedruzzi L M, Stockler-Pinto M B, Leite M, et al. Nrf2-keap1 system versus NF-κB: The good and the evil in chronic kidney disease[J]?Biochimie, 2012, 94(12): 2461-6.
[5] Kim H J, Vaziri N D. Contribution of impaired Nrf2-keap1 pathway to oxidative stress and inflammation in chronic renal failure [J].AmJPhysiolRenalPhysiol, 2010, 298(3): F662-71.
[6] Leonard M O, Kieran N E, Howell K, et al. Reoxygenation-specific activation of the antioxidant transcription factor Nrf2 mediates cytoprotective gene expression in ischemia-reperfusion injury[J].FASEBJ, 2006, 20(14): 2624-6.
[7] Liu M, Grigoryev D N, Crow M T, et al. Transcription factor Nrf2 is protective during ischemic and nephrotoxic acute kidney injury in mice[J].KidneyInt, 2009, 76(3): 277-85.
[8] Liu M, Reddy N M, Higbee E M, et al. The Nrf2 triterpenoid activator, CDDO-imidazolide, protects kidneys from ischemia-reperfusion injury in mice[J].KidneyInt, 2014, 85(1): 134-41.
[9] Zhao L, Xu L, Tao X, et al. Protective effect of the total flavonoids from rosa iaevigata michx fruit on renal ischemia-reperfusion injury through suppression of oxidative stress and inflammation[J].Molecules, 2016, 21(7):pii.E952
[10] Long C, Yang J, Yang H, et al. Attenuation of renal ischemia/reperfusion injury by oleanolic acid preconditioning via its antioxidant, antiinflammatory, and antiapoptotic activities[J].MolMedRep, 2016, 13(6): 4697-704.
[11] Miller R P, Tadagavadi R K, Ramesh G, et al. Mechanisms of cisplatin nephrotoxicity[J].Toxins, 2010, 2(11): 2490-518.
[12] Chirino Y I, Pedraza-Chaverri J. Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity[J].ExpToxicolPathol, 2009, 61(3): 223-42.
[13] Aleksunes L M, Goedken M J, Rockwell C E, et al. Transcriptional regulation of renal cytoprotective genes by Nrf2 and its potential use as a therapeutic target to mitigate cisplatin-induced nephrotoxicity[J].JPharmacolExpTher, 2010, 335(1): 2-12.
[14] 王嫣虹, 徐 翔. 五味子乙素抗顺铂所致HK-2凋亡及其机制的研究[J]. 中国药理学通报, 2014, 30(7): 961-4.
[14] Wang Y H, Xu X. Protective effect of schisandrin B against HK-2 apoptosis induced by cisplatin [J].ChinPharmacolBull, 2014, 30(7): 961-4.
[15] 李 梅, 金 晶, 李 佳, 等. 五味子乙素激活Nrf2/ARE通路对顺铂致HK-2细胞氧化应激损伤的保护作用[J]. 药学学报, 2012, 47(11): 1434-9.
[15] Li M, Jin J, Li J, et al. Schisandrin B protects against nephrotoxicity induced by cisplatin inHK-2 cells via Nrf2-ARE activation [J].ActaPharmSin, 2012, 47(11): 1434-9.
[16] Kilic U, Kilic E, Tuzcu Z, et al. Melatonin suppresses cisplatin-induced nephrotoxicity via activation of Nrf-2/HO-1 pathway[J].NutrMetab, 2013, 10(1):7.
[17] Chen Q, Peng H, Dong L, et al. Activation of the NRF2-ARE signalling pathway by the Lentinula edodes polysaccharose LNT alleviates ROS-mediated cisplatin nephrotoxicity[J].IntImmunopharmacol, 2016, 36: 1-8.
[18] Pedruzzi L M, Cardozo L F, Daleprane J B, et al. Systemic inflammation and oxidative stress in hemodialysis patients are associated with down-regulation of Nrf2[J].JNephrol, 2015, 28(4): 495-501.
[19] Aminzadeh M A, Reisman S A, Vaziri N D, et al. The synthetic triterpenoid RTA dh404 (CDDO-dhTFEA) restores Nrf2 activity and attenuates oxidative stress, inflammation, and fibrosis in rats with chronic kidney disease[J].Xenobiotica, 2014, 44(6): 570-8.
[20] Vaziri N D, Liu S, Farzaneh S H, et al. Dose-dependent deleterious and salutary actions of the Nrf2 inducer dh404 in chronic kidney disease[J].FreeRadicBiolMed, 2015, 86:374-81.
[21] Tapia E, Garcia-Arroyo F, Silverio O, et al. Mycophenolate mofetil and curcumin provide comparable therapeutic benefit in experimental chronic kidney disease: role of Nrf2-Keap1 and renal dopamine pathways[J].FreeRadicRes, 2016, 50(7): 781-92.
[22] Jiménez-Osorio A S, García-Nino W R, González-Reyes S, et al. The effect of dietary supplementation with curcumin on redox status and Nrf2 activation in patients with nondiabetic or diabetic proteinuric chronic kidney disease: A pilot study[J].JRenNutr, 2016, 26(4): 237-44.
[23] Saldanha J F, Leal V O, Rizzetto F, et al. Effects of resveratrol supplementation in Nrf2 and NF-kappaB expressions in nondialyzed chronic kidney disease patients: A randomized, double-blind, placebo-controlled, crossover clinical trial[J].JRenNutr, 2016, 26(6): 401-406
[24] Jiang T, Huang Z, Lin Y, et al. The protective role of Nrf2 in streptozotocin-induced diabetic nephropathy[J].Diabetes, 2010, 59(4): 850-60.
[25] Zheng H, Whitman S A, Wu W, et al. Therapeutic potential of Nrf2 activators in streptozotocin-induced diabetic nephropathy[J].Diabetes, 2011, 60(11): 3055-66.
[26] 李 航, 曹延萍, 张连珊, 等. 叔丁基对苯二酚减轻高糖诱导的肾小球系膜细胞氧化应激损伤[J]. 中国药理学通报, 2011, 27(4): 528-33.
[26] Li H, Cao Y P, Zhang L S, et al. tBHQ attenuates high glucose induced oxidative stress injury in mouse mesangial cells [J].ChinPharmacolBull, 2011, 27(4): 528-33.
[27] 李 航, 任韫卓, 刘淑霞, 等. 叔丁基对苯二酚对糖尿病小鼠肾脏氧化应激损伤及Nrf2蛋白表达的影响[J]. 中国药理学通报, 2009, 25(10): 1341-5.
[27] Li H, Ren Y Z, Liu S X, et al. Effects of tBHQ on the oxidative stress and the expressionof Nrf2 in kidneys of diabetic mice [J].ChinPharmacolBull, 2009, 25(10): 1341-5.
[28] Yang Y, Chen G, Cheng X, et al. Therapeutic potential of digitoflavone on diabetic nephropathy: nuclear factor erythroid 2-related factor 2-dependent anti-oxidant and anti-inflammatory effect[J].SciRep, 2015, 5: 12377.
[29] Arellano-Buendía A S, Tostado-González M, García-Arroyo F E, et al. Anti-inflammatory therapy modulates Nrf2-Keap1 in kidney from rats with diabetes[J].OxidMedCellLongev, 2016, 2016:4693801.
Research on preventative role of Nrf2 in kidney diseases
CAO Si-si1, 2, 3, YAN Miao2, 3, ZHANG Bi-kui2, 3,JIANG Yun-sheng4,FAN Xin-rong5
(1.SchoolofPharmaceuticalScience; 2.DeptofPharmacy,theSecondXiangyaHospital; 3.InstituteofClinicalPharmacy, 4.DeptofNephrology,theSecondXiangyaHospital,CentralSouthUniversity,Changsha410011,China;5.ChinaAcademyofChineseMedicalScience,Beijing100700)
Nrf2, a key transcriptional factor in regulating endogenous antioxidant signaling pathway, maintains the redox bal-ance by controlling the expression of a battery of antioxidant enzymes, phase-Ⅱ detoxification enzymes and phase-Ⅲ transporters. Furthermore, Nrf2 regulates inflammation. Recent researches have confirmed that Nrf2 provides a vital physiological role in kidney diseases, activation of Nrf2 enhances the antioxidant and anti-inflammatory ability in cellular and tissue levels, thus alleviates renal injury. Here, this article aims to summarize the protective effect of Nrf2 on various models of kidney impairment and explore the potential of Nrf2 as a therapeutic target to prevent kidney diseases.
Nrf2; oxidative stress; NF-κB; renal ischemia-reperfusion injury; acute kidney injury; chronic kidney disease
时间:2017-3-4 11:49
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1149.004.html
2016-10-21,
2016-12-02
国家自然科学基金资助项目(No 81202985,81573686,81373708)
曹思思(1990-),女,硕士,研究方向:临床药学,E-mail:1169233155cs@sina.com; 张毕奎(1968-),男,博士,教授,硕士生导师,研究方向:体内药物分析及临床药理学,通讯作者,E-mail:zhbk68@163.com
10.3969/j.issn.1001-1978.2017.03.002
A
1001-1978(2017)03-0301-05
R-05;R322.61;R349.1;R364.5;R394;R587.2;R692
