抗肾纤维化药物高内涵筛选模型的建立及应用
2017-03-17孙雪娇王曦廷吴清华张宇欣栗世铀李亚东
孙雪娇,刘 祎,李 城,王曦廷,吴清华,张宇欣,栗世铀,李亚东,李 彧
(北京中医药大学 1.基础医学院,2.中药学院,北京 100029;3.中国科学院北京基因组研究所,北京 100101)
抗肾纤维化药物高内涵筛选模型的建立及应用
孙雪娇1,刘 祎1,李 城1,王曦廷1,吴清华3,张宇欣2,栗世铀3,李亚东1,李 彧1
(北京中医药大学 1.基础医学院,2.中药学院,北京 100029;3.中国科学院北京基因组研究所,北京 100101)
目的 建立可用于高内涵分析的肾纤维化体外的细胞模型,为抗肾纤维化中药化合物的筛选和机制研究奠定基础。方法 本研究通过TGF-β1诱导正常大鼠肾成纤维细胞NRK49F,以肌成纤维细胞标志α-平滑肌肌动蛋白(α-SMA)作为检测指标,通过高内涵成像分析系统对α-SMA荧光表达强度进行检测分析,并对细胞种板密度、诱导时间、诱导培养基中血清浓度等各种条件进行优化,建立稳定的肾纤维化体外模型。在此基础上以TGF-β1受体阻滞剂SB525334和姜黄素、大黄素对模型进行验证。并进一步探讨吡非尼酮是否具有抗肾纤维化功效。结果 实验通过对细胞密度、诱导时间、培养基中血清浓度进行优化,确立了可用于高内涵分析的NRK49F肾纤维化体外模型的建立条件。SB525334、姜黄素、大黄素和吡非尼酮均能减少TGF-β1诱导的α-SMA过表达,抑制NRK49F的活化。结论 实验建立了可用于高内涵筛选技术的肾纤维化体外模型,并能相对稳定地筛选具有抗肾纤维化作用的药物。吡非尼酮在本模型中抑制了成纤维化细胞向肌成纤维细胞转化,提示其可能具有抗肾纤维化作用,为抗肾纤维化药物初筛对象的选择提供了思路。
肾纤维化;细胞模型;高内涵分析技术;NRK49F;α-SMA;中药化合物
肾纤维化是各种原因引起的慢性肾脏病(chronic kidney disease,CKD)进展至终末期肾病(end stage renal disease,ESRD)的共同病理特征,包括肾间质纤维化、肾小球硬化,以大量的细胞外基质积聚、肾脏正常的生理结构和功能破坏为特征,现代医学尚未发现行之有效的治疗方法,仅能依靠透析或者肾移植维持生命,给患者及其家属带来极大的痛苦[1]。同时,近年来CKD的发病率逐年升高[2-3]。因此,进行有关抗肾纤维化药物的研发,对于临床肾纤维化的预防及治疗具有重大意义。
研究证明很多中药化合物显示出了抗肾纤维化的作用[4-5]。但是中药或天然药物成分复杂、种类繁多,需要建立高效快速的的筛选模型,同时基于动物保护的原则,为了减少大量动物实验,也需要建立体外肾纤维化细胞模型。高内涵分析(high-content analysis,HCA)是一种以细胞为检测对象,通过显微成像法对细胞内待测的指标信号进行采集并通过分析图像中的信息来解析细胞内物质活动的技术[6]。HCA技术可在保持细胞结构和功能完整的条件下,在单一实验中可以获得大量细胞信息以及候选药物药理学活性及潜在的作用机制等方面的相关信息[7]。在现代药物研发中,无论是药物的初级筛选、靶点的发现与明确、候选药物的优化,还是在药物临床前毒性和安全性的研究都具有明显的优势[8-10]。与普通肾纤维化细胞模型以及传统的成像分析方式相比,抗肾纤维化中药化合物高内涵筛选模型的建立适用于复杂中药组分的高效率筛选及相关作用机制的研究。
本实验以TGF-β1诱导正常大鼠肾成纤维细胞NRK49F,通过对诱导培养条件的优化,建立了稳定的可用于高内涵分析技术的肾纤维化体外模型,并应用有效药物对模型进行初步验证。
1 材料与方法
1.1 细胞培养 正常大鼠成纤维细胞(NRK49F)购自中国医学科学院基础医学研究所基础医学细胞中心,培养在含有体积分数为5%胎牛血清(FBS)、100 kU·L-1青霉素( penicillin)和1×105g·L-1链霉素(streptomycin)的DMEM培养液中,培养条件为37 ℃、5% CO2,当细胞融合至80%左右时用0.25%胰蛋白酶进行消化并传代,切勿长满。
1.2 药物与试剂 人类重组转化生长因子-β1(Recombinant human TGF-β1,R&D,货号 240B-002),TGF-β1受体阻滞剂SB525334(selleck,货号S1476),鼠源α-SMA抗体(anti alpha smooth muscle actin antibody produced in mouse,Sigma,货号A5228-200UL),荧光标记的羊抗鼠IgG(anti-mouse IgG(whole molecule) FITC antibody produced in goat,Thermo,货号35502),染核试剂Hoechst 33342(20 g·L-1,Sigma,货号B2261),4%多聚甲醛溶液(PFA),5% BSA的PBS溶液,PBS缓冲液,DMEM(Gibco,货号11995065)。TritonX -100(Sigma,货号T8787-100 mL)。吡非尼酮(TCI,货号P1871),姜黄素(源叶生物,b20614-20mg)、大黄素(源叶生物,b20240-20mg)溶于DMSO中。96孔板(Grenier,货号655090)。
1.3 仪器设备 高内涵成像及分析设备(Molecule Device,型号ImageXpess XLS),CO2培养箱(Thermo Fisher scientific,型号3111),超净工作台(上海智城分析仪器制造有限公司,型号ZHJH-C1115B)。
2 方法
2.1 NRK49F肾纤维化高内涵分析体外模型的建立 按上述细胞培养方法进行NRK49F细胞的培养,待细胞融合至80%左右,用胰蛋白酶将细胞消化下来后并接种于96孔板,种板密度分别为:每孔6 000个、8 000个、10 000个、12 000个、15 000个、20 000个、25 000个。分别设置为空白对照组和模型组,24 h后换成无血清培养基DMEM,饥饿24 h后,空白对照组换成含有不同浓度FBS的DMEM培养基,模型组的培养液为相应空白对照组的培养液中加入TGF-β1并使其终浓度为10 μg·L-1,孵育条件:5% CO2,37℃。诱导时间分别为:24、48、72 h。

Fig 1 Effect of serum concentration on expression of α-SMA in NRK49F cells
A:Fluorescence images of α-SMA in NRK49F cells (Blue indicating cell nucleus,green indicating α-SMA); B:Expression of α-SMA induced by TGF-β1 with or without serum;C:Effect of different serum concentrations on expression of α-SMA induced by TGF-β1 (cell density:6000 cells/well). TGF-β1 induced groupvscorresponding normal control group,*P<0.05,**P<0.01.
诱导结束后,用预热至37℃的4% PFA将细胞固定20 min,PBS洗3遍,0.1% Triton X -100进行透化30 min,5% BSA封闭并保存于4℃过夜。然后分别孵育α-SMA的一抗(1 ∶500)1 h、羊抗鼠二抗(1 ∶1 000)1.5 h、Hoechst33342(1 ∶1 000)15 min。利用高内涵成像设备曝光照相,获取α-SMA的相关数据并进行对比分析,将空白对照组与模型组之间差异最大的作为模型建立的最佳条件,并在待定的模型建立条件下重复3次,若结果能够保持稳定则确定为模型建立的条件。
2.2 NRK49F体外肾纤维化模型的验证 按照以上实验确定的模型诱导条件进行细胞培养,并设置空白对照组、模型组、药物干预组,药物干预组在加入TGF-β1的同时按不同浓度加入姜黄素(30、10、3.3、1.1 μmol·L-1)和大黄素(36,12,4,1.3 μmol·L-1),待诱导时间结束,重复上述方法进行α-SMA的检测与分析,对模型进行验证。
2.3 吡非尼酮抗肾纤维化作用的初步探讨 在实验确定的模型诱导条件下,以治疗肺纤维化临床有效药物吡非尼酮(1.1、0.37、0.12、0.04 mmol·L-1)作为待测药物,按照上述实验方法分析检测NRK49F细胞α-SMA的表达情况,进行初步的药效评定,探讨吡非尼酮是否具有抗肾纤维化作用。
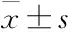
3 结果
NRK49F肾纤维化体外模型建立条件的优化。
3.1 培养基中血清浓度的优化 根据图像以及数据统计分析的结果(Fig 1),我们发现:在不同浓度血清的条件下,TGF-β1诱导后NRK49F细胞中α-SMA的表达量增高且细胞形态发生了明显的改变,细胞的体积明显变大,并由短梭形转化长梭形,具备肌成纤维细胞的特征。
当TGF-β1(10 μg·L-1)诱导时间为48 h,在每孔15 000个、20 000个、25 000个的细胞种板密度条件下(Fig 1),有血清的实验组(Fig 1B)中模型组较空白对照组α-SMA的表达量有明显差异,而无血清组中模型组与空白对照组α-SMA的表达量无差异,表明NRK49F细胞转化为肌成纤维细胞并高表达α-SMA需要血清。且随着血清浓度的增加,α-SMA的表达量明显增加(见Fig 1C),呈现FBS剂量依赖性。

Fig 2 Effect of different induction time onexpression of α -SMA induced by TGF- β1
TGF-β1 induced groupvsthe corresponding normal control group,*P<0.05,**P<0.01.

Fig 3 Effect of different cell density on expression of α-SMA induced by TGF-β1
TGF-β1 induced groupvsthe corresponding normal control group,*P<0.05,**P<0.01. 6,8,10,12,15 k in the chart stand for 6 000 cells/well, 8 000 cells/well,10 000 cells/well, 12 000 cells/well, 15 000 cells/well.
3.2 诱导时间的优化 为了对诱导时间进行优化,我们首先设置了种板密度为每孔6 000个、8 000个、10 000个,12 000个、15 000个、20 000个、25 000个,分别诱导24、48 h的实验组,通过对α-SMA表达量的分析,当诱导时间为24 h时,模型组与空白对照组的α-SMA的表达量几乎没有明显差异,TGF-β1的诱导作用尚未显现。当诱导时间为48 h、种板密度为15 000个/孔时,空白对照组与模型组的差异最大。随后又增加了不同细胞种板密度下诱导时间为72 h的实验组,通过对诱导时间分别为24、48、72 h不同组别的之间的分析比较,我们发现当诱导时间为72 h时,种板细胞密度为6 000个/孔实验条件下的空白对照组与模型组α-SMA表达强度差异较大,见Fig 2。
3.3 细胞种板密度的优化 NRK49F细胞种板密度不同,空白对照组与TGF-β1诱导的模型组α-SMA表达差异不同,当种板细胞密度为6 000个/孔到15 000个/孔时(Fig 3),随着种板密度的增加,这种差异逐渐减小,当种板细胞密度为6 000个/孔时α-SMA表达差异相对最大。
由此,我们确定了肾纤维化体外高内涵分析模型的最佳条件,即细胞种板密度为6 000个/孔、TGF-β1(10 μg·L-1)溶于含有血清的DMEM中所构成的诱导培养液、诱导时间为72 h。
3.4 NRK49F体外肾纤维化模型的验证 在通过上述实验确立的优化条件的基础上,我们运用TGF-β1受体阻滞剂SB525334,文献中报道的具有抗肾纤维化功效的姜黄素、大黄素对模型进行了初步的验证,结果如下:
根据图像及数据分析结果(Fig 4~6),TGF-β1受体阻滞剂SB525334、姜黄素、大黄素均能抑制TGF-β1诱导的α-SMA过表达(姜黄素P<0.05,SB525334和大黄素P<0.01),同时能够抑制NRK49F细胞的增殖(P<0.01)。表明文献中报道的具有抗肾纤维化的化合物能够在本模型中显示出抑制TGF-β1诱导的成纤维细胞激活的作用。

Fig 4 Effect of TGF-β1 receptor blocker SB525334 on expression of α-SMA
Fluorescence image(A),ratio of cyto α-SMA fluorescence intensity(B) and changes of NRK49F cell number(C).*P<0.05,**P<0.01vsTGF-β1 induced model group.

Fig 5 Effect of curcumin on expression of α-SMA
Ratio of cyto α-SMA fluorescence intensity(A) and changes of NRK49F cell number(B).*P<0.05,**P<0.01vsTGF-β1 induced model group.
3.5 吡非尼酮抗肾纤维化作用的初步探讨 吡非尼酮是用于肺纤维化治疗的临床用药。在本实验模型中,吡非尼酮拮抗TGF-β1诱导的α-SMA的过表达(P<0.05),同时也显示出抑制TGF-β1诱导的成纤维细胞增殖的功效(P<0.01),提示其可能具有抗肾纤维化的作用。此前吡非尼酮在抗肾纤维化方面研究相关的文献报道甚少。
4 讨论
在肾纤维化的发生发展过程中,肌成纤维细胞(myofibroblasts)被认为是细胞外基质(extra cellular matrix,ECM)的主要来源,而表达α-平滑肌肌动蛋白(α-SMA)常作为肌成纤维细胞的标志[11]。肌成纤维细胞主要来源于组织局部存在的成纤维细胞、骨髓来源的成纤维细胞、肾小管上皮细胞、内皮细胞和足细胞,其中50%源自局部间质成纤维细胞的增殖、35%源自骨髓来源的成纤维细胞的转化、10%内皮细胞间充质转化(endothelial-to-mesenchymal transition,EnMT)以及5%上皮细胞间充质转化(epithelial-to-mesenchymal transition,EMT)[12-13]。为什么上述细胞会转化成表达α-SMA、能够产生大量ECM的肌成纤维细胞?其中一个关键的因素是由于细胞因子TGF-β1的刺激。当器官受到损伤时,受损的细胞就会产生大量的TGF-β1,TGF-β1继而诱导周围的细胞发生转化、大量增殖,引起肌成纤维细胞的聚集,成为器官纤维化重要的病理机制[14-15]。中医药在肾纤维化相关疾病的治疗中具有良好的前景。然而中药化合物成分繁多、种类复杂,实现抗肾纤维化功效化合物的高效快速筛选需要建立相应的肾纤维化体外模型。本实验以TGF-β1诱导NRK49F细胞转化,用带有荧光的二抗对α-SMA进行标记,高内涵分析技术能够高灵敏地对相应荧光信息进行采集,荧光强度间接地反映出了α-SMA表达情况,并作为模型建立成功的检测指标。

Fig 6 Effect of emodin on expression of α-SMA
Ratio of cyto α-SMA fluorescence intensity(A) and changes of NRK49F cell number(B).**P<0.01vsTGF-β1 induced model group.

Fig 7 Effect of pirfenidone on expression of α-SMA
Ratio of cyto α-SMA fluorescence intensity(A) and changes of NRK49F cell number(B).*P<0.05,**P<0.01vsTGF-β1 induced model group.
由于血清中含有复杂的细胞因子,对于模型诱导中的细胞状态以及TGF-β1的诱导作用可能产生干扰,另一方面,TGF-β1能够诱导成纤维细胞的增殖,如果种板密度过高则TGF-β1的作用可能因细胞的接触性抑制生长而被掩盖,同时不利于细胞相关指标荧光信息的采集,由此我们对细胞种板密度以及诱导过程中培养液血清的含量进行了优化。发现在种板密度为6 000个/孔、TGF-β1(10 μg·L-1)溶于含有5% FBS的DMEM中所构成的诱导培养液、诱导时间为72 h时,模型组较空白对照组α-SMA表达差异最大,由此确立了肾纤维化高内涵体外模型的建立条件。
根据文献中报道,姜黄素能够抑制成纤维细胞的增殖、减少ECM聚集、抑制TGF-β1诱导的EMT,减少TGF-β1受体的表达等[16-19],大黄素能够抑制肾间质纤维化模型大鼠肾组织中基质金属蛋白酶组织抑制物-1(TIMP-1)表达、提高基质金属蛋白酶-9(MMP-9)表达,促进ECM的降解,缓解肾纤维化[20-21]。姜黄素、大黄素以及TGF-β1受体阻滞剂SB525334在本模型中均显示出了抑制NRK49F向肌成纤维细胞转化的功效,验证了模型的相对可靠性。为进一步利用高内涵技术筛选抗肾纤维化药物奠定了基础。
另外,不同器官纤维化虽然病位不同,但具有共同的特征:持续的刺激不能缓解,致使局部细胞损伤,炎性细胞浸润,各种细胞因子释放,尤其是TGF-β1,导致肌成纤维细胞的激活,产生大量的细胞外基质并不断沉积[22-23]。器官组织内细胞外基质的过度异常沉积,实质细胞减少,持续进展可致器官结构破坏和功能减退乃至衰竭。并且有相同的细胞、细胞因子及信号通路参与纤维化的发生发展,比如TGF-β/Smads通路以及细胞转分化(ETM)的发生等。由于不同器官纤维化具有相同的发病机制,由此推测用于某一器官纤维化有效的药物可能对其他器官的纤维化也有相同作用。本实验在成功建立肾纤维化模型的基础上,对临床上用于肺纤维化治疗的药物吡非尼酮进行了初步检测,结果表明吡非尼酮具有抑制NRK49F激活成为肌成纤维细胞的功效,说明其可能具有抗肾纤维化作用。这一发现为初步的抗肾纤维化药物高内涵筛选以及体内实验研究提供了线索。
总之, 我们建立的肾纤维化细胞模型具有肌成纤维细胞特征,可用于体外筛选抗肾纤维化的药物。
(致谢:特别感谢中国科学院北京基因组研究所精准基因组医学重点实验室栗世铀老师组对本课题研究的支持与帮助。)
[1] Pradere J P,Gonzalez J,Klein J,et al. Lysophosphatidic acid and renal fibrosis[J].BiochimBiophysActa,2008,1781(9): 582-7.
[2] Seck S M,Doupa D,Gueye L,et al. Epidemiology of chronic kidney disease in northern region of Senegal: a community-based study in 2012[J].PanAfrMedJ,2014,18:307.
[3] Xue L,Lou Y,Feng X,et al. Prevalence of chronic kidney disease and associated factors among the Chinese population in Taian, China[J].BMCNephrol,2014,15:205.
[4] Xia J,He L Q,Su X. Interventional mechanisms of herbs or herbal extracts on renal interstitial fibrosis[J].JIntegrMed,2016,14(3):165-73.
[5] Dey I,Shah K,Bradbury N A. Natural compounds as therapeutic agents in the treatment cystic fibrosis[J].JGenetSyndrGeneTher,2016,7(1):pii284.
[6] 王萌萌,何 玲,胡 梅,等. 高内涵筛选技术及其在药学研究中的应用[J]. 药学进展,2011,11: 481-6.
[6] Wang M M, He L, Hu M, et al. The development of high-content screening technique and its application in pharmaceutical research[J].ProgPharmacSci, 2011,11.481-6.
[7] 胡经阳,严春琳,朱 彦,等. 高内涵筛选应用于中药现代化的前景展望[J]. 天津中医药大学学报,2013,2:120-4.
[7] Hu J Y, Yan C L, Zhu Y, et al. The prospect of the application of high content screening in TCM modernization[J].JTianjinUniverTraditChinMed,2013,2:120-4.
[8] Fraietta I,Gasparri F. The development of high-content screening(HCS) technology and its importance to drug discovery[J].ExpertOpinDrugDiscov,2016,11(5): 501-14.
[9] Bickle M. The beautiful cell: high-content screening in drug discovery[J].AnalBioanalChem,2010,398(1): 219-26.
[10]Denner P,Schmalowsky J,Prechtl S. High-content analysis in preclinical drug discovery[J].CombChemHighThroughputScreen,2008,11(3): 216-30.
[11]Zhou D,Liu Y. Renal fibrosis in 2015: Understanding the mechanisms of kidney fibrosis[J].NatRevNephrol,2016,12(2): 68-70.
[12]Lebleu V S,Taduri G,O′connell J,et al. Origin and function of myofibroblasts in kidney fibrosis[J].NatMed,2013,19(8):1047-53.
[13]Falke L L,Gholizadeh S,Goldschmeding R,et al. Diverse origins of the myofibroblast-implications for kidney fibrosis[J].NatRevNephrol,2015,11(4): 233-44.
[14]Lan H Y.Diverse roles of TGF-beta/Smads in renal fibrosis and inflammation[J].IntJBiolSci,2011,7(7): 1056-67.
[15]Meng X M,Tang P M,Li J,et al. TGF-beta/Smad signaling in renal fibrosis[J].FrontPhysiol,2015,6:82.
[16]Zhou X,Zhang J,Xu C,et al. Curcumin ameliorates renal fibrosis by inhibiting local fibroblast proliferation and extracellular matrix deposition[J].JPharmacolSci,2014,126(4): 344-50.
[17]Li R,Wang Y,Liu Y,et al. Curcumin inhibits transforming growth factor-beta1-induced EMT via PPARgamma pathway, not Smad pathway in renal tubular epithelial cells[J].PLoSOne,2013,8(3): e58848.
[18]Gaedeke J,Noble N A,Border W A. Curcumin blocks multiple sites of the TGF-beta signaling cascade in renal cells[J].KidneyInt,2004,66(1): 112-20.
[19]富徐燕,赵丕文,李亚东,等.姜黄素对人循环纤维细胞增殖及COLⅠ表达影响的研究[J]. 中国药理学通报,2014,7:942-7.
[19]Fu X Y, Zhao P W, Li Y D, et al. Effects of curcumin on proliferation and COL I expression of human circulating fibrocytes[J].ChinPharmacolBull,2014,7:942-7.
[20]李冬梅,刘 巍. 大黄素对肾纤维化大鼠肾组织MMP-9表达的影响[J]. 中国中医药现代远程教育,2014,10:160-1.
[20]Li D M, Liu W. The effect of emodin on expression of matrix metalloproteinase-9 in rat with renal tubulointerstitial fibrosis[J].ChinMedModDistEdChina,2014,10:160-1.
[21]李冬梅,孙 禄,刘 巍,等. 大黄素对肾纤维化大鼠肾组织中基质金属蛋白酶组织抑制物-1表达的影响[J]. 齐齐哈尔医学院学报,2010,17:2689-91.
[21]Li D M, Sun L, Liu W,et al.The effect of emodin on expression of tissue inhibitor of metalloproteinase-1 in rat with renal tubulointerstitial fibrosis[J].JQiqiharMedColl,2010,17:2689-91.
[22]Wynn T A. Integrating mechanisms of pulmonary fibrosis[J].JExpMed,2011,208(7): 1339-50.
[23]Elpek G O.Cellular and molecular mechanisms in the pathogenesis of liver fibrosis:An update[J].WorldJGastroenterol,2014,20(23):7260-76.
Establishment and application of high content screening model for anti-renal fibrosisdrugs
SUN Xue-jiao1,LIU Yi1,LI Cheng1,WANG Xi-ting1,WU Qing-hua3,ZHANG Yu-xin2,LI Shi-you3,LI Ya-dong1,LI Yu1
(1.SchoolofBasicMedicalScience;2.SchoolofChineseMedicine,Beijing100029,China;3.BeijingInstituteofGenomics,ChineseAcademyofSciences,Beijing100101,China)
Aim To establish a cellular model of renal fibrosisinvitro, which can be used for the high-content analysis, and lay a good foundation for the screening and mechanism study of traditional Chinese medicine compounds with anti-fibrotic effect.Methods In this study, normal rat kidney fibroblasts(NRK49F) were induced by TGF-β1. As the maker ofmyofibroblast, alpha smooth muscle actin(α-SMA) was detected and analyzed by high content imaging analysis system, and the cell plate density, induction time, the concentration of serum in medium were optimized, to establish a stable model of renal fibrosisinvitro. Then the model was validated by TGF- β1 receptor blocker SB525334, curcumin and emodin. On this basis,whether pirfenidone had the effect of anti-renal fibrosis was explored. Results By optimizing the cell density, induction time and serum concentration in culture medium, the conditions of NRK49F renal fibrosis modelinvitrofor high content analysis were established. SB525334, curcumin and emodin and pirfenidone reduced the expression of α-SMA in NRK49F induced by TGF-β1. Conclusions Aninvitromodel of renal fibrosis, which can be used for high content screening technology, is established and can be used to screen drugs with anti-renal fibrosis effects relatively stably. Pirfenidone in this model inhibits the transformation of NRK49F into myofibroblasts, suggesting that it may be able to inhibit renal fibrosis, providing a way for the selection of objects for anti-renal fibrosis drug screening.
renal fibrosis;cell model;high-content analysis;NRK49F;α-SMA;Chinese traditional medicine compounds
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.016.html
2016-10-13,
2016-11-09
国家自然科学基金面上项目(No 81573716,No 81173642)
孙雪娇(1990-),女,硕士,研究方向:中西医结合基础肾病,E-mail:1099648128@qq.com; 李 彧(1974-),女,博士,副研究员,副教授,研究方向: 中医药防治器官纤维化,通讯作者,E-mail:liyubeijing1973@163.com
10.3969/j.issn.1001-1978.2017.03.008
A
1001-1978(2017)03-0327-08
R-332;R282.71;R363-332;R692.9;R965.1
