Triton WR-1399 通过影响VLDL-C代谢通路和RCT诱导急性HLP小鼠模型的研究
2017-03-17卓俊城曾晓会曾巧煌陈玉兴蔡大可甘海宁张成哲
卓俊城,曾晓会,曾巧煌,陈玉兴,蔡大可,姚 楠,甘海宁,张成哲
(1.广州中医药大学,广东 广州 510504;2.广东省中医药工程技术研究院,广东 广州 510095;3.广州中医药大学第二临床医学院,广东 广州 510120;4.广东省中医药研究开发重点实验室, 广东 广州 510095)
◇实验方法学◇
Triton WR-1399 通过影响VLDL-C代谢通路和RCT诱导急性HLP小鼠模型的研究
卓俊城1,2,4,曾晓会2,4,曾巧煌3,陈玉兴2,4,蔡大可2,4,姚 楠2,4,甘海宁2,4,张成哲1,4
(1.广州中医药大学,广东 广州 510504;2.广东省中医药工程技术研究院,广东 广州 510095;3.广州中医药大学第二临床医学院,广东 广州 510120;4.广东省中医药研究开发重点实验室, 广东 广州 510095)
目的 观察肌肉注射化学表面活化剂Triton WR-1399诱导小鼠急性高脂血症模型,考察时效和量效关系,并从基因水平探讨Triton WR-1399诱发高脂血症动物模型的机制。方法 用肌肉注射的方式分别给予小鼠0.4 g·kg-1,0.8 g·kg-1和1.5 g·kg-1的Triton WR-1399,取血时间点为24、32、48、56、72、80和96 h,观察这7个时间点小鼠甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白(LDL-C)和高密度脂蛋白(HDL-C)的变化;采用荧光定量PCR(RT-qPCR)法检测脂蛋白脂肪酶(LPL),胆固醇脂酰转移酶(LCAT),胆固醇7-羟化酶(CYP7A1),载脂蛋白AI(ApoAI),载脂蛋白(ApoB),低密度脂蛋白受体(LDLR),B类Ⅰ型清道夫受体(SRB1)和羟甲基戊二酰辅酶A还原酶(HMGCR)的脂质代谢相关通路基因mRNA相对表达量变化。基于模型复制方法考察,研究贝特类和他汀类代表药物的调脂作用,验证模型的稳定性。结果 Triton WR-1399(0.8 g·kg-1,1.5 g·kg-1)剂量组的TC、TG和LDL-C水平明显升高,LPL、LDLR、ApoB和SRB1的基因相对表达明显降低,HMGCR的基因相对表达明显升高;非诺贝特对该急性模型有明显降脂作用。结论 采用肌肉注射0.8 g·kg-1Triton WR-1399所诱导的急性高脂血症小鼠模型稳定,可用于调脂药物筛选,其诱导模型的机制可能与抑制VLDL-C代谢通路和阻断胆固醇逆向转运过程有关。基于该模型的发病机制,非诺贝特比瑞舒伐他汀表现出更为明显的降脂作用。
Triton WR-1399;高脂血症模型;基因表达;VLDL-C;HMGCR; LPL; 非诺贝特
高脂血症(hyperlipidemia, HLP),即脂质代谢紊乱引起的多种脂质水平异常,是导致脂肪肝、动脉粥样硬化及心脑血管损害等多种疾病的重要因素[1]。因此,为筛选防治高脂血症的药物及其药效评价提供有效且稳定的动物模型显得尤为重要。Triton WR-1399是一种非离子表面活性剂,可用于复制急性小鼠高脂血症动物模型[2]。据文献报道,该模型产生机制主要与抑制脂蛋白脂酶活性有关[3],但与脂质相关通路其他靶标的研究报道甚少,其诱发机制还需深入挖掘。研究发现,复制该模型所需造模剂的剂量和成模时间也是众说纷纭。鉴于此,本实验旨在考察Triton WR-1399 诱导HLP小鼠模型的时效和量效关系,以及探讨其诱发小鼠HLP模型的机制,为建立稳定可行的急性小鼠HLP模型提供实验依据。
1 材料
1.1 试剂 Triton WR-1399,SIGMA产品,Lot # MKBQ7986V。 胆固醇(total cholesterol,TC)试剂盒,批号20150815;甘油三酯(triglyceride,TG)试剂盒,批号20150815,均购自南京建成生物工程研究所。高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒,批号140501;低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)试剂盒,批号140461,均购于中生北控生物科技股份有限公司。瑞舒伐他汀钙片(rosuvastatin),阿斯利康制药有限公司,批号129721;非诺贝特(fenofibrate),法利博福尼制药公司,批号23504。
1.2 仪器 IQTM5型荧光定量PCR仪、SmartSpec plus 核酸蛋白测定仪(美国Bio-Rad公司);Varioskan Flash型全波长多功能酶标仪(美国Thermo公司);BS224S电子天平(1/万)(德国SARTORIUS);5450 型小型高速离心机(德国Eppendorf 公司)。
1.3 动物 SPF级NIH小鼠,♀♂各半,体质量18 g~22 g,由广东省医学实验动物中心提供,实验动物生产许可证号SCXK(粤)2013-0002,实验动物质量合格证号№44007200025983。动物实验环境:广东省中医研究所SPF级动物实验室,设施使用许可证号SYXK(粤)2010-0059。
2 方法
2.1 肌注Triton WR-1399诱导小鼠急性高脂血症模型的时效和量效关系考察 取SPF级NIH小鼠280只,♀♂各半,随机均分为28组,即正常对照组,0.4、0.8、1.5 g·kg-1,每个剂量设置24、32、48、56、72、80、96 h时间点,每组10只。根据时间设置,造模前动物禁食不禁水16 h,均肌肉注射不同剂量Triton WR-1399 造模,正常对照组同法肌肉注射等体积生理盐水。动物麻醉,眼眶静脉丛取血,6 000 r·min-1离心10 min。
2.2 贝特类和他汀类代表药物的降脂作用研究 取SPF级NIH小鼠40只,♀♂各半,随机分为4组即空白对照组,模型组,非诺贝特组和瑞舒伐他汀组,每组10只。动物连续给药7 d,于d 5,动物禁食不禁水16 h,均肌肉注射0.8 g·kg-1Triton WR-1399造模,正常对照组同法肌肉注射等体积生理盐水。末日给药1 h后,动物麻醉,眼眶静脉丛取血,6 000 r·min-1离心10 min。
2.3 血脂水平检测 按试剂盒说明书,TC测定采用胆固醇氧化酶法;TG测定采用甘油磷酸氧化酶法;HDL-C测定采用磷钨酸-镁沉淀法;LDL-C采用聚乙烯硫酸沉淀法测定。
2.4 对小鼠肝脏基因表达的影响 各组小鼠取同一位置小块肝脏100 mg,液氮下研磨,然后加入1 mL TRIzol试剂,混匀后转移到1.5 mL离心管中,在室温下放置5 min。然后在4 ℃下12 000 r·min-1,离心10 min。取出上清液,转入新的1.5 mL离心管中,加入1/5体积的氯仿,用力混匀2 min,4 ℃下12 000 r·min-1,离心10 min。上清液转移到新的1.5 mL离心管,加入等体积异丙醇,放入-20℃冰箱静置过夜。次日,取出在4 ℃下12 000 r·min-1,离心10 min。弃上清,沉淀用1 mL 75%的乙醇洗涤2次后,在室温下干燥10 min。最后用200 μL灭菌超纯水溶解沉淀,并且用核酸蛋白测定仪测定OD260/OD280比值,算出RNA的浓度和纯度。
反转录的操作按照Invitrogen公司M-MLV First Strand Kit提供的实验方法(下表)进行,加入上述提取的总RNA,合成第一链 cDNA。

Tab 1 First strand cDNA synthesis
60 min reaction at 42 ℃,5 min reaction at 94℃,first-strand cDNA is obtained
根据GenBank提供的基因序列设计特异性引物,引物设计利用Primer5.0和Beacon Designer 7.91生物软件,由上海英潍捷基贸易有限公司合成。设计的引物序列如下表所示。
基因表达的检测按照下表所示组分进行添加,然后放入荧光定量PCR仪进行反应。

Tab 2 Information of augmented gene primers

Tab 3 Components of PCR reactions
将上述反应混合物放入PCR仪进行扩增。步骤①:94 ℃×5 min;步骤②:94 ℃×30 s→55℃×30 s→72 ℃×50 s(45个循环);步骤③:72 ℃×7 min。每组10个样品,分别取1 μL作为cNDA模板扩增,运用2-△△Ct法计算各组基因相对表达量。具体计算公式为:
F=2-[(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-
(对照组目的基因平均Ct值-对照组内参基因平均Ct值)]
3 结果
3.1 模型复制的时效和量效考察结果
3.1.1 注射Triton WR-1399后小鼠体质量和肝脏指数的变化 如Tab 4,与空白对照组相比,Triton WR-1399各剂量组的动物体质量并无明显变化;其肝脏重量在0.4 g·kg-1和1.5 g·kg-1剂量组明显升高;各剂量组的肝脏指数与空白对照组的差异没有统计学意义。
3.1.2 注射Triton WR-1399后血脂水平的时效与量效关系 见Tab 5~8,与正常对照组比较,0.8 g·kg-1和1.5 g·kg-1剂量组的TG、TC和LDL-C水平明显升高(P<0.05或P<0.01);前者的HDL-C水平有降低的趋势,但差异无统计学意义(P>0.05);后者能明显降低HDL-C的水平(P<0.05或P<0.01)。0.4 g·kg-1剂量组对TG、TC、LDL-C和HDL-C水平均无影响(P>0.05)。
从Fig 1A~D可见,0.8 g·kg-1和1.5 g·kg-1剂量组的血脂水平变化趋势基本一致。TG和TC水平大约在56 h时达到峰值,且在24~56 h趋于稳定;0.8 g·kg-1剂量组的LDL-C在32 h左右达到峰值,之后随着时间推移而呈下降趋势;与之相对应的HDL-C在32 h内呈下降趋势,其后随时间推移上升并在56 h左右达到峰值,随后下降;1.5 g·kg-1剂量组的LDL-C在48 h左右达到峰值,HDL-C在24 h达到最低值,之后随着时间推移略微回升,72 h达到峰值,其后明显下降(P<0.05或P<0.01)。
3.1.3 RT-qPCR检测Triton WR-1399对脂质代谢通路相关基因表达的影响 由Fig 2可见,与空白组相比,Triton WR-1399各剂量组能明显地降低LPL基因表达水平(P<0.01);0.8 g·kg-1和1.5 g·kg-1剂量组的ApoB基因相对表达也呈下降趋势(P<0.05),LCAT和ApoA1基因相对表达呈下降趋势,但差异无统计学意义(P>0.05)。
此外,在Triton WR-1399不同剂量的条件下,LDLR、HMGCR和CYP7A1基因表达水平在24~72 h之间呈现起伏波动,分别于32 h和56 h到达峰值,随后出现下降趋势,于72 h之后趋于平稳;与空白对照组相比,其中0.8 g·kg-1剂量组的SRB1、LDLR和HMGCR基因表达水平明显下调(P<0.05);而CYP7A1在0.8 g·kg-1和1.5 g·kg-1剂量组条件下,呈现明显波动趋势,分别于32 h和56 h到达峰值。
3.2 非诺贝特和瑞舒伐他汀对注射Triton WR-1399小鼠急性高脂血症模型的影响 从Tab 9可以看出,与空白对照组相比,模型组的TC、TG和LDL-C的水平均上升,HDL-C水平下降(P<0.05或P<0.01);与模型组相比,非诺贝特组的TC、TG和LDL-C水平明显降低(P<0.05或P<0.01);瑞舒伐他汀组降脂作用不明显(P>0.05)。
4 讨论
4.1 模型复制方法 该模型采用了肌肉注射的方式进行诱导,比尾静脉注射操作更加方便,可重复性高。与空白对照组相比,Triton WR-1399各剂量组的肝脏指数没有明显变化。

Fig 1 The time- dependent influence of different dosages of Triton WR-1399 on TG, TC, LDL-C and HDL-C level
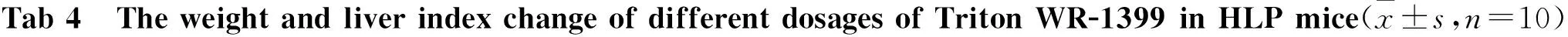

GroupDosage/g·kg-1Bodyweight/gLiverweight/gLiverratio(×100)Control-24.08±1.281.58±0.146.57±0.61TritonWR-13990.424.78±1.431.65±0.166.65±0.570.824.65±1.311.61±0.196.52±0.721.524.43±1.431.60±0.176.56±0.52

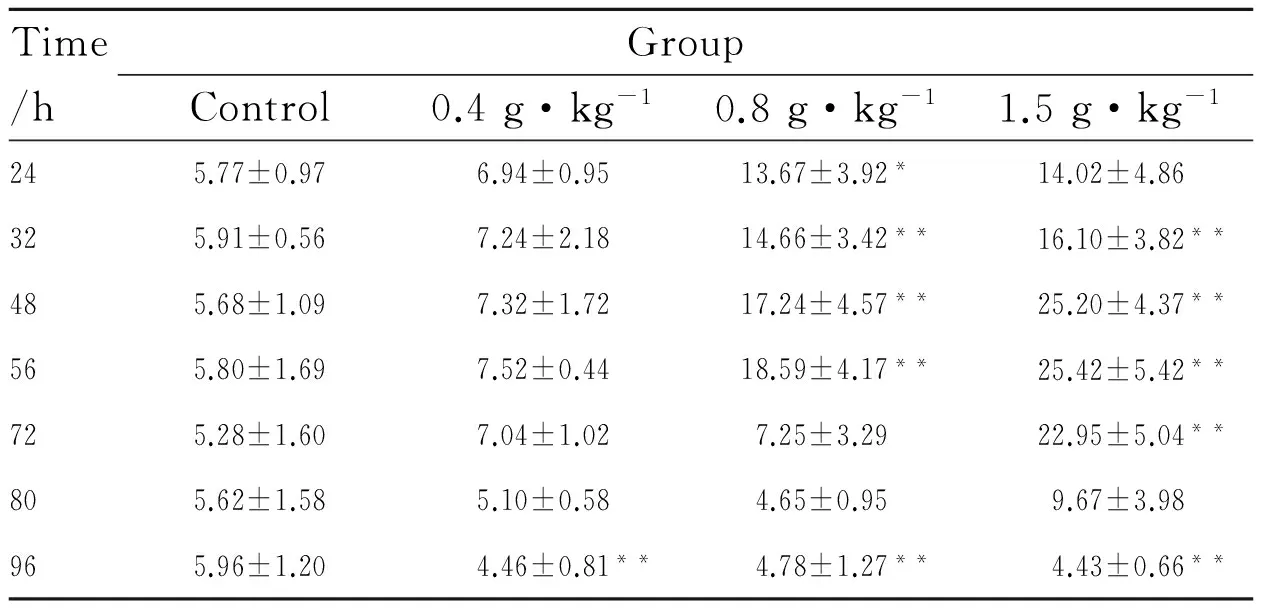
Time/hGroupControl0.4g·kg-10.8g·kg-11.5g·kg-1245.77±0.976.94±0.9513.67±3.92*14.02±4.86325.91±0.567.24±2.1814.66±3.42**16.10±3.82**485.68±1.097.32±1.7217.24±4.57**25.20±4.37**565.80±1.697.52±0.4418.59±4.17**25.42±5.42**725.28±1.607.04±1.027.25±3.2922.95±5.04**805.62±1.585.10±0.584.65±0.959.67±3.98965.96±1.204.46±0.81**4.78±1.27**4.43±0.66**
*P<0.05,**P<0.01vscontrol group


Time/hGroupControl0.4g·kg-10.8g·kg-11.5g·kg-1241.28±0.411.04±0.6726.06±3.92**28.37±9.70*321.51±0.480.81±0.5225.06±2.92**34.68±7.74**481.20±0.401.22±0.4028.13±3.86**37.09±2.88**561.58±0.590.97±0.3328.14±7.60**36.94±1.28**721.22±0.560.88±0.715.55±4.15*33.71±4.27*801.18±0.541.51±0.331.69±0.507.33±5.08**961.51±0.442.20±0.411.34±0.391.40±0.54
*P<0.05,**P<0.01vscontrol group


Time/hGroupControl0.4g·kg-10.8g·kg-11.5g·kg-124h0.76±0.151.03±0.21 3.88±0.90**4.44±5.0732h1.01±0.681.61±0.488.69±2.77*5.53±5.9848h1.09±0.912.59±0.776.96±2.02**8.87±8.80**56h1.05±0.712.21±0.984.90±2.14**5.83±6.69**72h0.93±0.382.17±0.66**2.84±0.90**6.45±6.7680h1.38±0.472.18±0.511.44±0.952.75±2.8096h1.18±0.781.37±0.261.46±1.540.58±0.63
*P<0.05,**P<0.01vscontrol group
4.2 Triton WR-1399 对HLP小鼠模型血脂水平的量效和时效影响 与空白组相比,不同剂量的Triton WR-1399对血脂水平的影响呈量效关系,其中0.8 g·kg-1和1.5 g·kg-1剂量组血脂水平(TC、TG和LDL-C)明显升高,说明模型诱导成功。从时效曲线的结果可见,血脂水平(TC、TG)呈现先上升后下降的趋势,于32~56 h间出现相对稳定的平台期。本实验结果提示,Triton WR-1399诱导急性小鼠HLP模型呈剂量和时间依赖性,选择合适的剂量进行诱导,且在血脂水平处于相对稳定的平台期即32~56 h之间,将更能可靠的呈现调血脂药物的疗效评价效果。

Tab 8 The time-dependent influence of
*P<0.05,**P<0.01vscontrol group
4.3 Triton WR-1399 对HLP小鼠脂质代谢相关基因相对表达的影响 由结果可知,肌肉注射不同剂量的Triton WR-1399脂质代谢相关基因表达情况各异。结合Fig 3脂质代谢关键通路图分析,0.8 g·kg-1在32 h~56 h内,明显地下调了LPL、LDLR、ApoB和SRB1的基因相对表达,ApoA1、LCAT、CYP7A1和HMGCR的水平也呈下调趋势。有文献报道Triton WR-1399能抑制LPL的活性和其转录水平[4],与本研究结果一致,从而使VLDL-C水解受阻,大量的堆积导致血中TG和TC水平升高;ApoB是VLDL-C与LDL-C的主要载脂蛋白,可以识别LDLR[5-6],结果显示其mRNA表达下调,表明LDL-C代谢通路受阻,使与之结合的TC无法被肝细胞的LDLR摄取分解成FC,从而上调了HMGCR的活性和mRNA的表达[7-8],使得内源性FC合成增加[8],然而FC对HMGCR的活性有负反馈调节作用,当内源性FC能满足细胞内的需求时,HMGCR的活性或基因表达则会下调。
结果显示Triton WR-1399能够使LCAT基因相对表达下调,使得LCAT在HDL表面催化FFA从卵磷脂转移至FC生成CE这一过程被阻断,无法向成熟的HDL-C转化,从而影响胆固醇逆向转运通路[9-10]。同时,作为LCAT的辅助因子,ApoA1的mRNA下调,使其激活受到影响,进一步影响HDL-C的发育成熟;肝细胞的SRB1可以摄取分解未与LDLR结合的LDL-C以及HDL-C[11],当SRB1的mRNA表达水平下调,导致摄取CE的过程被阻断;进入肝脏后的FC可以被CYP7A1转化成胆汁酸外排以调节肝细胞的胆固醇流量[12],完成胆固醇逆向转运,从结果可看出,注射Triton WR-1399后其活性及其mRNA表达先升高,这可能与其肝脏代偿性表现有关,32 h之后随着时间的推移其表达下降,胆固醇代谢去路受阻,进一步加剧TC的滞留。
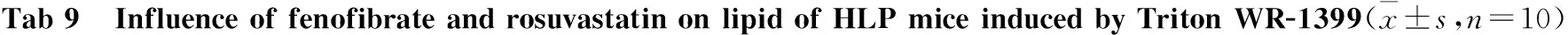

GroupIndexesTG/mmol·L-1TC/mmol·L-1LDL-C/mmol·L-1HDL-C/mmol·L-1Control2.14±0.744.16±0.812.85±0.821.23±0.35Model24.76±7.74**15.66±4.56**6.26±3.26*0.72±0.39**Rosuvastatin22.17±6.0213.97±5.194.95±2.801.23±0.17##Fenofibrate2.08±0.95##6.65±1.70**##3.09±1.03#1.28±0.74##
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.

Fig 2 Influence of different dosages of Triton WR-1399 on relative gene expression in HLP mice models*P<0.05,**P<0.01 vs control group
综上所述,Triton WR-1399 诱导急性HLP小鼠模型的机制可能通过影响VLDL-C代谢通路和胆固醇逆向转运[13],使得TG和TC滞留在血液中,CE无法充分地被肝细胞的LDLR和SRB1摄取分解成FC以满足自身所需,导致内源性胆固醇合成途径被激活,从而进一步升高TC和TG在体内的水平[14]。

Fig 3 Influence of Triton WR-1399 onpathway of endogenous lipid metabolic mechanism
4.4 贝特类和他汀类代表药物对肌注Triton WR-1399小鼠急性高脂血症模型的影响 为进一步验证该模型复制方法稳定可靠,我们选择了降脂作用靶点明确的贝特类和他汀类代表药物—非诺贝特和瑞舒伐他汀作为研究对象,观察其降脂效果。
本研究结果初步证实,Triton WR-1399 诱导急性HLP小鼠模型的机制可能与选择性地抑制了LPL的活性以及阻断胆固醇逆向转运过程,导致TG和TC在体内大量蓄积,从而诱发高脂血症。基于该模型的研究,发现非诺贝特降脂效果明显,而瑞舒伐他汀并没有表现出明显的降脂作用。众所周知,非诺贝特为第3代苯氧芳酸类调脂药,为PPAR-α的激动剂[15],通过调节下游脂肪组织和骨骼肌中LPL的活性,从而加快富含TG的脂蛋白分解代谢,降低T G水平[16];非诺贝特还可升高HDL-C水平,促进胆固醇逆向转运,降低TC[17-18]。而瑞舒伐他汀作为新一代他汀类药物,可高度选择性地抑制HMGCR活性,减少TC合成,从而实现降血脂作用[19],然而本模型中不同剂量Triton WR-1399组的HMGCR基因表达在不同时间点呈现明显的起伏变化,其中0.8 g·kg-1剂量组HMGCR基因表达在有效筛选药效时间内代偿性上调后呈下调趋势,使得他汀类药物无法发挥其调脂药效。
(致谢:本实验在广东省中医药工程技术研究院中药药理研究室和广东省中医药研究开发重点实验室开展,感谢陈玉兴老师、曾晓会老师、蔡大可老师、姚楠老师、甘海宁师兄、曾巧煌师姐和张成哲同学的帮助与支持。)
[1] 赵 严, 胡国勇, 柯爱武,等. 高脂血症动物模型的研究进展[J]. 中华胰腺病杂志, 2011, 11(4):295-7.
[1] Zhao Y, Hu G Y, Ke A W. et.al. Research progress of hyperlipidemia animal model[J].ChinJPancreatol,2011, 11(4):295-7.
[2] 翟羽佳, 陈邦添, 李善兵,等. Triton WR-1339诱发小鼠高脂血症模型的研究[J]. 中国药理学通报, 2011, 27(8):1178-80.
[2] Qu Y J, Chen B T, Li S B,et al. Study on hyperlipoidemia model induced by Triton WR-1339 in mice[J].ChinPharmacolBull, 2011, 27(8):1178-80.
[3] 余艳辉, 文 军, 郭兆贵. Triton WR-1339对小鼠血脂水平的影响[J]. 中国药理学通报, 2002, 18(5):599-600.
[3] Yu Y H, Wen J, Guo Z G. Effects of Triton WR-1339 on blood-lipids of mice[J].ChinPharmacolBull, 2002, 18(5):599-600.
[4] Takahashi Y,Inaba N,Kuwahara S.Antioxidative effect of citrus essential oil components on human low-density lipoproteininvitro[J].BiosciBiotechnolBiochem,2003,67:195-7.
[5] 胡源岙. 根皮苷激活脂蛋白脂酶改善实验性高甘油三酯血症[D].暨南大学, 2013.
[5] Hu Y A. Effects of phloridzin on experimental hypertriglyceridemia by activating lipoprotein lipase[D].Jinan University,2013.
[6] 宋 鑫, 高南南, 杨润梅,等. 豚鼠高脂血症模型LDL-C代谢紊乱的机制研究[J]. 中国药理学通报, 2012, 28(3):342-6.
[6] Song X, Gao N N, Yang R M. et al. Mechanism of hyperlipidemia LDL-C metabolic disorder in the guinea pig[J].ChinPharmacolBull, 2012, 28(3):342-6.
[7] Kou S,Han B,Wang Y,et al.Synergetic cholesterol-lowering effects of main alkaloids from Rhizoma Coptidis in HepG2 cells and hypercholesterolemia hamsters[J].LifeSci,2016,151:50-60.
[8] Hu H J,Luo X G,Dong Q Q,et al.Ethanol extract of Zhongtian hawthorn lowers serum cholesterol in mice by inhibiting transcription of 3-hydroxy-3-methylglutaryl-CoA reductase via nuclear factor-kappa B signal pathway[J].ExpBiolMed(Maywood),2016,241:667-74.
[9] 李向荣,陈菁菁, 刘晓光. 桑叶总黄酮对高脂血症动物的降血脂效应[J]. 中国药学杂志,2009,44(21):1630-3.
[9] Li X R,Chen Q Q,Liu X G. Lipid lowering activity of total flavonoids from mulberry leaves in two hyperlipidemic animal models[J].ChinPharmaJ, 2009, 44(21):1630-3.
[10]顾 清, 周朋辉, 张静姝,等. 核黄素对高脂血症大鼠脂质代谢的影响[J]. 中国慢性病预防与控制, 2015, 23(1):34-6.
[10]Gu Q, Zhou P H, Zhang J S. et al. The effects of riboflavin on lipid metabolism in rats with hyperlipidemia[J].ChinJPreventControlChronDis,2015, 23(1):34-6.
[11]Prashanth A,Jeyakumar S M,Giridharan N V.Vitamin A-enriched diet modulates reverse cholesterol transport in hypercholesterolemic obese rats of the WNIN/Ob strain[J].JAtherosclerThromb,2014,21:1197-207.
[12]Schurr P E,Schultz J R.Triton-induced hyperlipidemia in rats as an animal model for screening hypolipidemic drugs[J].Lipids,1972,7:68-74.
[13]Davidson M H,Voogt J,Luchoomun J,et al.Inhibition of intestinal cholesterol absorption with ezetimibe increases components of reverse cholesterol transport in humans[J].Atherosclerosis,2013,230:322-9.
[14]Cao P,Pan H,Xiao T,et al.Advances in the study of the antiatherogenic function and novel therapies for HDL[J].IntJMolSci,2015,16:17245-72.
[15]Zhang Y,Cui Y,Wang X L,et al.PPARα/γ agonists and antagonists differently affect hepatic lipid metabolism, oxidative stress and inflammatory cytokine production in steatohepatitic rats[J].Cytokine,2015,75:127-35.
[16]闫冬梅. 非诺贝特作用机制的进展[J]. 中国医药指南, 2012, 10(21):467-9.
[16]Yang D M. Advances in mechanism of fenofibrate[J].GuideChinaMed, 2012, 10(21):467-9.
[17]Ferreira E S,Silva M A,Demonte A.β-conglycinin combined with fenofibrate or rosuvastatin have exerted distinct hypocholesterolemic effects in rats[J].LipidsHealthDis,2012,11:11.
[18]初欣欣, 杨润梅, 于 莹,等. 金黄地鼠高脂血症模型甘油三酯代谢紊乱的生物标志物的研究[J]. 中国药理学通报, 2014,30(7):1012-7.
[18]Chu X X, Yang R M, Yu Y,et al. Triglyceride disorder biomakers in hyperlipidemia hamsters[J].ChinPharmacolBull, 2014,30(7):1012-7.
[19]李玉霞, 江 珊. 瑞舒伐他汀的研究进展[J]. 心血管病学进展, 2010, 31(4):585-8.
[19]Li Y X, Jiang S. Advances in research of rosuvastatin[J].AdvCardiovaDis, 2010, 31(4):585-8.
Study on hyperlipidemia mice models induced by Triton WR-1399 via VLDL-C metabolic pathway and reverse cholesterol transport
ZHUO Jun-cheng1,2,4, ZENG Xiao-hui2,4, ZENG Qiao-huang3,CHEN Yu-xing2,4, CAI Da-ke2,4, YAO Nan2,4,GAN Hai-ning2,4, ZHANG Cheng-zhe1,4
(1.GuangzhouUniversityofChineseMedicine,Guangzhou510504,China;2.GuangdongProvinceEngineeringTechnologyResearchInstituteofT.C.M,Guangzhou510095,China;3.TheSecondAffiliatedHospitalofGuangzhouUniversityofChineseMedicine,Guangzhou510120,China;
4.GuangdongProvincialKeyLaboratoryofResearchandDevelopmentinTraditionalChineseMedicine,Guangzhou510095,China)
Aim To investigate the time and dosage-dependent relationship in Triton WR-1399 -induced acute hyperlipidemia mice models and explore the underlying mechanism in gene relative expression.Methods Mice were given different dosages of Triton WR-1399(0.4 g·kg-1, 0.8 g·kg-1, 1.5 g·kg-1) through im and blood was collected at different time(24 h,32 h,48 h,56 h,72 h,80 h and 96 h) to observe the changes of TG,TC,LDL-C and HDL-C in HLP mice models. RT-qPCR was utilized to detect gene relative expression of LPL,LDLR,ApoA1,ApoB,LCAT,SRB1,CYP7A1 and HMGCR. To verify stability of this model, fenofibrate and rosuvastatin were adapted to investigate the mechanism of lipid regulation based on the exploration of acute HLP mice models.Results Triton WR-1399(0.8 g·kg-1,1.5 g·kg-1) could significantly reduce the level of TC,TG,LDL-C and enhance the content of HDL-C. In addition, it obviously inhibited the gene relative expression of LPL, LDLR, ApoB andSRB1, while HMGCR was significantly enhanced.Fenofibrate showed noble hypolipidemic efficacy in this model.Conclusions The effective time range for screening low-cholesterol is 24 h~32 h after intramuscular injection of Triton WR-1399(0.8 g·kg-1) and the underlying mechanism is likely associated with inhibition of metabolic pathway of VLDL-C and block of the reverse cholesterol transport. Based on the mechanism of acute HLP mice models,fenofibrate performs stronger hypolipidemic efficacy than rosuvastatin.
Triton WR-1399; hyperlipidemia model; gene expression; VLDL-C; HMGCR; LPL; fenofibrate
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.052.html
2016-10-08,
2016-12-08
广东省科技厅资助项目(No 2015A040404030,2014A070705014,2013B060300034);广东省中医药管理局资助项目(No 20151013,20152006,20161026,20141028)
卓俊城(1993-),男,硕士生,研究方向:中药药理学,E-mail:boyce0118@126.com; 陈玉兴(1971-),男,主任中药师,研究方向:中药药理学,通讯作者,E-mail:tcmgdp@126.com
10.3969/j.issn.1001-1978.2017.03.026
A
1001-1978(2017)03-0433-07
R-332;R344;R363-332;R589.2;R965.1;R972.6;R977.6
