萆薢总皂苷对大鼠急性痛风性关节炎NALP3炎性体信号通路的影响
2017-03-17陈光亮
王 璐,那 莎,陈光亮
(安徽中医药大学中西医结合临床学院, 安徽 合肥 230038)
萆薢总皂苷对大鼠急性痛风性关节炎NALP3炎性体信号通路的影响
王 璐,那 莎,陈光亮
(安徽中医药大学中西医结合临床学院, 安徽 合肥 230038)
目的 研究萆薢总皂苷对大鼠急性痛风性关节炎的防治作用及机制。方法 Wistar大鼠,♂,72只,随机分组后,各用药组大鼠预先灌胃给予不同剂量萆薢总皂苷,随后右侧踝关节腔注射尿酸钠诱导急性痛风性关节炎。观察大鼠步态,测定关节肿胀度,HE染色进行病理学分析。ELISA法检测血清TNF-α、IL-1β、IL-18表达。Western blot法检测滑膜组织中pro-IL-1β、NALP3炎性体相关蛋白变化。结果 萆薢总皂苷各浓度和秋水仙碱均可改善大鼠步态。TSD高、中剂量组与秋水仙碱类似,可降低大鼠关节肿胀度,病理学检查踝关节病变好转,血清TNF-α、IL-1β、IL-18明显减少,滑膜组织pro-IL-1β、NALP3、ASC、caspase-1前体和活性形式蛋白表达降低。结论 萆薢总皂苷对大鼠急性痛风性关节炎具有防治作用,机制可能是抑制NALP3炎性体装配和激活,以及抑制炎性细胞因子的表达。
萆薢总皂苷;急性痛风性关节炎;尿酸钠;NALP3;炎性体;炎性因子
急性痛风性关节炎(acute gouty arthritis,AGA),是体内嘌呤代谢紊乱血尿酸升高,导致尿酸钠盐(monosodium urate,MSU)晶体在关节及周围组织沉积所引起的炎症反应。目前是危害人类健康的严重代谢性疾病,随着生活水平的提高,发病率逐年升高[1-2]。萆薢(Dioscorea hypoglauca)来源于薯蓣科植物粉萆薢(Dioscorea hypoglauca polibin)的干燥根茎,具有利湿浊、祛风湿之功效,主治膏淋、风湿痹痛、湿疹,含甾体皂苷1.1%-2.6%[3],是临床上治疗痛风和高尿酸血症的代表药物。课题组前期研究显示,萆薢总皂苷(total saponin of Dioscorea,TSD)可通过调节肾脏尿酸转运蛋白-1 (uric acid transporter 1,URAT1)表达,促进尿酸排泄,防治高尿酸血症[4]。最新研究发现[5-7],固有免疫直接参与痛风的发展,多种固有免疫细胞参与识别并吞噬MSU晶体,激活胞内的信号转导,最终调节炎性细胞因子如白细胞介素-1β(interleukin-1β, IL-1β)等的产生和成熟,其中NALP3( nod-like receptor protein 3,NALP3) 炎性体(NALP3 inflammasome)的形成是重要的信号活化产物。本实验以MSU诱导大鼠AGA模型,从与AGA急性发作相关的细胞因子TNF-α、IL-1β、IL-18入手,进一步研究TSD对大鼠关节滑膜组织NALP3炎性体相关蛋白的影响,阐明TSD防治AGA的可能作用机制,为TSD的临床应用提供实验依据。
1 材料与方法
1.1 药品与试剂 萆薢总皂苷(本课题组提供[8],批号201501)。尿酸(Sigma公司, 10010995);秋水仙碱片(西双版纳药业有限责任公司,H53021369);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-18酶联免疫吸附(ELISA)检测试剂盒(武汉博士德科技有限公司,EK0393、EK0592、EK0526);NALP3一抗(武汉博士德生物公司,BA3677),ASC一抗(美国ImmunoWay公司,YT0365),pro-caspase-1一抗(美国Abcam公司,ab108362),cleaved caspase-1一抗(美国Santa Cruz公司,sc-1597),β-actin一抗(美国CST公司,8H10D10);二抗(HRP标记山羊抗兔IgG、山羊抗小鼠IgG)、ECL化学发光试剂盒(碧云天生物技术公司A0208、A0239、P0018)等。
1.2 动物 Wistar大鼠,♂,72只,体质量(200±20)g,SPF级,由安徽省医学实验动物中心提供,动物合格证编号:SCXK(皖)2015-001。
1.3 仪器 YP202N电子天平(上海精密仪器有限公司),TB-718生物组织包埋机(湖北泰维电子有限公司),NOVA超薄切片机(LKB公司),CKX41-F32FL 型倒置显微镜(美国Olympus 公司),UV-754分光光度计(上海精密仪器有限公司),酶标仪(美国Thermo公司)Eppendorf 5430R台式高速冷冻离心机,DYY-7C电泳仪(北京六一仪器),GE凝胶成像系统(美国GE公司)等。
1.4 方法
1.4.1 尿酸钠溶液的制备 按照文献方法[9],取2g尿酸加入400 mL的沸水中,用1mol·L-1NaOH溶液调pH至7.4,再加热至95℃,室温冷却并轻轻搅拌,4℃放置过夜,析出絮状沉淀,过滤,得微晶型尿酸钠,80℃高温灭菌。用前称取1g尿酸钠,充分研磨,加无菌生理盐水20 mL配成50 g·L-1的混悬液。
1.4.2 实验分组与给药 大鼠随机均分为6组(n=12):正常组,模型组,TSD低、中、高剂量组(30、100、300 mg·kg-1)和阳性对照组(秋水仙碱0.3 mg·kg-1),正常组和模型组蒸馏水灌胃,TSD和秋水仙碱组灌胃给药,每日9点给药1次,连续7 d,d 5给药后1 h,正常组大鼠右侧踝关节背侧注射无菌生理盐水0.2 mL,其它各组在大鼠右侧踝关节背侧注射0.2 mL MSU混悬液,诱导AGA模型。
1.4.3 关节肿胀度测定 关节肿胀度测定分别于造模前,造模后6、12、24、48 h测定大鼠右侧踝关节的容积,以(造模后关节容积-造模前关节容积)的差值作为关节肿胀度。
1.4.4 大鼠步态分级 造模24 h后,按Coderre[10]的方法观察大鼠步态。0级:正常行走;1级:轻微跋行,受试下肢略有弯曲;2级:中度跋行,受试下肢刚触及地面;3级:重度跋行,受试下肢离开地面,三足着地行走。
1.4.5 大鼠踝关节组织病理学观察 造模48 h后,各组取其中6只大鼠,处死后以受试踝关节为中心的上下0.5cm部位,经4%多聚甲醛固定1周,常规石蜡包埋,5μm纵向切片,脱蜡水化后苏木精、伊红染色,逐级脱水封片。200×光学显微镜下观察HE染色后踝关节滑膜组织、炎症细胞浸润等情况。
1.4.6 血清炎症因子TNF-α、IL-1β、IL-18的测定 造模48h后,各组大鼠用10%水合氯醛麻醉,腹主动脉取血,静置20min后,以3 500 r·min-1离心15 min,收集血清。实验时按ELISA试剂盒步骤操作,测定大鼠血清TNF-α、IL-1β、IL-18表达。
1.4.7 大鼠踝关节滑膜组织IL-1β前体蛋白、NALP3炎性体相关蛋白表达 造模48 h后,按照文献方法[11],各组取6只大鼠,处死后快速分离出踝关节滑膜组织置于研磨器中,于冰上加入含1 mmol·L-1PMSF的RIPA裂解液,并充分研磨,匀浆,于12 000 r·min-1,4 ℃离心5 min,收集上清液。Western blot检测pro-IL-1β,NALP3炎性体组成蛋白NALP3、ASC、pro-caspase-1和caspase-1活性形式的表达。
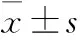
2 结果
2.1 萆薢总皂苷对MSU诱导的急性痛风性关节炎大鼠关节肿胀度影响 与正常组相比,模型组在造模后6、12、24、48 h关节肿胀度均明显增加(P<0.01)。与模型组相比,秋水仙碱组在造模后6、12、24、48 h关节肿胀度降低,TSD高、中剂量组大鼠(300、100 mg·kg-1)在造模后6、12、24、48 h关节肿胀度降低,差异具有显著性。TSD低剂量组(30 mg·kg-1)大鼠关节肿胀程度与模型组相比差异无统计学意义。见Fig 1。
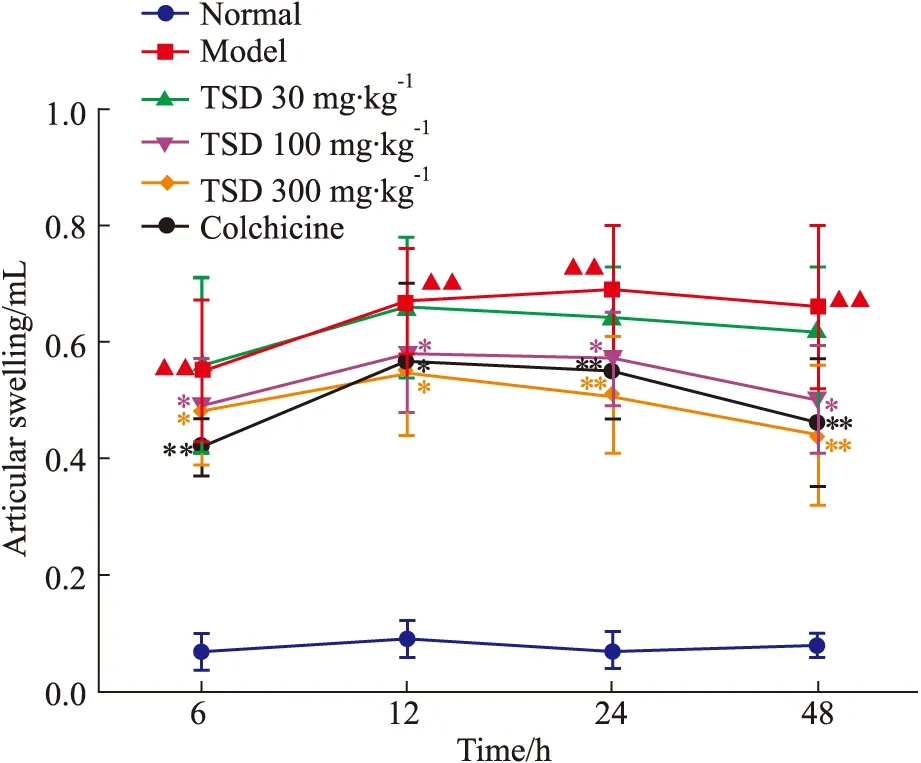
Fig 1 Effect of TSD on articular swelling
One-way ANOVA analysis:▲▲P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
2.2 萆薢总皂苷对MSU致急性痛风性关节炎大鼠步态的影响 模型组大鼠在注射MSU造模 24h后,活动减少,后肢弯曲,轻触或抬离地面,呈三足步态,且关节局部红肿程度严重。TSD 30、100、300 mg·kg-1组及秋水仙碱组大鼠与模型组相比步态评分差异均有显著性,步态明显好转,见Tab 1。
2.3 萆薢总皂苷对大鼠踝关节及周围组织病理学的影响 正常组大鼠滑膜组织无炎细胞浸润,未见毛细血管充血、水肿,滑膜层细胞均匀分布;模型组大鼠滑膜组织可见明显滑膜增生、充血水肿、大量中性粒细胞和单核细胞等炎性细胞浸润。TSD 30 mg·kg-1周围软组织充血水肿明显有较多的炎细胞浸润,较模型组略有改善。TSD 100 mg·kg-1组可见部分充血水肿,滑膜层细胞有增生,炎性细胞浸润较模型组改善明显。TSD 300 mg·kg-1组与秋水仙碱组相似,炎性细胞浸润少,滑膜层细胞基本正常,仅有轻微充血水肿,与模型组相比有明显改善。见Fig 2。

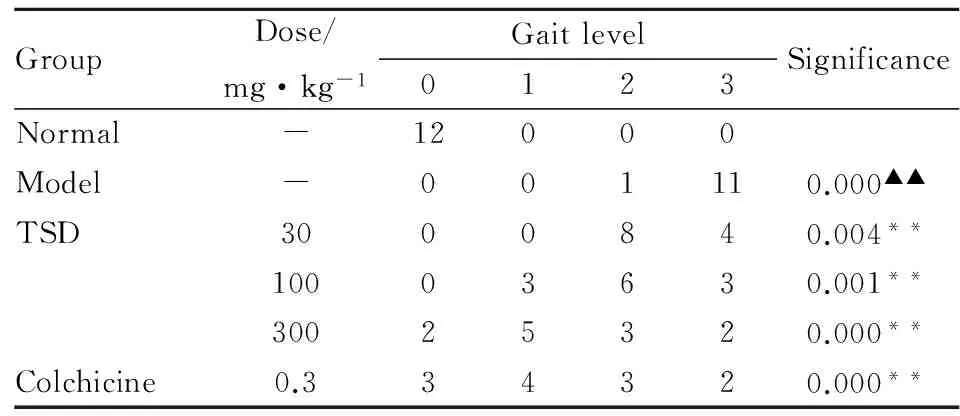
GroupDose/mg·kg-1Gaitlevel0123SignificanceNormal-12000Model-001110.000▲▲TSD3000840.004**10003630.001**30025320.000**Colchicine0.334320.000**
Mann-Whitney U analysis:▲▲P<0.01vsnormal;**P<0.01vsmodel

Fig 2 Effect of TSD on histological pathology of ankle joint in AGA rats(200×)
A:Normal;B:Model;C:TSD 30 mg·kg-1;D: TSD 100 mg·kg-1;E: TSD 300 mg·kg-1;F:Colchicine
2.4 萆薢总皂昔对大鼠血清中TNF-α、IL-1β、IL-18水平的影响 与正常组相比,模型组大鼠血清中TNF-α、IL-1β、IL-18水平明显增加。与模型组大鼠相比,秋水仙碱组和TSD高、中剂量组大鼠(300、100 mg·kg-1)TNF-α、IL-1β、IL-18水平降低,差异有显著性(P<0.05)。TSD低浓度组(30mg·kg-1)各炎性因子水平与模型组相比均未见明显差异。见Fig 3。

Fig 3 Effect of TSD on TNF-α,IL-1β,
1:Normal;2:Model;3:TSD 30 mg·kg-1;4: TSD 100 mg·kg-1;5: TSD 300 mg·kg-1;6:Colchicine. One-way ANOVA analysis.▲▲P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
2.5 萆薢总皂苷对大鼠滑膜组织IL-1β前体、NALP3炎性体相关蛋白的影响 Western blot和半定量统计结果显示,模型组大鼠pro-IL-1β表达较正常对照组明显上调,而TSD 300、100 mg·kg-1、秋水仙碱组与模型组相比明显降低。NALP3、ASC、pro-caspase-1和cleaved caspase-1蛋白在正常组大鼠中仅有微量表达,而在模型组大鼠中明显升高。与模型组相比,秋水仙碱组、TSD 300、100 mg·kg-1组可见NALP3、ASC、pro-caspase-1和cleaved caspase-1蛋白表达明显降低,呈剂量依赖性;而TSD 30 mg·kg-1组与模型组相比有降低趋势,但差异无统计学意义,见Fig 4。
3 讨论
急性痛风性关节炎是MSU晶体沉积在关节组织引起的,发作时以四肢远端关节非对称的急性剧痛、红肿、发热为主要特征,起病急剧,是痛风首发症状。缓解关节症状,抑制炎症反应对防治痛风性关节炎具有重要意义。现有大量研究显示NALP3炎性体信号通路在痛风炎症与免疫调节中发挥重要作用[12-14]。NALP3是NLRs受体家族中的重要亚族之一,主要由B淋巴细胞、T淋巴细胞等产生。NALP3作为胞内模式识别受体,识别病原相关分子模式和危险相关分子模式。如MSU 、SiO2、CPPD、胞外ATP等危险信号分子,可作为配体被NALP3识别,使NALP3发生蛋白寡聚化,并招募衔接蛋白凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing,ASC)和具有半胱天冬酶活化募集结构域(caspase activiting and recruitment domain,CARD)的半胱天冬酶-1(caspase-1),组装成NALP3炎性体,最终活化效应蛋白caspase-1。IL-1β是痛风急性发作的关键细胞因子[15],IL-18、IL-6、TNF-α等都被报道参与痛风的发展。近期研究发现[16-17],IL-1β的成熟受到两个信号调控,一是细胞外模式识别受体Toll样受体,调控pro-IL-1β的产生;另一个关键信号是经NALP3炎性体效应蛋白caspase-1剪切,使IL-1β的前体成有活性的形式。活化的IL-1β、IL-18等炎性因子分泌到细胞外产生痛风的炎症级联放大效应。NALP3、ASC、caspase-1是炎性体激活的关键,IL-1等炎性因子是炎性体激活后致炎的终产物,是目前防治急性痛风性关节炎新的研究要点。最新研究发现[18]:TRAIL 与Neuropilin-2两种细胞因子在急性痛风发作时明显上调,亦可作为日后诊断、治疗的新指标。《药品化义》中记载,萆薢“性味淡薄,长于渗湿,主治风寒麻痹”,含甾体皂苷1.1%~2.6%,主要为粉背皂苷A(hypoglaucine A)、原粉背皂苷A(protohypoglaucine A)、纤细薯蓣皂苷(gracillin)、原纤细薯蓣皂苷(progracillin)[3]。甾体皂苷元(主要是薯蓣皂苷元)是半合成甾体激素的主要原料,最早法国专利报道薯蓣皂苷元(diosgenin)及其总皂苷有抗关节炎作用。美国Pfizer制药公司用替告皂苷元(tigogenin)和海柯皂苷元(hecogenin)为甾体母核所合成的纤维双糖苷有很强的降血脂作用。不同文献对痛风用药规律系统分析显示,在常用处方中萆薢使用频率排在前10位[19-22]。本实验以下游炎性因子和NALP3炎性体为出发点,探讨萆薢总皂苷防治急性痛风性关节炎的作用机制。


1:Normal;2:Model;3:TSD 30 mg·kg-1;4: TSD 100 mg·kg-1;5: TSD 300 mg·kg-1;6:Colchicine. One-Way ANOVA analysis:▲▲P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
本实验采用大鼠踝关节注射MSU晶体复制AGA模型,造模后大鼠关节肿胀程度明显增加,后肢弯曲抬离地面,呈三足步态;病理切片结果显示,滑膜组织可见大量炎性细胞浸润,充血水肿明显,模型复制成功。本实验研究发现:TSD组与模型组比较,TSD各浓度均可改善大鼠步态,300、100 mg·kg-1的TSD能明显改善大鼠关节肿胀程度,使炎细胞的浸润减少,缓解组织充血水肿。以上结果表明,TSD可明显改善急性痛风性关节炎大鼠病变,效果与秋水仙碱类似。
模型组大鼠血清中IL-1β、IL-18、TNF-α表达明显升高,提示IL-1β、IL-18、TNF-α等炎性因子在痛风急性发作中起到重要作用。与秋水仙碱类似,TSD高、中剂量均可抑制炎性因子的表达。Martinon等[7]研究发现用MSU诱导小鼠腹膜炎,NALP3-/-、ASC-/-以及caspase-1-/-小鼠腹膜炎症反应比野生型小鼠明显减轻,IL-1β的成熟和释放受到明显抑制。提示MSU介导的炎症反应需要NALP3炎性体的参与,而IL-1β的成熟也是受到NALP3炎性体的直接调控。因而探讨TSD发挥作用是否与抑制NALP3炎性体的活化相关具有重要的研究意义。本实验中模型组大鼠滑膜组织NALP3、ASC、caspase-1的前体和活性形式表达均明显上调,说明NALP3炎性体参与AGA炎症的发展。与模型组相比,300、100mg·kg-1的TSD可明显降低NALP3、ASC、caspase-1前体和活性形式的表达,说明TSD抗AGA作用的发挥可能是通过抑制NALP3炎性体的装配以及活化,与秋水仙碱类似。因而实验结果表明,TSD可通过抑制NALP3炎性体的装配以及激活的caspase-1,调节下游炎性因子表达,缓解痛风急性发作的症状,防治急性痛风性关节炎。因其对IL-1β前体也具有抑制作用,TSD是否参与另一细胞膜上的固有免疫识别受体Toll样受体调节的通路还需要以后进一步研究。TSD发挥作用具有多靶点性,为临床实践提供有力的依据,并为NALP3炎性体通路相关的疾病防治提供参考。
(致谢:本研究在安徽中医药大学中西医结合临床学院药理学实验室完成,衷心感谢本课题组所有老师和同学的指导和帮助。)
[1] Lu X,Li X,Zhao Y,et al. Contemporary epidemiology of gout and hyperuricemia in community elderly in Beijing[J].IntJRheumDis, 2014,17(4):400-7.
[2] Kuo C F,Grainge M J,Zhang W,et al. Global epidemiology of gout: prevalence, incidence and risk factors[J].NatRevRheumatol, 2015,11(11):649-62.
[3] 国家中医药管理局《中华本草》编委会.《中华本草(精选本)》[M].上海:上海科技出版社,1998: 2107-11.
[3] Editorial board of Chinese Materia Medica of State Administration of Traditional Chinese Medicine. Chinese Mateteria Medica[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1998: 2107-11.
[4] 陈光亮,朱立然,那 莎,等. 萆薢总皂苷对大鼠慢性高尿酸血症和肾小管尿酸转运体1表达的影响[J]. 中国中药杂志, 2013,38(14):2348-53.
[4] Chen G L,Zhu L R,Na S,et al. Effect of total saponin of Disoscorea on chronic hyperuricemia and expression of URAT1 in rats[J].ChinJChinMaterMed, 2013,38(14):2348-53.
[5] Qing Y F,Zhang Q B,Zhou J G. Innate immunity functional gene polymorphisms and gout susceptibility[J].Gene, 2013,524(2):412-4.
[6] 王 璐,李 璐,陈光亮. NALP3炎性体在痛风中的作用与药物治疗研究进展[J]. 生命科学, 2016,28(3):405-8.
[6] Wang L,Li L,Chen G L. Role of NALP3 inflammasome in the pathogenesis of gout and advances in drug treatment[J].ChinBullLifeSci, 2016,28(3):405-8.
[7] Martinon F,Pétrilli V,Mayor A,et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J].Nature, 2006, 440(7081):237-41.
[8] 陈光亮. 萆薢牛膝总皂苷防治痛风及其机制研究[D]. 合肥:安徽医科大学, 2005:34-6.
[8] Chen G L. Effcts and mechanisms of total saponin of Dioscorea and Achyranthes on gout[D]. Hefei:Anhui Medical University, 2005:34-6.
[9] Huang H G,Sun Y F,Ming H U, et al. Characteristics of monosodium urate monohydrate crystal-induced acute arthritis in rats that mimicked human gouty arthritis[J].BullAcadMil, 2005,29: 538-42.
[10] Coderre T J,Wall P D. Ankle joint urate arthritis in rats provides a useful tool for the evaluation of analgesic and anti-arthritic agents[J].PharmacolBiochemBehav, 1988,29(3):461-6.
[11] 胡雨峰,俞晶华,奚飞飞. 桂枝芍药知母汤对 CIA 大鼠关节炎的作用及其机制研究[J]. 江苏中医药, 2015,47(11):76-82.
[11] Hu Y F,Yu J H,Xi F F. Influence and mechanism research of Guizhishaoyaozhimu decoction of CIA rats[J].JiangsuJTraditChinMed, 2015,47(11):76-82.
[12] Church L D,Cook G P,McDermott M F. Primer: inflammasomes and interleukin-1 beta in inflammatory disorders[J].NatClinPractRheumatol, 2008,4(1): 34-42.
[13] Tao J H,Zhang Y,Li X P. P2X7R: a potential key regulator of acute gouty arthritis[J].SeminArthritisRheum, 2013, 43(3):376-80.
[14] Steiger S,Harper J L.Mechanisms of spontaneous resolution of acute gouty inflammation[J].CurrRheumatolRep, 2014,16(1):392.
[15] Kingsbury S R,Conaghan P G,McDermott M F. The role of the NLRP3 inflammasome in gout[J].JInflammRes, 2011,4:39-49.
[16] McCormack W J,Parker A E,O'Neill L A. Toll-like receptors and NOD-like receptors in rheumatic diseases[J].ArthritisResTher, 2009,11(5):243.
[17] Motta V,Soares F,Sun T, et al. NOD-like receptors: versatile cytosolic sentinels[J].PhysiologicalReviews, 2015,95(1):149-78.
[18] 姚 丽,霍 红,韩 月,等.痛风性关节炎的生物标志物[J]. 中国药理学通报, 2012,28(10):1432-5.
[18] Yao L,Huo H,Liu J,et al. The biomarkers of gouty arthritis[J].ChinPharmacolBull, 2012,28(10):1432-5.
[19] 徐 熠,徐玲玲,刘 静,等.中药治疗慢性痛风性关节炎的规律及其Logistic回归分析[J]. 世界临床药物, 2013,34(8):469-71.
[19] Xu Y,Xu L L,Liu J, et al. Treatment regularity with traditional Chinese medicine for chronic gouty arthritis and its Logistic regression analysis[J].WorldClinicalDrugs, 2013,34(8):469-71.
[20] 佟金秋,马宝东,陈岩松.痛风内治法用药规律系统综述[J]. 实用中医内科杂志, 2013,27(10):1-2.
[20] Tong J Q, Ma B D, Chen Y S. The systematic review in external treatment medication rule of gout[J].JPracticalTraditChinIntMed, 2013,27(10):1-2.
[21] 孙 益,贾万贵,李象钧,等.基于数据挖掘技术的中医药治疗痛风临床用药分析研究[J]. 中国中医急症, 2014,23(1):58-9.
[21] Sun Y, Jia W G, Li X J, et al. Analysis research of TCM treatment experience in gout based on date mining technology[J].JEmergTraditChinMed, 2014,23(1):58-9.
[22] 潘碧琦, 潘建科, 刘 军, 等.基于关联规则和复杂系统熵聚类的痛风用药规律研究[J]. 中华中医药杂志, 2014,29(6):2040-3.
[22] Pan B Q, Pan J K, Liu J, et al. Analysis on medication rule in herbal prescriptions for gout based on apriori and clustering algorithm[J].ChinJTraditChinMedPharmacy, 2014,29(6):2040-3.
Effect of total saponin of Dioscorea on NALP3 inflammasome signaling pathway with acute gouty in rats
WANG Lu, NA Sha, CHEN Guang-liang
(ClinicalCollegeofIntegrativeMedicine,AnhuiUniversityofChineseMedicine,Hefei230038,China)
Aim To investigate the effects of total saponin of Dioscorea (TSD) on rats with monosodium urate crystal-induced acute gouty arthritis (AGA) and mechanisms. Methods Totally 72 Wistar rats were randomly devided into six groups, Each group was given corresponding drug before, then rat acute gouty arthritis model was made by injection of monosodium urate in the ankle joint cavity. The gait, articular swelling degree and physiological changes of rats were observed. The concentration of TNF-α,IL-1β,IL-18 in serum were detected by ELISA. The levels of pro-IL-1β, NALP3, ASC, pro-caspase-1, and cleaved caspase-1 were detected by Western blot. Results All TSD groups and colchicine significantly changed the gait of rats and TSD high and middle groups significantly reduced joint swelling and diminished the pathological changes. The levels of TNF-α,IL-1β,IL-18 in serum were significantly decreased, and the levels of pro-IL-1β, NALP3, ASC, pro-caspase-1 and cleaved caspase-1 were apparently reduced in TSD high and middle groups. Conclusion TSD possesses anti-gout function and the mechanism may be related to suppressing the NALP3 inflammasome activation and inhibiting the cytokine production.
total saponin of Dioscorea; acute gouty arthritis; MSU; NALP3; inflammasome; inflammatory cytokines
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.026.html
2016-10-13,
2016-12-18
国家自然科学基金资助项目(No 81573670)
王 璐(1992-),女,硕士生,研究方向:药物防治代谢性疾病,E-mail:wlulu0302@163.com; 陈光亮(1964-),男,博士,教授,博士生导师,研究方向:药物防治代谢性疾病,通讯作者,E-mail:chguangl@163.com
10.3969/j.issn.1001-1978.2017.03.013
A
1001-1978(2017)03-0354-07
R-332;R284.1;R364.5;R392.12;R589.7;R684.3
