白念珠菌HSP90的研究进展
2017-03-16孟靖顺赵静薛伟吴建华
孟靖顺 赵静 薛伟 吴建华
(1.上海长海医院,上海 200433;2.中国科学院大学,上海 200031)
·综述·
白念珠菌HSP90的研究进展
孟靖顺1赵静1薛伟2吴建华1
(1.上海长海医院,上海 200433;2.中国科学院大学,上海 200031)
调查表明白念珠菌已成为全球第4大致病菌并且有逐年上升的趋势,较多机构已开展白念珠菌致病机制的研究。相关研究表明白念珠菌的热休克蛋白90 (HSP90)能促进白念珠菌的形态变化以及耐药形成。本文从蛋白结构、客户蛋白、辅助因子等方面总结了白念珠菌HSP90在调控白念株菌形态变化以及耐药性形成方面的研究进展。
白念珠菌;HSP90;蛋白质结构;客户蛋白;耐药性
早期的研究发现,人体内的HSP90抑制剂格尔德霉素可以大大提高白念珠菌对抗真菌药的敏感性,近年来的研究也表明HSP90在真菌的矛盾生长、临床耐药以及致病侵袭力方面均具有重要作用[1]。本文中,笔者着重阐述有关HSP90的蛋白质结构、重要氨基酸位点、调控HSP90的部分基因序列、HSP90的关键辅助因子、HSP90客户蛋白的分类以及作用。
1 HSP90蛋白结构的相关研究发现
HSP90蛋白的结构变化对HSP90的功能有重要的作用。HSP90蛋白结构主要分为N端、Linker region (CL)、M区域以及C端。N端呈口袋状,其具有由α螺旋和β折叠形成的三明治结构的ATP的结合靶位可与ATP结合[2-3]。研究表明,N端关键氨基酸位点的突变能影响HSP90与ATP的结合速率 (ATPase cycle),从而导致HSP90与客户蛋白 (client protein)结合强度下降,包括部分耐药客户蛋白[4]。现已发现在人源HSP90的N端存在部分关键辅助因子与HSP90的结合结构域,如耐药辅助因子sgt1与HSP90结合的靶位——CS1结构域,其若遭到破坏会影响HSP90与sgt1的结合,从而导致HSP90失去激活部分耐药因子的功能[5]。CL则主要是连接N端与中间区域 (M domain)的部分,其在不同pH值下可改变HSP90自身的结构灵活性,进而影响HSP90部分辅助功能,例如HSP90与客户蛋白的结合[6-7]。CL部分氨基酸位点的突变能一定程度阻断HSP90与CPR7的结合,例如在白念珠菌模式生物酿酒酵母菌中,HSP90的CL部分突变会提高酿酒酵母对唑类药物的敏感性,但是CPR7参与的相关耐药机制与 CL区域之间的关系仍然有待深入研究;M区域在HSP90的结构和功能中发挥着重要作用,在人体HSP90中,M区域的α螺旋是HSP90与客户蛋白结合的结构基础;M164A关键位点的突变可以导致HSP90与蛋白CDC37 的结合强度下降[8];C端则对于白念珠菌HSP90二聚体的形成有至关重要的作用,其不仅包含了大量关键辅助因子靶位,还可能存在与ATP结合的区域。CPR7就是通过HSP90的C端末尾MEEVD区域与HSP90结合的。C端关键位点的突变可以引起HSP90的二聚体结构向单聚体结构转变。有研究人员通过热力实验发现,与白念珠菌同源性较高的人体HSP90 中,I692、Y689、L696等C端位点的突变会引起C端熔点下降,从而导致HSP90二聚体结构稳定性下降[9]。在人体中,HSP90的C端抑制剂已普遍运用在肿瘤治疗方面,例如使用抑制剂顺铂治疗肿瘤[10],这也提示HSP90蛋白C端的部分抑制可能在跟白念珠菌耐药性有关系。
2 HSP90中化学修饰的作用
真菌HSP90的主要化学修饰 (chemical modification)包括乙酰化 (acetylation)、磷酸化 (phosphorylation)和亚硝酸化。乙酰化主要发生在真菌HSP90的组蛋白和赖氨酸上。HSP90核心组蛋白的去乙酰化能够影响HSP90的转录和表达[11]。赖氨酸去乙酰化后通过改变HSP90与ATP的结合速率,抑制了HSP90与部分客户蛋白和辅助因子的结合。真菌HSP90中部分氨基酸位点的去乙酰化作用对改变真菌的耐药性有重要作用,例如酿酒酵母菌HSP90中K27的乙酰化突变能够提高HSP90对于格尔德霉素的敏感性,烟曲霉HSP90中K27的去乙酰化能提高烟曲霉对于唑类药物的敏感性。
HSP90的磷酸化和亚硝酸研究仍较局限,目前报道HSP90的磷酸化研究仅限于酿酒酵母和人体中。在酿酒酵母HSP90中S49,S288,T687磷酸化能够抑制HSP90对客户蛋白的折叠加工,YL24去磷酸化对HSP90 N端二聚体的形成和ATP速率的改变有重要作用;在人体中,C597的亚硝酸化能够降低HSP90与ATP的结合速率。
3 重要基因序列与HSP90的相互作用
基因片段的研究有利于帮助我们更直观地发现白念珠菌HSP90的调控功能及耐药机制。近年的研究发现,与白念珠菌HSP90存在相互作用的基因片段主要有两个部分。
一部分基因片段为独立的片段。通过基因芯片筛选发现白念珠菌基因库中有226个独立的基因片段与HSP90存在着受不同因素的调控、影响的相互作用[12]。例如,在高温高压下FCP3和HOF可使HSP90的表达上调,在耐药试验中HSP90能使AHR和FCR3的转录因子大量表达。其相互的作用机制主要有两个:①HSP90通过搬运部分基因序列附近的核小体或直接搬运基因片段的转录因子来提高它们的表达水平。②部分基因片段通过增减HSF1调控HSP90的表达水平,或是改变CK2磷酸酶对HSP90的化学修饰的强弱来影响HSP90与部分关键客户蛋白的结合[13]。
另一部分基因片段为HSP90内部序列。白念珠菌HSP90启动子的部分切除或置换能够影响HSP90的表达和功能。其切除部位和长度的不同对HSP90的功能和表达水平的有着不同的影响作用,近100bp的切除可使HSP90表达量下降,减弱其辅助功能,使得1,3-β-D-葡聚糖和蛋白磷酸酶的水平降低,减轻白念珠菌矛盾性生长和耐药现象[14]。中间50bp的置换对于HSP90的抑制作用最大,最新研究表明,启动子的中间50bp的置换使HSP90的表达大大降低,进而抑制了真菌耐药性的形成,总之基因序列的研究是发现HSP90引起耐药方面新途径的一重要的方法。
4 白念珠菌中HSP90的客户蛋白分类
HSP90在真菌中主要通过客户蛋白 (client protein)起作用,研究表明菌中有20%的蛋白组 (proteome)是HSP90的客户蛋白,在耐药形成过程中这些客户蛋白目前主要分为4大类。①耐药因子:HSP90的耐药客户蛋白主要有直接参与耐药通路的蛋白磷酸酶和Mkc1。HSP90能够激活蛋白磷酸酶的亚基CNA1、CNA2[15]在耐药通路中起作用;白念珠菌中,HSP90直接与Mkc1 (见图1)结合并通过转运以及折叠使Mkc1与swi6相互作用,swi6能够促使真菌耐药的形成以及菌丝的生长。研究发现,蛋白磷酸酶的耐药通路和Mkc1的耐药通路间可能存在相互作用和互补,一条通路的抑制能够增强另外一条通路的活性,研究还表明存在一种未知蛋白连接这两条通路,未知蛋白的缺失会导致两条通路的阻断[16]。②转录因子:HSF1既是HSP90的客户蛋白也是HSP90的转录因子[17],在高温环境下HSF1失去与HSP90的结合能力会使HSP90的大量转录而导致真菌形成耐药,其他转录因子则通过HSP90的转运使真菌更具有活力,如TAC1参与真菌的药物反应,CAP1主要参与的氧化应激,APA2参与的细胞壁的构建。③HSP90的调控蛋白:CK2作为HSP90的客户蛋白是一种蛋白磷酸酶[18],它能通过几个亚基调控HSP90的功能和表达转录水平。如催化亚基Cka1和Cka2起到调控HSP90转录表达的作用,调节亚基CKb1和Ckb2能使HSP90发生磷酸化改变。④RNA:HSP90在人体中对于microRNA的转运折叠加工有重要作用,对于piRNA的募集也有重要作用,研究发现HSP90的缺失会引起microRNA和piRNA转录水平的下降,但具体机制仍需研究。
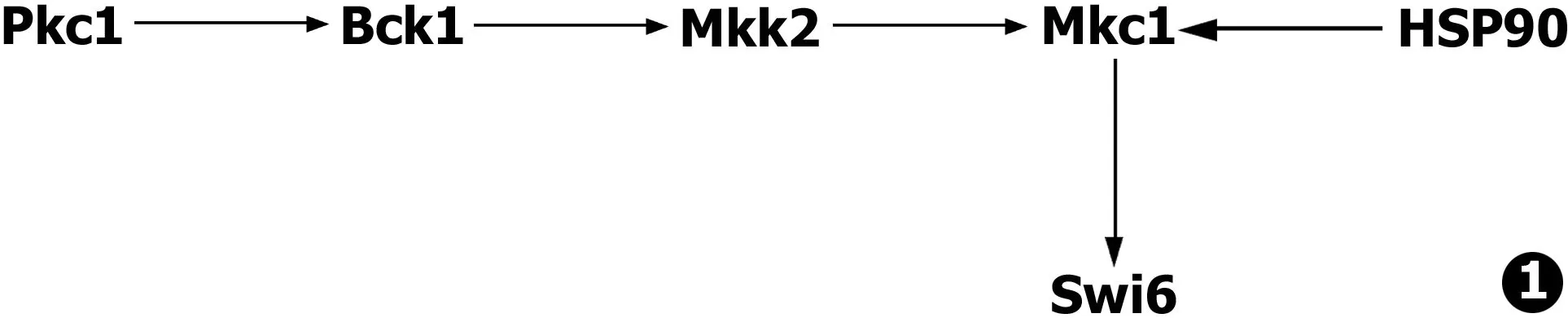
图1 白念珠菌HSP90通过Mkc1耐药机制模式图
Fig.1 HSP90 ofCandidaalbicananticipate the resistance mechanism by Mkc1
5 影响客户蛋白与HSP90相互结合的因素
目前来说客户蛋白与HSP90相互作用机制仍未明了。近年研究表明,主要有4个因素影响了HSP90与客户蛋白的结合。①结构的完整性:HSP90 M区域是HSP90与客户蛋白结合的主要区域,M区域的α螺旋结构的完整性直接影响HSP90与客户蛋白的结合,C端部分序列的突变可以影响蛋白二聚体结构的稳定性,而二聚体结构的缺失导致HSP90失去与客户蛋白的结合能力。②辅助因子:白念珠菌中辅助因子sgt1能够使HSP90与客户蛋白特异性结合,实验发现当敲除sgt1后HSP90不能与菌丝生长因子cry1结合[19]。③环境因素:在不同环境中HSP90会与不同的客户蛋白结合,在热激环境下HSP90与Mkc1蛋白结合[20],在NaCl高盐的环境下HSP90主要主要与HOG1结合,其内在选择机制仍有待研究。④ATP:ATP与HSP90的N端结合,为HSP90与客户蛋白的结合提供能量,ATP的代谢对HSP90有重要的作用,若其停止会导致HSP90不能与客户蛋白结合,但ATP代谢速率的过慢对于HSP90与客户蛋白是否起到抑制作用仍需研究。
6 HSP90与辅助因子的相互作用
真菌HSP90的辅助因子主要分为两种作用。一是能够影响HSP90与ATP的结合速率。例如,结合在HSP90 N端的Sba1能够加快HSP90和ATP的结合速率[21],其内在机制可能与结合的氨基酸位点的作用有关;CDC37能抑制人源HSP90中ATP口袋的水解环的形成阻止水解口袋的关闭影响ATPpase的进程[22],二是影响HSP90与客户蛋白的结合,MTaipale团队通过Quantitative Analysis实验和LUMIER测定证实了CDC37是HSP90与客户蛋白结合的中间桥梁,最后研究还发现sgt1是帮助HSP90参与耐药的重要因子,sgt1主要结合在HSP90的N端后通过增加蛋白磷酸酶亚基Cna1活性来增强耐药,实验已证明sgt1的敲除能够增强真菌对于唑类药物的敏感性减缓菌丝的生长。总之在真菌中有更多的辅助因子通过HSP90对白念珠菌的生长耐药等各方面起到重要作用,我们需要不断的了解和发现这些关键的辅助因子。
7 小 结
我们对于真菌HSP90的研究工作已日益完善,但是仍有一部分HSP90引起的致病机制尚未清楚。白念珠菌HSP90蛋白水平的化学修饰对HSP90与其耐药辅助因子结合的影响仍未明了。辅助因子在调控HSP90方面有重要作用,发现和研究更多有关耐药的HSP90辅助因子具有重要意义。客户蛋白是白念珠菌HSP90在体内发挥作用的重要部分,目前我们对于引起耐药的客户蛋白与HSP90的结合机制不是很明确。在结构方面HSP90 C端二聚位点的研究仍较局限,C端的深入研究对于了解HSP90结构变化与功能之间的联系有重要作用。
[1] Cowen LE.The fungal Achilles' heel:targeting Hsp90 to cripple fungal pathogens[J].Curr Opin Microbiol,2013,16(4):377-384.
[2] Taipale M,jarosz DF,Lindquist S.HSP90 at the hub of protein homeostasis:emerging mechanistic insights[J].Nat Rev Mol Cell Biol,2010,11(7):515-528.
[3] Blacklock K,Verkhivker GM.Computational modeling of allosteric regulation in the hsp90 chaperones:a statistical ensemble analysis of protein structure networks and allosteric communications[J].PLoS Comput Biol,2014,10(6):e1003679.
[4] Leach MD,Klipp E,Cowen LE,et al.Fungal Hsp90:a biological transistor that tunes cellular outputs to thermal inputs[J].Nat Rev Microbiol,2012,10(10):693-704.
[5] Blacklock K,Verkhivker GM.Allosteric regulation of the Hsp90 dynamics and stability by client recruiter cochaperones:protein structure network modeling[J].PLoS One,2014,9(1):e86547.
[6] Jahn M,Rehn A,Pelz B,et al.The charged linker of the molecular chaperone Hsp90 modulates domain contacts and biological function[J].Proc Natl Acad Sci U S A,2014,111(50):17881-17886.
[7] Zuehlke AD,Johnson JL.Chaperoning the chaperone:a role for the co-chaperone Cpr7 in modulating Hsp90 function inSaccharomycescerevisiae[J].Genetics,2012,191(3):805-814.
[8] Synoradzki K,Bieganowski P.Middle domain of human Hsp90 isoforms differentially binds Aha1 in human cells and alters Hsp90 activity in yeast[J].Biochim Biophys Acta,2015,1853(2):445-452.
[9] Ciqlia E,Verqin J,Reimann S,et al.Resolving hot spots in the C-terminal dimerization domain that determine the stability of the molecular chaperone Hsp90[J].PLoS One,2014,9(4):e96031.
[10] Zhao H,Garq G,Zhao J,et al.Design,synthesis and biological evaluation of biphenylamide derivatives as Hsp90 C-terminal inhibitors[J].Eur J Med Chem,2015,89:442-466.
[11] Veri A,Cowen LE.Progress and prospects for targeting Hsp90 to treat fungal infections[J].Parasitology,2014,141(9):1127-1137.
[12] Diezmann S,Leach MD,Cowen LE.Functional divergence of Hsp90 genetic interactions in biofilm and planktonic cellular states[J].PLoS One,2015,10(9):e0137947.
[13] Khurana N,Bhattacharyya S.Hsp90,the concertmaster:tuning transcription[J].Front Oncol,2015,5:100.
[14] Lamoth F,Juvvadi PR,Gehrke C,et al.Transcriptional activation of heat shock protein 90 mediated via a proximal promoter region as trigger of caspofungin resistance inAspergillusfumigatus[J].J Infect Dis,2014,209(3):473-481.
[15] Singh SD,Robbins N,Zaas AK,et al.Hsp90 governs echinocandin resistance in the pathogenic yeastCandidaalbicansvia calcineurin[J].PLoS Pathog,2009,5(7):e1000532.
[16] LaFayette SL,Colins C,Zaas AK,et al.PKC signaling regulates drug resistance of the fungal pathogenCandidaalbicansvia circuitry comprised of Mkc1,calcineurin,and Hsp90[J].PLoS Pathog,2010,6(8):e1001069.
[17] Leach MD,Budge S,Walker L,et al.Hsp90 orchestrates transcriptional regulation by Hsf1 and cell wall remodelling by MAPK signalling during thermal adaptation in a pathogenic yeast[J].PLoS Pathog,2012,8(12):pe1003069.
[18] Zhao R,Davey M,Kaplanek P,et al.Navigating the chaperone network:an integrative map of physical and genetic interactions mediated by the hsp90 chaperone[J]Cell,2005.120(5):715-727.
[19] Shapiro RS,Zaas AK,Betancourt-Qurioz M,et al.The Hsp90 co-chaperone Sgt1 governsCandidaalbicansmorphogenesis and drug resistance[J].PLoS One,2012,7(9):e44734.
[20] Robbins N,Uppuluri P,Nett J,et al.Hsp90 governs dispersion and drug resistance of fungal biofilms[J].PLoS Pathog,2011.7(9):e1002257.
[21] Graf C,Lee CT,Eva Meier-Andrejszki L,et al.Differences in conformational dynamics within the Hsp90 chaperone family reveal mechanistic insights[J].Front Mol Biosci,2014,1:4.
[22] Smith JR,et al.Restricting direct interaction of CDC37 with HSP90 does not compromise chaperoning of client proteins[J].Oncogene,2013,34(1):15-26.
[本文编辑] 施 慧
973子课题 (2013CB531602)
孟靖顺,男 (汉族),硕士研究生在读.E-mail:1781069890@qq.com
吴建华,E-mail:wujh_ch@163.com
R 379.4
B
1673-3827(2017)12-0058-04
2016-06-22
