谷氨酸转运体和γ-氨基丁酸转运体在脑缺血模型中的表达意义
2017-03-15魏子龙王之涵邱永明林盈盈
任 力, 邢 进, 魏子龙, 王之涵, 赵 亮,邱永明, 林盈盈
(1. 上海市浦东医院 神经外科, 上海, 201399;2. 上海交通大学附属仁济医院 神经外科, 上海, 200127)
谷氨酸转运体和γ-氨基丁酸转运体在脑缺血模型中的表达意义
任 力1, 邢 进1, 魏子龙1, 王之涵1, 赵 亮1,邱永明2, 林盈盈2
(1. 上海市浦东医院 神经外科, 上海, 201399;2. 上海交通大学附属仁济医院 神经外科, 上海, 200127)
目的 探讨谷氨酸转运体和γ-氨基丁酸转运体在脑缺血模型中的表达意义。方法 在体内缺血、体外缺氧2种模型中利用免疫荧光、Westen-blot、RT-PCR等技术定性定量的检测主要的谷氨酸转运体-1(EAAC-1)和γ-氨基丁酸转运体-1(GAT-1)的表达情况。结果 在局灶性脑缺血模型(大鼠脑中动脉缺血模型)和缺氧条件下培养的原代神经元中均发现, EAAC1表达下降, GAT1表达上升。结论 在脑缺血缺氧状态下EAAC1表达下降, GAT1表达上调。
脑缺血; 缺氧; 谷氨酸转运体1; γ-氨基丁酸转运体1
缺血缺氧是导致癫痫、中风等神经生理疾病发生的主要原因之一,具有较高致死率、致残率[1]。L-谷氨酸因脑缺血缺氧过度释放,导致中枢神经系统神经元死亡[2]。同时, γ-氨基丁酸(GABA)受体活化以抑制L-谷氨酸过度释放[3]。GABA转运体与谷氨酸转运体协同作用,共同维持细胞外GABA和谷氨酸的含量,参与正常神经元活动及大脑的多种病理状态[4]。目前,关于这两种氨基酸转运体在脑缺血性疾病中的具体表达尚不明确。本研究通过建立大鼠脑中动脉缺血(MCAO)模型,探讨谷氨酸转运体-1(EAAC-1)及γ-氨基丁酸转运体-1(GAT-1)在体内外缺血缺氧条件下的表达情况。
1 材料与方法
1.1 大鼠MCAO模型的建立
健康成年雄性SD大鼠16只,体质量250~300 g, 由上海交通大学医学院动物实验中心提供,食物和水随意提供,设置12、12 h日夜周期。本研究采用的动物实验研究通过动物实验伦理委员会的批准,并依据上海交通大学医学院的动物实验指南进行。
SD大鼠随机分为对照组(手术但无栓塞)与观察组,每组8只。观察组脑缺血24 h后腹腔注射50 mg/kg戊巴比妥钠麻醉,按照文献[4]对大鼠进行再灌注。具体操作如下: 1根单丝尼龙线与热处理后的圆尖通过颈外动脉引入右颈内动脉,直到到达一个轻微的阻力处,维持90 min后撤回,以便再灌注。再灌注开始的特定时间,采用戊巴比妥钠腹腔注射100 mg/kg将动物深度麻醉。大鼠心脏灌流4 ℃生理盐水后,在冰上解剖获取相应的缺血中心区和半暗带区脑组织,用于组织mRNA和蛋白的分析。大鼠心脏灌注4 ℃生理盐水后, 4%多聚甲醛(pH=7.4)灌流固定脑组织。取脑组织, 4% PFA固定,低温保存于20%、30%蔗糖溶液中。在-1.80和-4.80 mm间的前囟水平行连续冠状切片,共收集24个切片进行染色。
1.2 细胞培养
原代神经元在含有10% FBS(PAA,Linz,Austria)DMEM中培养,置于5% CO2、37℃的细胞培养箱中。为模拟体内缺氧环境,将细胞接种于10 cm培养皿中,用CoCl2处理培养的神经元24、48 h后,采用免疫印迹法和RT-PCR法观察EAAC1和GAT1的表达情况。
1.3 免疫荧光
采用4%多聚甲醛于4 ℃下固定含有细胞的玻片15 min, 并使用含有0.1%皂素、1%羊血清或2%驴血清的PBS溶液室温下孵育30 min。加入相应的小鼠EAAC1、GAT1一抗,稀释500倍, 4 ℃孵育过夜。吸去一抗,洗涤玻片,使用Alexa-Fluor-488标记的山羊抗兔荧光二抗,室温避光孵育2 h。激光共聚焦显微镜下观察。
1.4 实时荧光定量PCR
Trizol法抽提RNA, 并用DNA酶去除样本中的DNA。使用RNA反转录试剂盒合成cDNA, GAPDH作为引物内参。实时荧光定量PCR使用 SYBR Green PCR Master Mix试剂盒,重复3次,采用7900HT快速实时PCR机进行分析。
1.5 免疫印迹分析法
使用含有蛋白酶抑制剂和磷酸化抑制剂的RIPA裂解液提取蛋白。吸取适量蛋白上样至10%~15%聚丙烯酰胺凝胶,转膜至硝酸纤维素膜。一抗孵育过夜,适当浓度的二抗孵育1 h。添加ECL化学发光显影液,使用柯达胶片曝光。一抗为EAAC1、GAT1, Actin为蛋白内参。
2 结 果
2.1 EAAC1、GAT1在大鼠MCAO再灌注模型半暗带区的表达
采用免疫荧光法观察EAAC1、GAT1在半暗带区的表达,结果显示,观察组再灌注24 h后, EAAC1蛋白表达相比于对照组明显减少, GAT1蛋白表达相比于对照组增加。见图1。
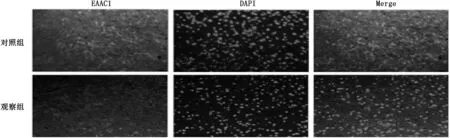
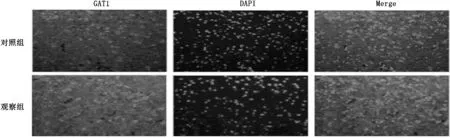
图1 大鼠脑中动脉缺血再灌注模型中EAAC1和GAT1表达
2.2 EAAC1、GAT1在缺氧刺激下的神经元中的表达
CoCl2处理24、48 h后,神经元EAAC1蛋白表达下调,并呈时间依赖性(图2A), GAT1蛋白表达上调(图2B); RT-PCR法检测EAAC1和GAT1的mRNA水平, CoCl2处理24、48 h后, EAAC1 mRNA水平下调(图2C), GAT1 mRNA水平上调(图2D)。见图2。



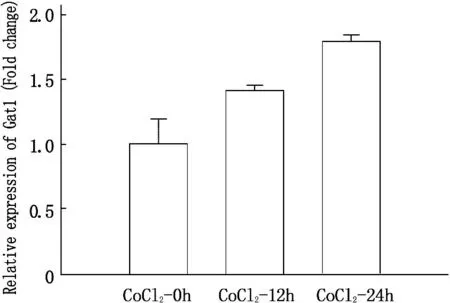
图2 EAAC1和 GAT1在缺氧诱导的神经元中的表达
3 讨 论
脑缺血再灌注损伤由多因素共同作用所致,其中兴奋性氨基酸毒性、梗死周围去极化、炎症和凋亡是引起神经元死亡的主要病理生理机制,构成了脑缺血再灌注损伤的级联反应[5-6]。谷氨酸为兴奋性神经递质,具有神经毒性作用。GABA为抑制性神经递质,具有神经保护作用。GABA转运体和谷氨酸转运体是中枢神经系统重要的转运蛋白,参与大脑多种病理状态,尤其是脑缺血性疾病和癫痫[7-8]。谷氨酸转运体家族含5个成员,分别是GLAST/EAAT1、GLT-1/EAAT2、EAAC1/EAAT3、EAAT4和EAAT5[9]。研究[10-11]证明,消除GLT-1的小鼠发生严重癫痫,可见GLT-1在中枢神经系统中发挥重要作用。与GLT-1相比,EAAC1在神经元死亡中的作用尚未明确。除了介导细胞外谷氨酸转运,最新研究[12]发现EAAC1可作为半胱氨酸转运体从而发挥作用,并维持神经元的谷胱甘肽代谢。因此,推测EAAC1可能在维持谷氨酸转运外,还发挥着其他重要的作用。钠-氯离子依赖性GAT1主要负责将GABA从神经传递的突触间隙去除,从而终止了GABA神经传递的作用[13]。
本研究中, EAAC1在局灶性脑缺血MCAO模型及缺氧条件下培养的原代神经元中的表达均降低, GAT-1的表达轻度升高,与国内研究[14]结果一致。可见脑缺血再灌注后谷氨酸的神经毒性及GABA的神经保护作用, EAAC-1可通过调节谷氨酸水平保护神经元损伤。本研究还发现, CoCl2处理后,大量的神经元凋亡,可见缺氧和能量不足所致的细胞凋亡是脑缺血缺氧损伤的重要发病机制。
[1] Roger V L, Go A S, Lloyd-Jones D M, et al. Heart Disease and Stroke Statistics-2011 Update:A Report From the American Heart Association[J]. Circulation, 2010, 123(4): e18-e209.
[2] Kostandy B B. The role of glutamate in neuronal ischemic injury: the role of spark in fire[J]. Neurol Sci, 2012, 33(2): 223-237.
[3] Hutchinson P J, O′Connell M T, Al-Rawi P G, et al. Increases in GABA concentrations during cerebral ischaemia: a microdialysis study of extracellular amino acids[J]. J Neurol Neurosurg Psychiatr, 2002, 72(1): 99-105.
[4] 毛小元, 蔡际群. γ-氨基丁酸转运体与癫痫关系的研究进展[J]. 国际神经病学神经外科学杂志, 2009, 36(3): 261-264.
[5] 杨娟. 谷氨酸转运体与癫痫关系的研究进展[J]. 中风与神经疾病杂志, 2012, 29(4): 377-379.
[6] Jiang J, Amara S G. New views of glutamate transporter structure and function: advances and challenges[J]. Neuropharmacology, 2011, 60(1): 172-181.
[7] Watanabe T, Morimoto K, Hirao T, et al. Amygdala-kindled and pentylenetetrazole-induced seizures in glutamate transporter GLAST-deficient mice[J]. Brain Res, 1999, 845(1): 92-96.
[8] Li L, Zuo Z. Glutamate transporter type 3 knockout reduces brain tolerance to focal brain ischemia in mice[J]. J Cereb Blood Flow Metab, 2011, 31(5): 1283-1292.
[9] 金亦涛, 刘国卿, 唐治华. γ-氨基丁酸转运体研究进展[J]. 国外医学: 生理、病理科学与临床分册, 2004, 24(1): 8-10.
[10] Bianchi M G, Bardelli D, Chiu M, et al. Changes in the expression of the glutamate transporter EAAT3/EAAC1 in health and disease[J]. Cell Mol Life Sci, 2014, 71(11): 2001-2015.
[11] 刘青青, 郭虹, 王少峡, 等. 脑缺血损伤机制的研究进展[J]. 中华中医药学刊, 2012, 30(6): 1228-1230.
[12] Lussier A L, Romay-Tallon R, Caruncho H J, et al. Altered GABAergic and glutamatergic activity within the rat hippocampus and amygdala in rats subjected to repeated corticosterone administration but not restraint stress[J]. Neuroscience, 2013, 231: 38-48.
[13] Smith K S, Rudolph U. Anxiety and depression: mouse genetics and pharmacological approaches to the role of GABA(A) receptor subtypes[J]. Neuropharmacology, 2012, 62(1): 54-62.
[14] 陈魁, 胡风云. 电针水沟穴对全脑缺血昏迷大鼠脑组织谷氨酸转运体-1γ-氨基丁酸转运体-1的影响[J]. 山西医药杂志: 上半月, 2013, 42(5): 501-503.
Significance of expressions of glutamate transporters and γ-aminobutyric acid transporters in rat model with cerebral ischemia
REN Li1, XING Jin1, WEI Zilong1, WANG Zhihan1, ZHAO Liang1,QIU Yongming2, LIN Yingying2
(1.DepartmentofNeurosurgery,ShanghaiPudongHospital,Shanghai, 201399; 2.DepartmentofNeurosurgery,RenjiHospitalAffiliatedtoShanghaiJiaotongUniversity,Shanghai, 200127)
Objective To explore the significance of expressions of glutamate transporters and γ-aminobutyric acid transporters in the rat model with cerebral ischemia. Methods The detections of the expressions of glutamate transporter-1 (EAAC-1) and γ-aminobutyric acid transporter -1 (GAT-1) in models with ischemia in vivo and hypoxia in vitro were performed by immunofluorescence, Westen-blot and real-time polymerase chain reaction (RT-PCR) methods. Results The expression of EAAC1 was reduced in the cerebrum of focal cerebral ischemic MACO rat model as well as in primary neurons cultured under hypoxia. The expression of GAT1 was elevated. Conclusion EAAC1 expression decreases while GAT1 expression increases under condition of cerebral ischemia and anoxia.
cerebral ischemia; anoxia; glutamate transporter-1; γ-aminobutyric acid transporter -1
2016-11-20
上海市卫生和计划生育委员会面上项目(201540412); 上海市卫生和计划生育委员会中医药科研基金
魏子龙, E-mail: weizilong2007@163.com
R 743
A
1672-2353(2017)03-048-04
10.7619/jcmp.201703015
课题(2014JP025A); 上海市浦东新区卫生系统重点专科建设项目(PWZz2013-18)
