冠心病合并糖代谢异常患者血清不对称二甲基精氨酸、脂联素及Apelin水平的变化
2017-03-15彭文芳夏莉莉汤瑜斌邹大进
黄 珊, 彭文芳, 夏莉莉, 汤瑜斌, 邹大进
(1. 第二军医大学附属长海医院 内分泌代谢科, 上海, 200433;2. 上海交通大学附属同仁医院 内分泌代谢科, 上海, 200336)
论 著
冠心病合并糖代谢异常患者血清不对称二甲基精氨酸、脂联素及Apelin水平的变化
黄 珊1, 2, 彭文芳2, 夏莉莉2, 汤瑜斌2, 邹大进1
(1. 第二军医大学附属长海医院 内分泌代谢科, 上海, 200433;2. 上海交通大学附属同仁医院 内分泌代谢科, 上海, 200336)
目的 探讨合并冠心病的糖代谢异常患者血清不对称二甲基精氨酸(ADMA)、脂联素(APN)及Apelin水平的变化。方法 选取临床疑似冠心病并行选择性冠状动脉造影(CAG)检查患者,根据口服糖耐量试验分为冠心病合并糖耐量异常(CHD+IGT)组30例,冠心病合并2型糖尿病(CHD+DM)组32例,单纯冠心病(CHD)组28例,正常对照组(NC)33例。测定ADMA、APN、Apelin、血脂、胰岛素水平,并计算BMI及HOMA-IR。测定Gensini积分。结果 CHD+IGT组及CHD+DM组的BMI指数显著高于NC组(P=0.000); CHD+DM组的FPG显著高于NC组和CHD组(P=0.000); CHD+IGT组及CHD+DM组的PPG显著高于NC组和CHD组(P=0.000); CHD+IGT组及CHD+DM组的FINS、HOMA-IR均显著高于NC组(P<0.05); CHD+IGT组及CHD+DM组的APN显著低于NC组(P<0.05); CHD+IGT组及CHD+DM组的ADMA、Apelin均显著高于NC组及CHD组(P=0.000); CHD+IGT组及CHD+DM组的Gensini积分显著高于NC组(P<0.05); 以Gensini积分为应变量,多因素逐步回归分析表明ADMA、APN和Apelin是其主要独立相关影响因素。结论 高ADMA、Apelin和低APN水平相比于其他因素能更为敏感地预测糖尿病大血管病变的严重程度。
冠心病; 糖代谢异常; 不对称二甲基精氨酸; 脂联素; Apelin; Gensini积分
冠心病(CAHD)是指冠状动脉粥样硬化使管腔狭窄或阻塞,或(和)因冠状动脉功能性改变(痉挛),导致心肌缺血、缺氧或坏死而引起的心脏病[1]。UKPD等[2]研究证实,在糖代谢异常阶段已导致大血管病变的发生,且远远高于正常糖代谢人群。研究[3]显示,中国冠心病住院患者中约3/4合并糖代谢异常,因此IGT阶段和糖尿病(DM)都被视为心血管病的高危因素。ADMA 作为内源性一氧化氮合酶(NOS)抑制剂,竞争性地抑制NOS活性,被认为是动脉粥样硬化早期特征性改变及其发生的始动因素[4]。脂联素(APN)在糖尿病血管并发症的发生发展中可能起保护作用[5], 而Apelin作为一种新近发现的脂肪因素,参与调控体内能量代谢,在糖尿病血管保护中可能具有重要作用[6]。本研究比较冠心病合并糖代谢异常者血清ADMA、APN及Apelin的水平,了解其在糖代谢异常不同阶段的变化及其在糖尿病大血管病变中的意义,现报告如下。
1 资料与方法
1.1 一般资料
选取临床疑似冠心病而入院行冠状动脉造影术患者,均接受选择性冠状动脉造影(CAG)检查,并行口服糖耐量试验,根据1999年WHO诊断标准,按照是否合并糖代谢异常分为3个亚组:冠心病合并糖耐量异常(CHD+IGT)组30例,冠心病合并2型糖尿病(CHD+DM)组32例,单纯冠心病(CHD)组28例。心导管检查前所有患者均签署手术知情同意书。同时选择同期来本院健康体检中心体检的年龄、性别相匹配的健康者33例为正常对照组(NC)。所有入选对象均排除肝、肾、甲状腺疾病,急性代谢紊乱、心功能衰竭、感染、自身免疫性疾病或结缔组织疾病、肿瘤及既往曾接受过PTCA 或CABG治疗者。并未使用影响胰岛素分泌和胰岛素抵抗的药物。
1.2 诊断及分类标准
冠心病的诊断标准:临床症状、心电图、冠脉造影提示左前降支(LAD)、左回旋支 (Lcx)和右冠状动脉(RCA) 3支主要冠状动脉中至少1支直径狭窄全50%。采用 1999 年世界卫生组织(WHO)分类诊断标准:空腹血糖调节受损(IFG), FPG 6.1~<7.0 mmol/L, 服糖后 2 h PG<7.8 mmol/L; 糖耐量减低(IGT), FPG<6.1 mmol/L, 服糖后2 h PG≥7.8 mmol/L~<11.1 mmol/L; 空腹血糖受损合并糖耐量减低(IFG +IGT), FPG 6.1~<7.0 mmol/L, 服糖后 2 h PG≥7.8mmol/L~< 11.1 mmol/L。高血压定义为收缩压(SBP)≥140 mmHg和/或舒张压(DBP)≥90 mmHg。
1.3 方法
每例受试者空腹8~10 h后于次日晨8点做75 g葡萄糖耐量试验,所有入选者在抽取上述静脉血标本同时,留取2 mL静脉血,以2%EDTA抗凝后离心15 min, 转速3 000 r/min, 留取上清液血浆0.5 mL, 放置-80 ℃冰箱保存,采用葡萄糖氧化酶法测定,在美国贝克曼全自动生化仪上完成。同时空腹检测甘油三脂(TG)、胆固醇(TC)、高密度脂蛋白-胆固醇(HDL-c)、低密度脂蛋白-胆固醇(LDL-c)、脂蛋白a(Lpa)、空腹胰岛素水平(FINS)。采用ELISA法测定APN, 试剂盒购自美国Linco公司; 采用ELISA法检测Apelin, 试剂盒购自美国Phoenix Pharmaceutical公司; 采用双抗夹心ELISA法检ADMA, 试剂盒购自Biocheck公司。每例受试者均测体质量(kg)、身高(m)、血压(mmHg), 计算每位患者的体质量指数BMI(kg/m2)。评价胰岛素抵抗指标,计算胰岛素抵抗指数HOMA-IR=(FINS×FPG)/22.5。
使用GE INNOVA3100血管造影机,以Judkins法[4]常规穿刺右股或右挠动脉,进行选择性冠脉血管造影。左冠状动脉至少投照5个体位,右冠状动脉至少投照2个体位,必要时加做其他体位至冠状动脉各段能够充分显示,造影结果的判断由2名经验丰富的冠脉介入医师完成,取平均值。使用Gensini积分系统对左主干、左前降支、左回旋支及右冠脉的每支每处病变进行评分,以各支病变处的积分和作为该患者的冠脉狭窄程度的总积分。
Gensini积分系统:每支冠脉血管病变狭窄程度行定量评定,即狭窄程度以最严重处为积分标准,狭窄直径<25%计1分, ≥25%~<50%计2分, ≥50%~<75%计4分, ≥75%~<90%计8分, ≥90%~<99%计16分, ≥99%计32分,根据不同冠脉分支将以上得分乘以相应系数。左主干病变: 5; 左前降支病变:近端2.5, 中段1.5; 对角支病变:第一对角支1, 第二对角支0.5; 左回旋支病变:近端2.5, 远端1, 后降支1, 后侧支1; 右冠状动脉病变:近、中、远和后降支均1。
1.4 统计学方法
统计软件运用Stata 11.0软件,所有统计检验均采用双侧检验,显著性水平取0.05, 所有P值精确到小数点后3位,运用Kolmogorov-Simrnov统计学检验方法进行数据正态性检验,正态分布的定量变量:t检验, wilcoxn检验,单因素方差分析(One-Way ANOVA), 非正态分布的定量变量: Kruskal-Wallis检验,分类变量以例数(百分比)表示,采用χ2检验,不同变量间相关性检验采用Pearson、Spearman检验、多元线性逐步回归; 要求校正某些特殊变量影响时使用偏相关分析(Partial)。
2 结 果
各组间年龄、性别、TC、TG、HDL-c、LDL-c、吸烟率及高血压阳性率比较,差异无统计学意义(P>0.05)。CHD+IGT组及CHD+DM组的BMI指数高于NC组,差异有统计学意义(P=0.000), CHD组的BMI指数亦显著高于NC组(P=0.031)。CHD+DM组的FPG高于NC组和CHD组,差异有统计学意义(P=0.000), CHD+IGT的FPG显著高于NC组(P<0.05)。CHD+IGT组及CHD+DM组的PPG高于NC组和CHD组,差异有统计学意义(P=0.000)。CHD+IGT组及CHD+DM组的FINS高于NC组,差异有统计学意义(P<0.05)。CHD+IGT组及CHD+DM组的HOMA-IR高于NC组,差异有统计学意义(P=0.000), CHD+IGT组及CHD+DM组的HOMA-IR高于CHD组,差异有统计学意义(P<0.05); CHD+IGT组及CHD+DM组的APN明显低于NC组,差异有统计学意义(P<0.05); CHD+IGT组及CHD+DM组的ADMA、Apelin均高于NC组及CHD组,差异均有统计学意义(P=0.000); CHD+IGT组及CHD+DM组的Gensini积分高于NC组,差异均有统计学意义(P<0.05), CHD+DM组Gensini积分显著高于CHD组(P=0.012)。见表1。
Gensini积分与APN(r=-0.682,P=0.000)负相关,与BMI、PPG、FIN、HOMA-IR、ADMA、Apelin呈正相关(r=0.648、0.653、0.469、0.615、0.830、0.669,P=0.000)。见表2。以Gensini积分为应变量, 4组间比较有差异的BMI、FPG、PPG、FINS、HOMA-IR、Apelin、ADMA和APN等影响因素为连续变量进行多因素逐步回归分析, ADMA、APN和Apelin进入回归方程:Y=0.536+4.106ADMA-0.561APN+0.027Apelin, 结果表明Gensini积分的主要独立相关影响因素为ADMA、APN和Apelin, 见表3。
3 讨 论
冠心病冠脉粥样硬化的病因是复杂的,各种因素致血管内皮细胞损伤,通透性被破坏, LDL、VLDL渗入内皮下,巨噬细胞吞噬后变为泡沫细胞,形成早期的脂质条纹。如内皮被继续损伤,内皮细胞和巨噬细胞则分泌大量的细胞因子、生长因子、粘附分子,致使被趋化和活化的巨噬细胞吞噬脂质增多,并动员平滑肌细胞成为泡沫细胞,最后局部炎症纤维化,形成以“纤维帽”覆盖的内核为特征的典型斑块结构,同时伴有中层平滑肌细胞增生,引起血管狭窄和粥样硬化。
高血糖引发一系列不良反应,包括加重胰岛素抵抗、增强葡萄糖氧化应激反应,加重内皮功能障碍和低度的血管炎症反应,导致脂代谢异常、凝血功能异常、纤溶活性降低、降低动脉粥样硬化斑块稳定性等。此外,高血糖还可上调转录核因子-kβ, 而核因子-kβ正是调控和激活与炎症过程相关的基因转录和表达的关键,这些改变与心血管疾病的发病密切相关,是动脉粥样硬化发生的危险因素。内皮功能异常是大血管病变的重要原因,内皮细胞损伤是动脉粥样硬化病理过程中的早期改变。高血糖导致的高胰岛素血症、高脂血症、脂质过氧化均可导致内皮功能受损。内皮细胞是覆盖在血管腔、心瓣膜内壁的单层细胞,功能和结构完善的内皮细胞对维持血管功能至关重要,它不但可主动地调节血管张力,还维持血管对大分子及白细胞的通透性,将之局限在很狭小的范围内,且内皮还可调节血管壁的增殖过程,凝血和纤溶间易变的平衡; 调节内皮下基质的结构。同时是具有旁分泌、自分泌功能的器官,在完成上述功能过程中,内皮可生成各种调节介质,这些调节因子调控血管的收缩和舒张,维持两种对立情况下的相对均衡,从而保证内皮功能的正常。在高血糖时,内皮损伤参与了动脉粥样硬化的形成[7-10]。本研究显示反映冠脉病变严重程度的Gensini积分从NC-CHD-IGT+CHD-DM+CHD逐渐增高, IGT+CHD、DM+CHD组与NC组和CHD组差异均有统计学意义,相关分析发现Gensini积分与空腹血糖无相关,而与餐后2 h血糖水平显著正相关,可见早在IGT阶段冠脉血管弥漫病变就己经存在,二者平行进展,这正与既往研究结果相一致[11]。
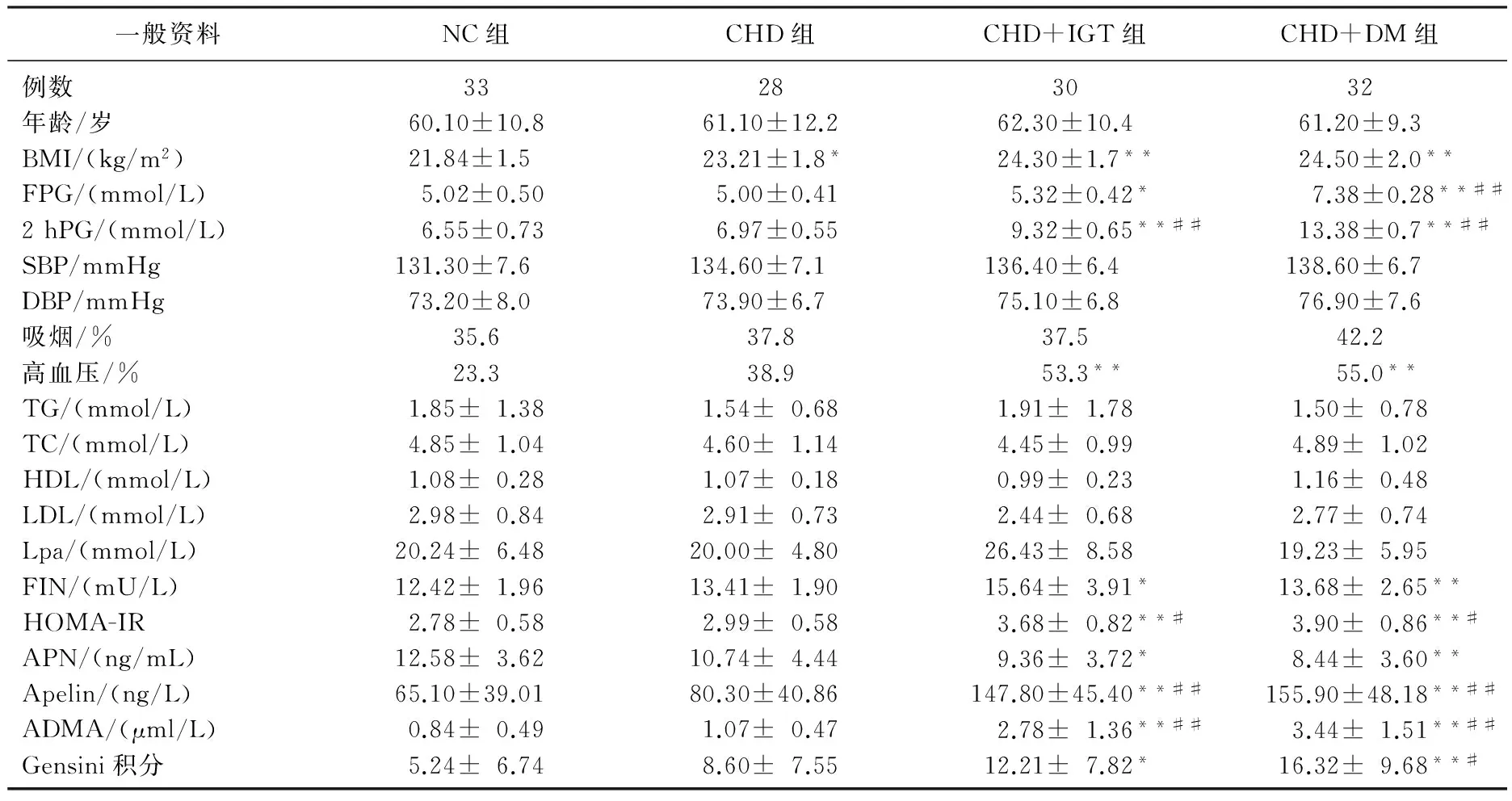
表1 4组一般资料的比较
与NC组比较, *P<0.05, **P<0.01; 与CHD组相比, #P<0.05, ##P<0.01。

表2 Gensini积分与相关指标的相关性分析
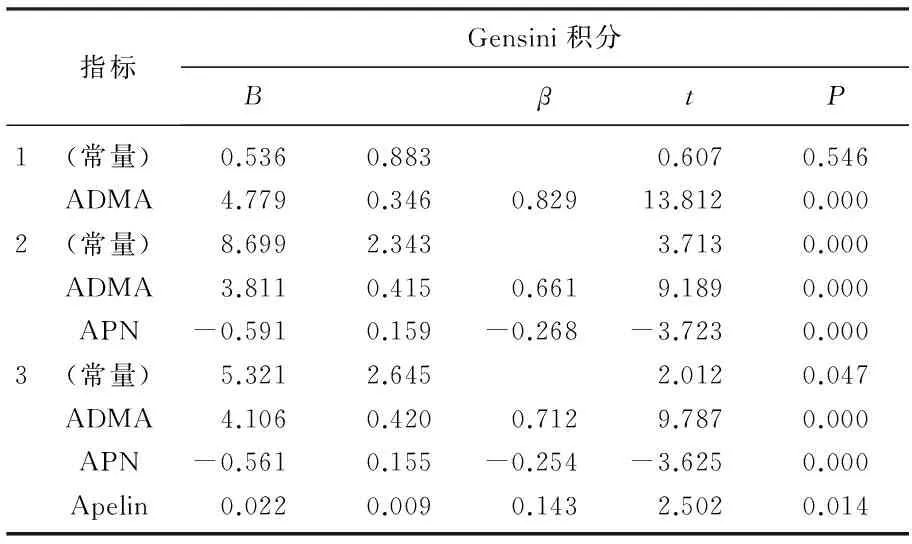
表3 以Gensini积分应变量的多因素线性回归分析
ADMA 作为内源性一氧化氮合酶(NOS)抑制剂,竞争性抑制NOS活性,减少NO生成,导致内皮依赖性血管舒张反应功能障碍,引起血管内皮依赖性舒张功能障碍,并且ADMA抑制内皮细胞的游动性从而抑制新生血管的形成,阻碍了损伤内皮的修复[12]。ADMA已被看作心血管疾病的一个新的危险因素,近年来研究发现在糖尿病患者体内ADMA的水平也出现异常的增高[13]。本研究结果显示,冠心病患者ADMA水平明显升高,高于正常对照人群,这与既往研究结果一致[13], 而合并冠心病的糖代谢异常患者,甚至在IGT阶段, ADMA的水平已明显升高,高于无糖代谢异常的冠心病患者,且随血糖水平的升高, ADMA的水平逐步升高。相关分析提示,反映冠脉病变严重程度的Gensini积分与ADMA水平密切相关,逐步回归分析也显示ADMA是Gensini积分的独立影响因素, ADMA不仅可以在IGT人群中预测冠脉病变的发生,而且ADMA水平的高低可以很好地反映疾病的严重程度。
APN是一种由脂肪细胞合成、分泌的细胞因子,在胰岛素敏感性和炎性通路中起重要作用,作为冠脉病变的保护因子, APN既可直接作用于冠状动脉粥样硬化的形成过程,又可通过引起与冠状动脉硬化形成有关的一系列危险因素的变化而间接影响血管病变的发生与发展。本研究中发现, APN水平按NC-CHD-IGT+CHD-DM+CHD有逐渐降低趋势,两两比较发现, IGT+CHD组和DM+CHD组均与NC组有显著差异,与CHD组并无显著差异,相关分析提示Gensini积分与APN水平密切相关,回归分析亦提示APN是Gensini积分的独立影响因素, APN水平的下降与疾病的进展有很好的相关性。
Apelin是一个由脂肪组织分泌的生物活性肽,是一种G蛋白偶联受体—血管紧张素Hl型受体样蛋白J受体(APJ)的内源性配体,具有扩张外周血管、正性肌力和调节体液平衡等多种重要的生物学功能[14-15]。目前研究认为, Apelin做为一种新的脂肪因子与肥胖、胰岛素抵抗及脂类代谢紊乱的关系密不可分。Boucher等[16]在研究中发现胰岛功能缺陷而血浆胰岛素水平下降的小鼠Apelin 的表达则明显降低,这表明Apelin水平的变化与血糖和胰岛素敏感性相关, Apelin可能参与糖尿病发生发展的过程, Apelin的升高可能是糖尿病或心血管功能紊乱等的最后防线,一定程度上起到代偿保护作用。本研究发现Apelin水平从NC-CHD-IGT+CHD-DM+CHD逐渐增高, IGT+CHD组和DM+CHD组均与NC组和CHD组有显著差异,相关分析提示Gensini积分与Apelin水平密切相关,回归分析亦提示Apelin是Gensini积分的独立影响因素。
本研究发现, Gensini评分虽与多项指标有相关性,但回归分析显示仅ADMA、APN和Apelin是反映冠脉病变严重程度Gensini积分的独立相关影响因素,在IGT阶段, ADMA、APN及Apelin水平已有明显改变,且随病情的发展, ADMA、APN和Apelin水平的改变与疾病的进展有很好的相关性,高ADMA、Apelin和低APN水平相比于其他因素能更为敏感的预测糖尿病大血管病变的严重程度。
[1] Cleeman J. Executive summary of the third report of the national cholesterol edeeation Program(NCEP) expert panel on determination, evaluation and treatment of high blood cholesterol in adults(APT- III)[J]. JAMA, 2001, 285: 2486-2497.
[2] Amini M, Janghorbani M. Diabetes and impaired glucose regulation in first-degree relatives of patients with type 2 diabetes in Isfahan, Iran: prevalence and risk factors[J]. Rev Diabet Stud, 2007, 4: 169-176.
[3] 胡大一, 潘长玉. 中国心脏调查组. 中国住院冠心病患者糖代谢异常研究[J]. 中华内分泌代谢杂志, 2006, 22(l): 7-10.
[4] Hiroyuki K, Masayuki M, Kahori S, et al. Asymmetric dimethylarginine, a biomarker of cardiovascular complications in diabetes mellitus[J]. World J Exp Med, 2015, 5(2): 110-119.
[5] Kadowaki T, Yamauchi T. Adiponectin receptor signaling: a new layer to the current model[J]. Cell Metab, 2011, 13 ( 2): 123-124.
[6] Pang H, Han B, Li Z Y, et al. Identification of molecular markers in patients with hypertensive heart disease accompanied with coronary artery disease[J]. Genet Mol Res, 2015, 14(1): 93-100.
[7] Castaldo E, Sabato D, Lauro D, et al. Hypoglycemia assessed by continuous glucose monitoring is associated with preclinical atherosclerosis in individuals with impaired glucose tolerance[J]. PLoS One, 2011, 6(12): 1-5.
[8] Olson N C, Callas P W, Hanley A J, et al. Circulating Levels of TNF-ɑ Are Associated with Impaired Glucose Tolerance, Increased Insulin Resistance, and Ethnicity: The Insulin Resistance Atherosclerosis Study[J]. J Clin Endocrinol Metab, 2012, 11: 1-8.
[9] Hidaka T, Nakagawa K, Goto C, et al. Pioglitazone improves endothelium- dependent vasodilation in hypertensive patients with impaired glucose tolerance in part through a decrease in oxidative stress[J]. Atherosclerosis, 2010, 210(2): 521-524.
[10] Krysiak R, Stachura-Kuach A, Okopien B. Metabolic and monocyte-suppressing actions of fenofibrate in patients with mixed dyslipidemia and early glucose metabolism disturbances[J]. Pharmacol Rep, 2010, 62(1): 120-130.
[11] Karasik A. Glycaemic control is essential for effective cardiovascular risk reduction across the type 2 diabetes continuum[J]. Ann Med, 2005, 37(4): 250-258.
[12] Worku A, Mahmood M. Endothelial dysfunction in diabetes: potential application of circulating markers as advanced diagnostic and prognostic tools[J]. PMAJ, 2010, 1(1): 32-45.
[13] Keiichi T, Yosuke O, Hiroko M, et al. Relationship between fluctuations in glucose levels measured by continuous glucose monitoring and vascular endothelial dysfunction in type 2 diabetes mellitus[J]. Cardiovasc Diabetol, 2013, 12: 1-9.
[14] David N, Michael H, Giovanni F, et al. Endogenous regulation of cardiovascular function by apelin-APJ[J]. Am J Physiol Heart Circ Physiol, 2009, 297(5): 1904-1913.
[15] Enrica G, Giuseppe L, Francesco N, et al. Adipose tissue and vascular inflammation in coronary artery disease[J]. World J Cardiol, 2014, 6(7): 539-554.
[16] Boucher J, Masri B, Daviaud D, et al. Apelin, a newly identified adipokine up-regulated by insulin and obesity[J]. Endocrinology, 2005, 146: 1764-1771.
Changes of serum asymmetric dimethylarginine, adiponectin and Apelin levels in coronary heart disease patients with abnormal glucose metabolism
HUANG Shan1, 2, PENG Wenfang2, XIA Lili2, TANG Yubin2, ZOU Dajin1
(1.DepartmentofEndocrinologyandMetabolism,ChanghaiHospitalAffiliatedtoShanghaiSecondMilitaryMedicalUniversity,Shanghai, 200433;2.DepartmentofEndocrinologyandMetabolism,TongrenHospitalAffiliatedtoShanghaiJiaotongUniversity,Shanghai, 200336)
Objective To investigate the changes of asymmetric dimethylarginine (ADMA), adiponectin (APN) and Apelin levels in coronary heart disease (CHD) patients with abnormal glucose metabolism. Methods Patients with suspected coronary artery disease (CAD) were treated with parallel selective coronary angiography (CAG), and they were divided into four groups, including 28 cases in CHD group, 30 cases in CHD+IGT group, 32 cases in CHD+DM group, and 33 cases in NC group. Body mass index (BMI), HOMA-IR, blood pressure, blood lipid, insulin, ADMA, APN and Apelin were measured, and Gensini score was calculated. Results The values of BMI in CHD+IGT group and CHD+DM group were significantly higher than NC group (P=0.000). FPG in CHD+DM group was significantly higher than CHD group and NC group (P=0.000). PPG in CHD+IGT group and CHD+DM group were significantly higher than CHD group and NC group (P=0.000). The values of FINS, HOMA-IR in CHD+IGT group and CHD+DM group were significantly higher than the NC group (P<0.05). APN values in CHD+IGT group and CHD+DM group were significantly lower than the NC group (P<0.05), and ADMA、Apelin values in CHD+IGT group and CHD+DM group were significantly higher than the CHD group and NC group(P=0.000). Gensini score in CHD+IGT group and CHD+DM group were significantly higher than the NC group (P<0.05). Multivariate regression analysis showed that ADMA, APN and Apelin values were correlated with Gensini score. Conclusion Values of ADMA, APN and Apelin maybe correlated with the degree of abnormal glucose metabolism, and these indexes are useful in evaluating and reflecting the disease severity.
coronary heart disease; abnormal glucose metabolism; asymmetric dimethylarginine; adiponectin; Apelin; Gensini score
2016-11-18
上海市卫生计划和生育委员会(20122048)
邹大进
R 541.4
A
1672-2353(2017)03-001-05
10.7619/jcmp.201703001
