丘脑底核脑深部电刺激术在改善帕金森病核心症状中的应用
2017-03-15张学君于春利
张学君, 于春利
(山东省威海市立医院, 1. 神经外科; 2. 皮肤美容科, 山东 威海, 264200)
丘脑底核脑深部电刺激术在改善帕金森病核心症状中的应用
张学君1, 于春利2
(山东省威海市立医院, 1. 神经外科; 2. 皮肤美容科, 山东 威海, 264200)
目的 探讨丘脑底核脑深部电刺激术在改善帕金森病(PD)核心症状中的疗效。方法 选取行双侧丘脑底核脑深部电刺激术PD患者20例,采用自身前后对照法在基线和随访结束时(术后12个月)对患者运动症状、认知功能进行评估,观察患者术后不良反应,比较术前、术后日左旋多巴等效计量。结果 术前及术后12个月时,服药状态下帕金森病评定量表第3部分(UPDRS Ⅲ)评分及各亚相评分均明显低于未服药状态(P<0.05); 术后12个月时,未服药及服药状态下的UPDRS Ⅲ评分及各亚相评分均明显低于术前(P<0.05), 服药后各个评分项目的改善率均明显高于术前(P<0.05), VFT评分明显低于术前(P<0.05), CDT评分明显高于术前(P<0.05); 术后1年日左旋多巴等效计量均较术前明显减少(P<0.01); 术后未见颅内出血、电极位置不当、脑脊液漏等并发症。结论 双侧丘脑底核脑深部电刺激术能显著改善PD患者运动及认知功能,有效减少药物用量,手术安全性高,治疗效果显著。
脑深部电刺激术; 丘脑底核; 帕金森病
帕金森病(PD)是常见的运动障碍性疾病,特征症状为震颤、肌肉僵直和运动和迟缓,平均发病年龄在55岁左右。PD的发生机理尚不完全清楚,目前普遍认同的观点是,存在于纹状体和黑质中的多巴胺能神经元的变性导致了PD的出现[1]。脑深部电刺激术是将一个能产生特定脉冲的电极放置在脑内某个神经核团中(如丘脑底核),并进行长期慢性电刺激的治疗方法[2]。20世纪50年代,脑深部电刺激术常被用于治疗疼痛方面的疾病,在此过程中发现该术式对震颤的改善有一定的效果。目前研究[3-4]已经证实,脑深部电刺激术能抑制丘脑、苍白球、丘脑底核等部位的作用,且疗效稳定。本研究探讨丘脑底核脑深部电刺激术在改善PD核心症状中的疗效。
1 资料与方法
1.1 一般资料
选取2014年6月—2015年8月行双侧丘脑底核脑深部电刺激术的PD患者20例,其中男14例,女6例;年龄38~74岁,平均(55.5±5.3)岁;病程5~13年,平均8.5年。20例患者均随访至术后1年。入组标准:符合2006年中华医学会神经病学分会运动障碍及帕金森病学组制定的原发性PD的诊断标准;多巴胺类药物治疗有效,或曾经有效(随病情进展,对药物敏感性逐渐下降);出现异动症或开关现象。排除标准:伴有痴呆、严重抑郁等严重精神症状者;多巴胺药物治疗无效; CT或MRI检查头颅,显示有其他脑器质性病变(脑卒中、脑外伤、脑瘤等)者;合并严重心血管、肝脏、肾脏疾病或糖尿病者。2组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1.2 手术方法
局麻下安装LEKSELL立体定向框架装置,使用核磁共振扫描定位双侧丘脑底核,直视定位,或根据图谱坐标进行定位并计算靶点坐标及进针角度。局部静脉麻醉,颅骨钻孔。微电极采用尖端直径20~30 μm的金属电极,进入到靶点上10 mm时开始记录,使用微电极推进系统沿丘脑底核后外上方向前内下部推进。当电极到达靶点,收到与丘脑底核电生理特征相符的电信号后,植入脑深部刺激电极,联接电刺激器,开始给予电刺激。电刺激采用双极导联方式,使用最小刺激电压,从最远端的两个触点开始进行。观察刺激对患者症状的改善情况及不良反应,以确认电极处于最佳位置。当确认处于最佳位置后,使用塑料圈将电极固定于颅骨上。改用气管插管全麻,锁骨下方切口,埋入电刺激发生器,设置刺激参数。术后4周用程控仪在体外开机并调整刺激参数,已达到最佳症状控制效果,且不产生明显不良反应,并进行持续电刺激。
1.3 评价指标
本研究为前瞻性队列研究设计,采用自身前后对照方法,在基线和随访结束时(术后12个月)进行相关评估。① 运动症状改善评估:术前、术后12个月在未服药和服药状态下,使用统一帕金森病评定量表第3部分(UPDRS Ⅲ)分别评价患者运动症状改善情况。② 认知功能评估:术前、术后12个月采用韦氏记忆量表(WMS)评估外显记忆功能;采用简易智能量表(MMSE)评估总体认知状况;采用残图命名量表(DPN)评估内隐记忆;采用语言评估量表(VFT)评估语言功能;采用画钟测验(CDT)评估执行能力。CDT评估分数越高,表明PD患者认知能力越高。WMS、MMSE、DPN、VFT评分越高,表明相关认知功能越弱。观察PD患者术后不良反应发生情况,比较术前、术后12个月的日左旋多巴等效计量。
1.4 统计学分析
2 结 果
2.1 手术前后UPDRS Ⅲ评分及改善率情况
由UPDRS Ⅲ评分及各亚相(震颤、强直、运动迟缓)评分可见,术前及术后12个月时,服药状态下的UPDRS Ⅲ评分及各亚相评分均显著低于未服药状态(P<0.05)。术后12个月时,未服药及服药状态下的UPDRS Ⅲ评分及各亚相评分均明显低于术前(P<0.05)。术前服药后,震颤改善率最高,为(75.2±6.2)%。术后12个月,服药后各个评分项目的改善率均显著高于术前(P<0.05)。见表1。
2.2 手术前后认知功能评估
术后12个月, PD患者WMS、MMSE、DPN评分与术前比较无显著差异(P>0.05); VFT评分明显低于术前, CDT评分显著高于术前(P<0.05)。见表2。
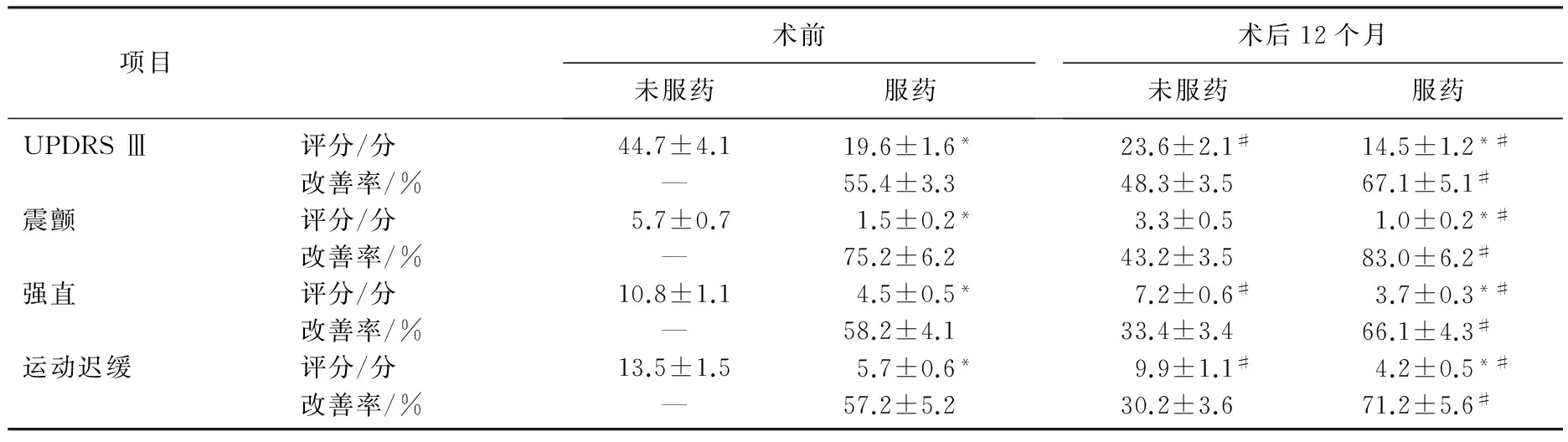
表1 手术前后UPDRS Ⅲ评分及改善率比较
与未服药比较, *P<0.05; 与术前比较, #P<0.05。

表2 手术前后认知功能评分比较 分
与术前比较, *P<0.05。
2.3 药量及手术不良反应情况
20例患者术前平均日左旋多巴等效计量为(750.6±125.6) mg, 术后1年为(425.6±567.8)mg, 患者术后1年日左旋多巴等效计量均较术前显著减少(P<0.01)。术后出现视、听幻觉1例, 3 d后自行缓解;术后出现针道少量出血1例,经短期保守治疗后出院;囊袋积液1例,经短期保守治疗后好转出院。未见颅内出血、电极位置不当、脑脊液漏等并发症。
3 讨 论
目前,中国每10万人中约有44人患有PD[5]。随着年龄的增长,罹患PD的风险也会增加,中国正快速步入老龄化时期,做好关于老年人PD的研究非常必要。PD的核心症状有僵直、震颤、姿态不稳、运动迟缓等。研究[6]证实,基底核功能紊乱是导致PD的病理生理基础。基底核中的丘脑底核与纹状体是皮质和丘脑神经冲动进入基底核的主要核团,与苍白球、黑质构成的输出核团形成了基底核-丘脑皮质通路[7]。该通路主要功能涉及到与PD密切相关的多巴胺系统。机体为保持运动的正常速度和张力,多巴胺会使投射到丘脑底核的纹状体神经元受到抑制[8],若多巴胺耗竭,可导致中脑和丘脑中靶结构受到抑制,使得PD患者运动减少[9]。
目前,左旋多巴是治疗PD的一线药物,该治疗方法能够缓解PD的运动症状,但无法减缓多巴胺神经元的进行性退变。且有一半以上PD患者通过长期多巴胺治疗,出现药物“开关现象”,即对药物的“反应期”和“不应期”。若逐渐加大药物剂量,会增加异动症的出现[10-11]。研究[12-13]开始考虑应用外科手段对PD进行治疗,早期外科治疗主要是将丘脑、苍白球、丘脑底核等神经核团进行损毁,但该方法存在许多弊病(只能缓解震颤,对强直、运动迟缓无明显改善,还可能出现哽咽、失声等副作用)。相对于损毁术,脑深部电刺激术具有可逆性,为患者提供了接受第2次治疗的机会,已是大势所趋[14-15]。
本研究结果表明,术前及术后12个月时,服药状态下的UPDRS Ⅲ评分及各亚相评分均明显低于未服药状态,术后12个月时,未服药及服药状态下的UPDRS Ⅲ评分及各亚相评分均明显低于术前,术前服药后震颤改善率最高。术后12个月,服药后各评分项目改善率均明显高于术前。可见,丘脑底核脑深部电刺激术对于改善PD患者震颤、强直、运动迟缓等症状较为明显。本研究中,术前及术后12个月对患者分别进行了认知功能评分,评分项目主要为WMS、MMSE、DPN、VFT、CDT评分。结果表明,术后12个月PD患者WMS、MMSE、DPN评分与术前比较无显著差异, VFT评分明显低于术前, CDT评分明显高于术前。可见,丘脑底核脑深部电刺激术对PD患者的一些认知功能确有明显影响。本研究还证实,患者术后1年日左旋多巴等效计量均较术前明显减少,且治疗无明显不良反应。
[1] Nassery A, Palmese C A, Sarva H, et al. Psychiatric and Cognitive Effects of Deep Brain Stimulation for Parkinson′s Disease[J]. Curr Neurol Neurosci Rep, 2016, 16(10): 87-87.
[2] 张伟忠, 卢凤飞, 薛杉, 等. 帕金森病患者年龄及侧脑室体积与STN-DBS针道角度的相关性研究[J]. 中华神经医学杂志, 2016, 15(6): 585-591.
[3] Dams J, Balzer-Geldsetzer M, Siebert U, et al. Cost-effectiveness of neurostimulation in Parkinson's disease with early motor complications[J]. Mov Disord, 2016, 31(8): 1183-1191.
[4] 崔青山, 庄平, 王云鹏, 等. 帕金森病丘脑底核β振荡活动与自主运动的相关性[J]. 中华神经外科杂志, 2016, 32(5): 480-485.
[5] Delavallée M, Delaunois J, Ruwet J, et al. STN DBS for Parkinson′s disease: results from a series of ten consecutive patients implanted under general anaesthesia with intraoperative use of 3D fluoroscopy to control lead placement[J]. Acta Neurochir (Wien), 2016, 158(9): 1783-1788.
[6] Kojovic M, Higgins A, Jahanshahi M. In Parkinson′s disease STN stimulation enhances responsiveness of movement initiation speed to high reward value[J]. Neuropsychologia, 2016, 89: 273-280.
[7] 杨柳, 贺曦, 张敏, 等. 国内脑深部丘脑底核电刺激术治疗帕金森病的meta分析[J]. 检验医学与临床, 2016, 13(8): 1049-1051, 1054.
[8] 高丹丹, 陶英群. 脑深部电刺激术治疗帕金森病非运动症状的研究进展[J]. 中华神经外科杂志, 2015, 31(4): 419-421.
[9] Mayer J S, Neimat J, Folley B S, et al. Deep brain stimulation of the subthalamic nucleus alters frontal activity during spatial working memory maintenance of patients with Parkinson′s disease[J]. Neurocase, 2016, 22(4): 369-378.
[10] 陶英群, 王莹, 梁国标, 等. 丘脑底核电刺激术治疗帕金森病的疗效[J]. 中国微侵袭神经外科杂志, 2015, 12(1): 19-22.
[11] Antosik-Wójcińska A Z, wicicki, Bieńkowski P, et al. Othello syndrome after STN DBS-psychiatric side-effects of DBS and methods of dealing with them[J]. Psychiatr Pol, 2016, 50(2): 323-327.
[12] 曹雄彬, 南毛球, 匡良洪, 等. 丘脑底核脑深部电刺激治疗帕金森病的临床分析[J]. 现代生物医学进展, 2015, 15(16): 3092-3095.
[13] Wang J W, Zhang Y Q, Zhang X H, et al. Cognitive and Psychiatric Effects of STN versus GPi Deep Brain Stimulation in Parkinson's Disease: A Meta-Analysis of Randomized Controlled Trials[J]. PLoS One, 2016, 11(6): 156-161.
[14] Steigerwald F, Müller L, Johannes S, et al. Directional deep brain stimulation of the subthalamic nucleus: A pilot study using a novel neurostimulation device[J]. Mov Disord, 2016, 31(8): 1240-1243.
[15] 吴斌, 胡晓吾, 王晓平, 等. 丘脑底核脑深部电刺激对帕金森病认知功能的影响[J]. 中华神经科杂志, 2014, 47(9): 617-623.
Application of subthalamic nucleus deep brain stimulation in improving core symptoms of patients with Parkinson′s Disease
ZHANG Xuejun1, YU Chunli2
(1.DepartmentofNeurosurgery; 2.DepartmentofDermalCosmetology,WeihaiMunicipalHospital,Weihai,Shandong, 264200)
Objective To explore the clinical efficacy of subthalamic nucleus deep brain stimulation in improving core symptoms of patients with Parkinson′s Disease (PD). Methods A total of 20 patients with PD who received bilateral subthalamic nucleus deep brain stimulation were selected, their motor symptoms and cognitive capacity on the baseline and after the end of follow up (after postoperative 12 months) were evaluated using self-correlative controlled method, postoperative adverse reactions was observed, and the equivalent dose of daily levodopa before and after operation was compared. Results Scores of Unified Parkinson′s Disease Rating Scale part Ⅲ (UPDRS Ⅲ) and each sub-phase scale were evidently lower before and after 12 months of operation in patients with drug administration than those without drug administration (P<0.05). The above scores were markedly lower after postoperative 12 months than operation before in patients with and without drug administration (P<0.05), and the improvement rate of each program score after drug administration was prominently higher than operation before (P<0.05), whereas verbal fluency test (VFT) was notably lower (P<0.05), and clock drawing test (CDT) was obviously higher after drug administration than operation before (P<0.05). The equivalent dose of daily levodopa was reduced more significantly after postoperative 1 year than operation before (P<0.01). None had postoperative complications like intra-cranial hemorrhage, improper position of electrodes, and leakage of cerebrospinal fluid. Conclusion Bilateral subthalamic nucleus deep brain stimulation, with high surgical safety and favorable therapeutic efficacy, can significantly improve PD patients′motor and cognitive function and effectively reduce the dosage of drug.
deep brain stimulation; subthalamic nucleus; Parkinson′s Disease
2016-12-05
R 338.2
A
1672-2353(2017)03-059-03
10.7619/jcmp.201703018
