人脐静脉内皮细胞对流感病毒血凝素的免疫应答研究
2017-03-10范国权陈向伟
范国权 陈向伟
030001 太原,山西医科大学微生物与免疫教研室
流感病毒的季节性流行或大流行在人群中造成不同程度的死亡,也给养禽业及国际贸易造成巨大的损失。更为严重的是,近年来随着禽类流感的不断爆发,其突破宿主的种属屏障,感染包括人类在内的多种哺乳动物,对人类的公共卫生安全造成严重的威胁[1-4]。禽流感在活禽市场和家禽屠宰加工厂检出率非常高,大大增加了人们与其接触的机会[5]。2013年3月底在上海和安徽两地发现了H7N9型禽流感感染人病例,这些病例主要表现为典型的病毒性肺炎,部分病例可迅速发展为急性呼吸窘迫综合征并死亡[6]。之后疫情扩散更广泛,患者年龄出现了年轻化,病毒致病性也发生了变化[7]。有研究发现,流感病毒感染后可以造成机体的免疫病理损伤,血管内皮细胞在病毒感染激活固有免疫阶段起到非常重要作用[8]。本研究用H3N2、H9N2流感病毒的重组HA蛋白和灭活H9N2病毒分别接种内皮细胞,解析其在宿主细胞固有免疫应答中的作用,将为了解其他亚型病毒的致病机制提供一些参考。
1 材料与方法
1.1实验材料甲型流感H9N2(A/Chicken/Hong Kong/G9/97)重组血凝素(Hemagglutinin,HA)蛋白,甲型流感H3N2(A/X-31)血凝素HA蛋白购自Sino Biological Inc.。禽流感(H9亚型)灭活病毒(SD696株)购自乾元浩生物股份有限公司。IFN-β ELISA试剂盒购自上海酶联生物科技有限公司。HUVECs,由实验室保存,按常规方法进行复苏、传代,实验用3~5代细胞。
1.2实验分组HA实验组按5 μg/ml剂量接种H3和H9亚型病毒HA于HUVECs,灭活病毒组按103EID50灭活A/Chicken/Shandong/6/96(H9N2)ml-1接种HUVECs,阴性对照组按正常细胞培养,所有组在37 ℃吸附1 h,弃上清液,洗涤后,每孔加入DMEM细胞维持培养基(含0.2% BSA)。在接种后24 h和36 h分别收集细胞悬液,并在接种24 h时间点,用冷PBS洗涤细胞3次,收集细胞,待提取总RNA。
1.3实时定量PCR检测细胞因子mRNA表达量
1.3.1 细胞总RNA提取:六孔板加入1 ml Trizol溶液,用移液器吹打至丝状物消失,使细胞充分裂解,分别转入1.5 ml离心管中,用氯仿-异丙醇-乙醇方法提取细胞总RNA,纯化后的细胞总RNA在波长为260/280 nm检测RNA的质量。
1.3.2 反转录反应:使用反转录试剂盒(购自TaKaRa公司)进行反转录反应。提取总RNA 1 μg,合成cDNA,所得cDNA于-4℃备用。
1.3.3 实时定量PCR(Real-Time PCR)反应:使用荧光定量试剂盒(购自ABI公司),以ACTB为内部参照,用相对定量方法计算mRNA量。引物由上海生工生物技术有限公司合成,序列和扩增片段长度见表1。
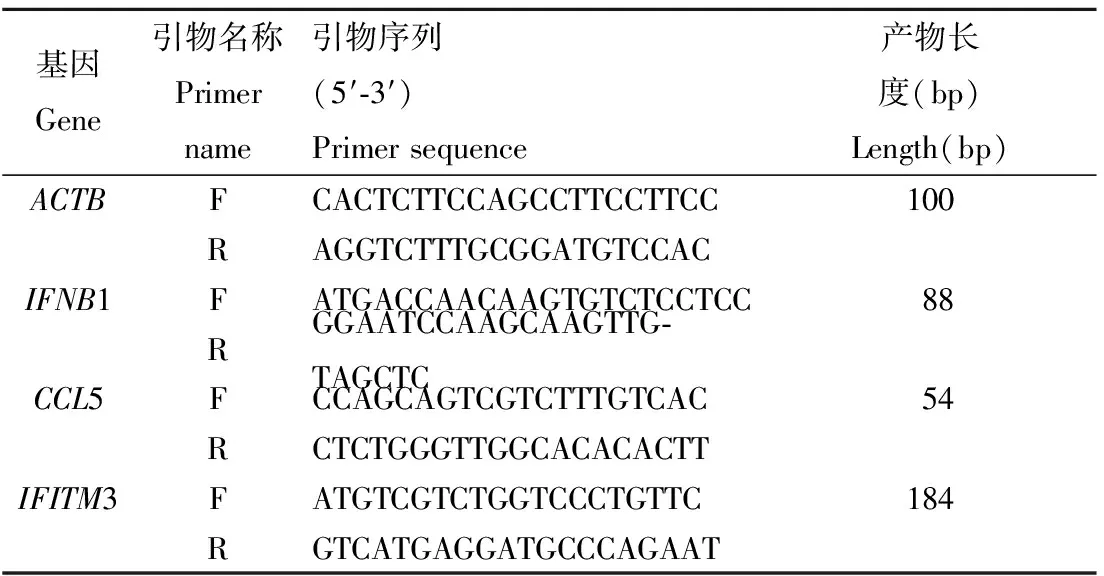
表1 目的基因引物信息
配制反应体系,25 μl体系包括SybrGreen qPCR Master Mix(2×) 12.5 μl,引物F(10 μmol/L) 0.5 μl,引物R(10 μmol/L) 0.5 μl,ddH2O 9.5 μl,cDNA模板 2 μl。将上述混合物混匀离心后按照下列反应程序下于ABI 7500型荧光定量PCR仪检测系统中进行反应:预变性95℃ 10 min;PCR反应,变性95℃ 15 s,退火/延伸60℃ 1 min,40个循环;对溶解曲线进行分析。反应结束后,根据2-ΔΔCT相对定量方法对基因的mRNA表达量进行分析。
1.4细胞培养液中细胞因子的检测用酶联免疫吸附实验检测样本中干扰素IFN-β的含量,操作严格按照试剂盒说明,绘制出标准曲线得到回归方程式,将检测样品的OD值代入方程式,计算出样品的检测浓度,再乘以稀释倍数,得到样品的实际浓度值。
1.5统计学方法实验数据所用检测方法为学生t检验或单向方差分析(One-way analysis of variance,ANOVA)。各实验组分别与对照组比较时(相对定量PCR基因mRNA相对表达值),使用学生t检验。实验各分组相互比较时(干扰素IFN-β蛋白表达量),使用ANOVA方法分析。统计学计算使用美国的微软Excel软件处理。
2 结果
2.1流感病毒HA接种HUVEC后IFNB1、CCL5、IFITM3mRNA的表达H3和H9亚型流感病毒重组HA蛋白接种HUVEC后24 h,H3组和H9组的IFNB1、CCL5、IFITM3的mRNA相对表达量与对照组比较差异无统计学意义(IFNB1,P=0.051、0.127;CCL5,P=0.314、0.429;IFITM3,P=0.530、0.269,t检验);灭活病毒(Viral particle)组CCL5和IFITM3与对照组比较相对表达量显著增加(P=0.022、0.047,t检验),IFNB1与对照组比较相对表达量差异无统计学意义(P=0.061,t检验),见图1,检测数据见表2。提示流感病毒重组HA蛋白单独作用内皮细胞,不能有效激活内皮细胞固有免疫;而灭活病毒能够刺激内皮细胞干扰素诱导基因的高表达。
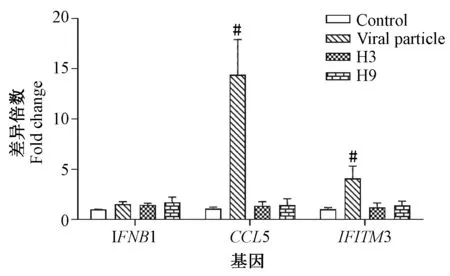
注:Control代表对照组,Viral Particle代表灭活H9N2病毒,H3代表H3亚型流感病毒血凝素重组蛋白,H9代表H9亚型流感病毒血凝素重组蛋白。图1 流感病毒重组HA蛋白接种HUVEC 24 h后IFNB1、CCL5和IFITM3 mRNA的表达量Note: Control as a negative control group, Viral particle as an inactived influenza virus particle, H3 as recombinant HA proteins of H3N2, H9 as recombinant HA proteins of H9N2.Fig.1 The expression of IFNB1, CCL5 and IFITM3 mRNA 24 h after innoculation of recombinant hemagglutinin proteins of influenza virus
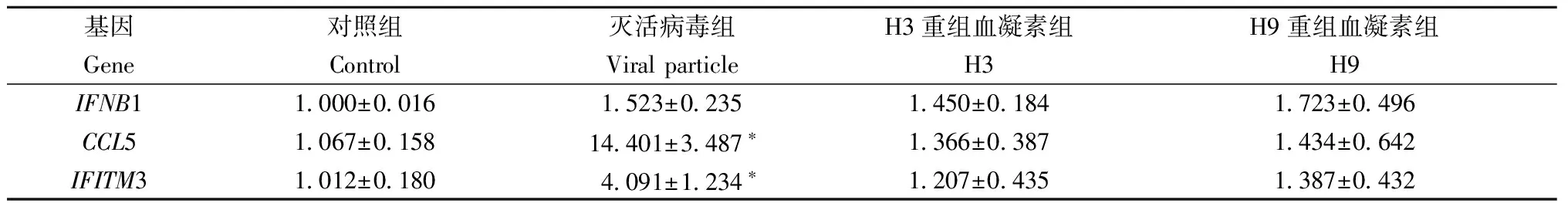
基因对照组灭活病毒组H3重组血凝素组H9重组血凝素组GeneControlViralparticleH3H9IFNB11 000±0 0161 523±0 2351 450±0 1841 723±0 496CCL51 067±0 15814 401±3 487∗1 366±0 3871 434±0 642IFITM31 012±0 1804 091±1 234∗1 207±0 4351 387±0 432
注:与对照组相比,*P<0.05
Notes:Compared with Control Group,*P<0.05
2.2流感病毒重组HA蛋白接种HUVEC后IFN-β表达量对照组、灭活病毒组、H3重组血凝素组和H9重组血凝素组的IFN-β蛋白表达量分别为12 h时间点(19.382±2.588,17.199±3.850,17.942±1.617,18.302±2.658),24 h时间点(20.627±4.094,18.518±1.714,19.232±1.883,18.306±2.595)。各组之间差异无统计学意义(P=0.871,ANOVA检验),见图2,提示流感病毒HA蛋白及H9N2灭活病毒颗粒均不能有效刺激内皮细胞高表达I型干扰素IFN-β。
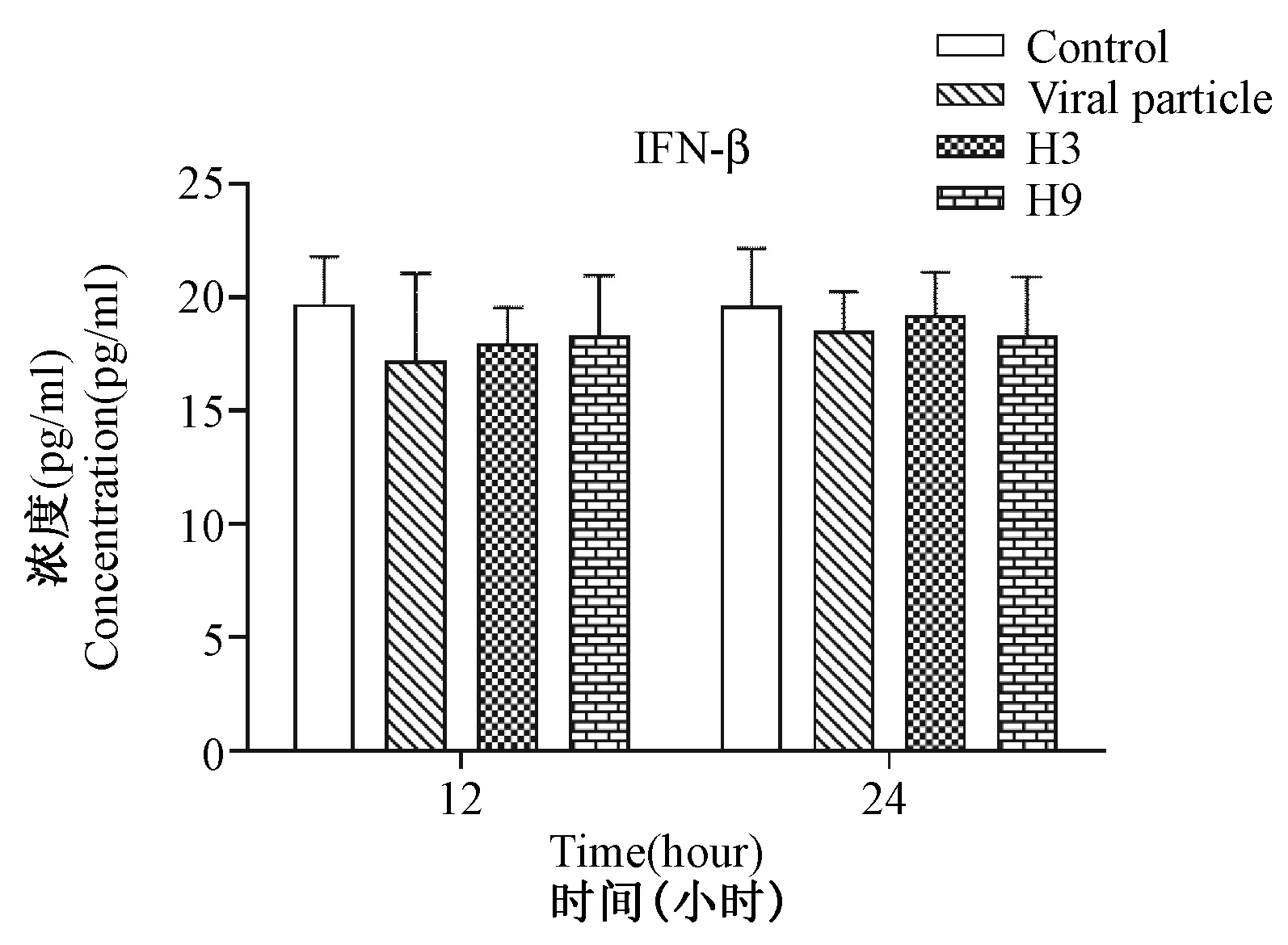
注:Control代表对照组,Viral Particle代表灭活H9N2病毒,H3代表H3亚型流感病毒血凝素重组蛋白,H9代表H9亚型流感病毒血凝素重组蛋白。图2 流感病毒重组HA蛋白接种HUVEC后IFN-β表达量Note: Control as a negative control group, Viral particle as an inactived influenza virus particle, H3 as recombinant HA proteins of H3N2, H9 as recombinant HA proteins of H9N2.Fig.2 IFN-β levels of recombinant hemagglutinin proteins of influenza virus group
3 讨论
近年来流感病毒的暴发越来越频繁,比如2009年暴发于北美洲的甲型H1N1流感,2013年在上海、江苏等地爆发的甲型H7N9流感,以及2017年中国香港暴发甲型H3N2流感。流感病毒的表面血凝素抗原和神经氨酸酶不断的变异,人群对其无免疫力,容易形成流行,不同亚型病毒之间还可以交换某些基因片段发生基因重排,出现具有新的生物学特征的病毒,这给抗流感病毒药物和疫苗的研制提出很大的挑战。流感病毒感染机体早期,机体依靠先天免疫机制发挥防御作用,上皮细胞构成抗感染的自然免疫屏障;病毒感染引起肺泡上皮细胞坏死、脱落,进而病毒可作用于肺部血管内皮细胞。已有研究表明流感病毒可直接感染内皮细胞,内皮细胞在病毒感染后固有免疫应答过程中起重要作用[9]。
本研究使用灭活流感病毒模拟早期病毒与内皮细胞相互作用,并单独使用流感病毒囊膜表面最丰富的抗原HA蛋白刺激内皮细胞,监测病毒颗粒和病毒蛋白对内皮细胞的影响。实验采用荧光实时定量PCR法检测了固有免疫中干扰素(IFNB1)和干扰素诱导基因(CCL5和IFITM3)的表达情况,用酶联免疫吸附试验法检测了干扰素(IFNβ1)蛋白表达水平。IFN-β属于I型干扰素,是机体细胞抵抗病毒感染的第一道防线,可以诱导内皮细胞产生CCL5[10]和IFITM3。结果发现单独使用不同亚型(H3和H9)HA蛋白不能有效激活内皮细胞固有免疫应答(IFNB1、CCL5和IFITM3),而病毒灭活颗粒可以有效激活干扰素诱导基因的表达(CCL5和IFITM3),说明启动内皮细胞固有免疫系统,需要完整的病毒颗粒参与,但无论是HA蛋白还是病毒颗粒在作用于内皮细胞在12 h和24 h时间点,没有有效引起I型干扰素IFN-β的高表达,推测内皮细胞干扰素诱导蛋白基因的高表达可能存在不依赖于I型干扰素的诱导通路,内皮细胞模式识别系统是在胞内进行识别,并且不依赖流感病毒复制。在内皮细胞实验,有研究者发现H3亚型重组HA蛋白接种肺内皮细胞不能促进血小板黏附内皮细胞(重组HA蛋白不能诱导内皮细胞黏附相应基因高表达),而灭活H3亚型病毒颗粒能促进血小板黏附内皮细胞[11],提示流感病毒诱导某些基因高表达也需要完整病毒颗粒刺激细胞。已有研究发现流感病毒重组蛋白HA(H1和H5亚型)能诱导小鼠髓性树突状细胞表达炎性细胞因子,并且不同亚型HA蛋白诱导效果没有显著差别[12]。这说明不同类型细胞对流感病毒HA蛋白的应答反应因细胞不同而具有很大的差异。而本研究中发现单独使用重组HA蛋白不能有效激活内皮细胞固有免疫应答,需要完整病毒颗粒刺激内皮细胞激活免疫反应。
本研究初步从细胞水平探讨流感病毒重组HA蛋白及灭活病毒颗粒对内皮细胞的影响,并对可能存在的固有免疫反应进行了初步探讨。已有的研究发现不同类型的细胞需通过不同的信号通路启动相应的免疫应答,但流感病毒颗粒如何激活干扰素诱导蛋白尚需今后深入研究。
[1] Fan M, Huang B, Wang A, et al. Human Influenza A(H7N9) Virus Infection Associated with Poultry Farm, Northeastern China[J]. Emerg Infect Dis, 2014,20(11):1902-1905. doi:10.3201/eid2014.140608.
[2] Millman AJ, Havers F, Iuliano AD, et al. Detecting Spread of Avian Influenza A(H7N9) Virus Beyond China[J]. Emerg Infec Dis, 2015,21(5):741-749. doi:10.3201/eid2105.141756.
[3] Huang Y, Li X, Zhang H, et al. Human infection with an avian influenza A (H9N2) virus in the middle region of China[J]. J of Med Virol, 2015,87(10):1641-1648. doi:10.1002/jmv.24231.
[4] Dortmans JC, Dekkers J, Wickramasinghe IN, et al. Adaptation of novel H7N9 influenza A virus to human receptors[J]. Sci Rep, 2013,3:3058. doi:10.1038/srep03058.
[5] 王笑笑, 程伟, 余昭, 等. 浙江省冬春季涉禽场所禽流感病毒污染特征及影响因素研究[J]. 中华预防医学杂志, 2016,50(3):250-254. doi:10.3760/cma.j.issn.0253-9624.2016.03.012.
[6] Mei Z, Lu S, Wu X, et al. Avian Influenza A(H7N9) Virus Infections, Shanghai, China[J]. Emerg Infect Dis, 2013,19(7):1179-1181.DOI:10.3201/eid1907.130523.
[7] Wu P, Peng Z, Fang VJ, et al. Human Infection with Influenza A(H7N9) Virus during 3 Major Epidemic Waves, China, 2013-2015[J]. Emerg Infect Dis, 2016,22(6):964-972. doi:10.3201/eid2206.151752.
[8] Teijaro JR, Walsh KB, Cahalan SM, et al. Endothelial cells are central orchestrators of cytokine amplification during influenza virus infection[J]. Cell, 2011,146(6):980-991. doi:10.1016/j.cell.2011.08.015.
[9] Viemann D, Schmolke M, Lueken A, et al. H5N1 Virus Activates Signaling Pathways in Human Endothelial Cells Resulting in a Specific Imbalanced Inflammatory Response[J]. J Immunol, 2011,186(1):164-173. doi:10.4049/jimmunol.0904170.
[10] Nakano M, Fujii T, Hashimoto M, et al. Type I interferon induces CX3CL1 (fractalkine) and CCL5 (RANTES) production in human pulmonary vascular endothelial cells[J]. Clin Exp Immunol, 2012,170(1):94-100. doi:10.1111/j.1365-2249.2012.04638.x.
[11] Sugiyama MG, Gamage A, Zyla R, et al. Influenza Virus Infection Induces Platelet-Endothelial Adhesion Which Contributes to Lung Injury[J]. J Virol, 2016,90(4):1812-1823. doi:10.1128/JVI.02599-15.
[12] Liu WC, Lin SC, Yu YL, et al. Dendritic Cell Activation by Recombinant Hemagglutinin Proteins of H1N1 and H5N1 Influenza A Viruses [J]. J Virol, 2010,84(22):12011-12017. doi:10.1128/JVI.01316-10.
