振子及其耦合条件对圆窗激励式人工中耳性能影响的数值研究
2017-03-09刘后广田佳彬饶柱石杨建华
徐 丹, 刘后广, 田佳彬, 饶柱石, 程 刚, 杨建华
(1.中国矿业大学 机电工程学院,江苏 徐州 221116;2. 上海交通大学 振动、冲击噪声研究所 机械系统与振动国家重点实验室,上海 200240)
振子及其耦合条件对圆窗激励式人工中耳性能影响的数值研究
徐 丹1, 刘后广1, 田佳彬2, 饶柱石2, 程 刚1, 杨建华1
(1.中国矿业大学 机电工程学院,江苏 徐州 221116;2. 上海交通大学 振动、冲击噪声研究所 机械系统与振动国家重点实验室,上海 200240)
为研究振子及其耦合条件对圆窗激励式人工中耳植入性能的影响,建立了包括振子和隔膜在内的人耳有限元模型。该模型基于一无任何听力损伤病史的成年志愿者右耳,采用CT扫描和逆向成型技术建立而成,通过与相关文献的实验数据比对验证了模型的可靠性。基于该模型,分析了圆窗上的初始预压力、振子和隔膜的设计参数变化对振子听力性能的影响。结果表明:振子横截面积越大,其对耳蜗的激励效果越差;隔膜的引入有利于提高振子的激振性能,在该研究范围内,较小的隔膜杨氏模量和厚度有利于提升振子的激振性能;振子质量的增加会恶化振子在高频段的植入性能;在圆窗上施加的初始预压力能够提高中高频段上对耳蜗的激振效果。
人工中耳;圆窗;振子;隔膜;有限元分析
感音神经性听力损伤主要采用佩戴传统助听器的方式来改善听力,缺乏具有针对性的药物治疗。而传统助听器存在诸多不足:堵塞耳道,使患者佩戴舒适性不佳;只能解决轻度到中度的感音神经性听力损伤;输出的声音信号与耳道反馈的声音信号混叠,使患者感受到的声音信号清晰度降低等[1-2]。针对上述传统助听器问题,并作为感音神经性听力损伤的有效治疗手段,近年来,人工中耳取得了较大的发展。人工中耳将外界的声信号转化成机械信号后直接激励听骨链或圆窗,以实现听力补偿,具有语音清晰度高,负反馈小和高频增益强等特点[3]。
人工中耳包括麦克风、振子、信号处理装置以及供电装置,其向内耳传音的途径有两种:①通过卵圆窗,即耳蜗正向激励;②通过圆窗,即耳蜗逆向激励。根据振子激励位置不同,人工中耳可分为砧骨激励式[4-7]、圆窗激励式[8-10]和鼓膜激励式[11-13]等。其中,包括砧骨激励式和鼓膜激励式等在内的传统人工中耳,需要患者听骨链完好,其与听骨链连接后可代替部分或全部听骨链的作用。然而,一些中重度传导性或混合性聋病患者的外耳道、听骨链或鼓室异常(如先天性中外耳畸形、鼓膜穿孔等),导致传统人工中耳装置难以经卵圆窗传音途径有效地将声能传递入内耳。而对耳蜗逆向激励的圆窗激励式人工中耳可以有效地避免上述问题,且在人颞骨上的实验表明,圆窗激励在耳蜗内产生的压力响应可以实现人耳对声音信号的听觉转换功能[14]。因此,近年来不少学者致力于圆窗激励式人工中耳的研发与设计,以期改善患者听力。
现有的临床报道显示,不同的患者,圆窗激励式人工中耳的植入效果具有较大的差异[15]。此外,BELTRAME等[16]指出该类人工中耳对听力的实际增益小于理论预期。针对上述问题,基于人体颞骨实验,学者们做了大量的研究。MAIER等[17]指出,一开始在圆窗上施加的静力是振子植入的临床效果多变的原因之一,且此静力是提高圆窗激励式振子激振效果的关键因素。SALCHER等[18]发现,除患者自身的差异外,在圆窗所受的初始静力恒定的前提下,振子与圆窗之间的耦合方式是影响激振效果的另一重要因素,且二者的耦合方式有待于进一步优化。KOKA等[19]通过研究发现,利用软组织(本文称为“隔膜”)将振子与圆窗耦合能够提高声能向内耳的传递。GOSTIAN等[20]探讨了悬浮振子在圆窗处放置的技术方法,结果表明,在圆窗龛中植入软骨或将悬浮振子附加在耦合器上,能大大提高振子对内耳的激励效果。上述实验研究工作对圆窗激振式人工中耳听力补偿性能的探索具有重要意义,但受到实验条件限制,大部分实验只是集中研究特定的听力设备和软组织材料,没有对振子或隔膜的某一材料参数进行针对性的研究。
除了实验外,针对人耳的尺寸细小、材料各异的组织结构,国内外学者探索有限元法研究人耳传声特性[21-25],并采用该方法辅助研究人工中耳听力补偿效果[26-28]。王学林等利用有限元模型比较分析了蜗窗激励和外耳道激励下耳蜗基底膜(Basilar Membrane, BM)的振动,提出了以基底膜最佳反应部位位移相等为准则的耳蜗等效激励力计算方法。ZHANG等[29]通过对人耳有限元模型分析,提出圆窗激励式振子横截面积的减小有利于提高其植入性能。TIAN等[30]指出在振子轴向长度一定的前提下,振子与圆窗之间引入的隔膜能够降低振子横截面积的变化对其植入性能的影响。上述研究从理论上揭示了圆窗激励式人工中耳的动态特性,但振子与圆窗的耦合条件也有待于进一步完善,如在研究振子横截面积变化的影响时,ZHANG等只设定了两种横截面积(分别为1 mm2和0.314 mm2),对比较少。此外,同TIAN等类似,在其研究中,振子横截面积变化的同时,质量也随之改变,并未保证变量的唯一性。而且,到目前为止,并没有关于振子初始预压力、振子质量以及隔膜厚度对圆窗激励式人工中耳植入性能影响的系统理论性研究报道。
为解决上述问题,本文基于微CT(Computer Tomography)逆向成型技术建立包括振子、隔膜、人耳在内的有限元模型。在此有限元模型基础上,系统分析了振子横截面积、振子质量、隔膜厚度、隔膜杨氏模量及初始预压力对圆窗激振式人工中耳听力补偿性能的影响。
1 方法
1.1 人耳有限元模型的建立
基于新鲜的人体颞骨标本(男,45岁,右耳),利用CT扫描以及逆向成型技术,建立人中耳几何模型。该模型包括鼓膜(Tympanic Membrane, TM)、听小骨(锤骨、砧骨和镫骨)以及肌腱和韧带。采用有限元前处理软件Hypermesh划分网格,得到人体中耳有限元模型。其中,整个听骨链以及中耳的韧带和肌腱均采用四面体单元C3D4,总单元数为48 043。鼓膜和鼓膜环韧带采用壳单元S3,单元数为804。鼓膜长轴9 mm,短轴7.75 mm,鼓膜环韧带、鼓膜张紧部(TM Pars Tensa, PT)和鼓膜松弛部(TM Pars Flaccida, PF)的厚度则分别取为0.2 mm、0.05 mm 和0.1 mm。为了使模型更加准确,对鼓膜张紧部建立三层结构,从内向外厚度分别为0.017 mm、0.016 mm 和0.017 mm。
耳蜗采用充满液体的导管模型,该模型为非螺旋状。该导管被基底膜分成两个类似的腔体,分别为前庭阶和鼓阶,此外,耳蜗还包括圆窗(Round Window, RW)、卵圆窗和蜗孔。前庭阶和鼓阶的高度、宽度分别由蜗底的2 mm、3.2 mm近似线性变化至蜗顶的0.4 mm和0.65 mm。鼓阶和前庭阶的液体容积分别为93.270 mm3和92.315 mm3。采用AC3D4和AC3D8单元对鼓阶和前庭阶进行划分,单元数分别为17 577和13 802。蜗孔是长方形的流体通道,尺寸为0.65 mm×1.6 mm。圆窗膜的面积为2 mm2,接近ATTURO等[31]报道的尺寸2.08 mm2,其厚为0.1 mm。基底膜采用壳单元S3和S4,单元总数为482,其厚度和宽度从蜗底到蜗顶近似呈线性变化,其厚度由7.5 μm变化至2.5 μm,宽度由0.15 mm变化至0.5 mm。
研究表明,耳道及中耳腔内气体所产生的阻抗,远小于中耳、内耳各组织结构所产生的,这使得耳道和中耳腔对中耳、内耳系统的动态特性影响较小[32]。考虑到上述因素,本文的建模过程中不考虑中耳腔、耳道及其内部的气体。振子与隔膜均采用圆柱实体结构,最终建立的包含振子与隔膜在内的人耳有限元模型如图1所示,其中,圆窗与隔膜形状一致,位于圆窗骨壁中间。
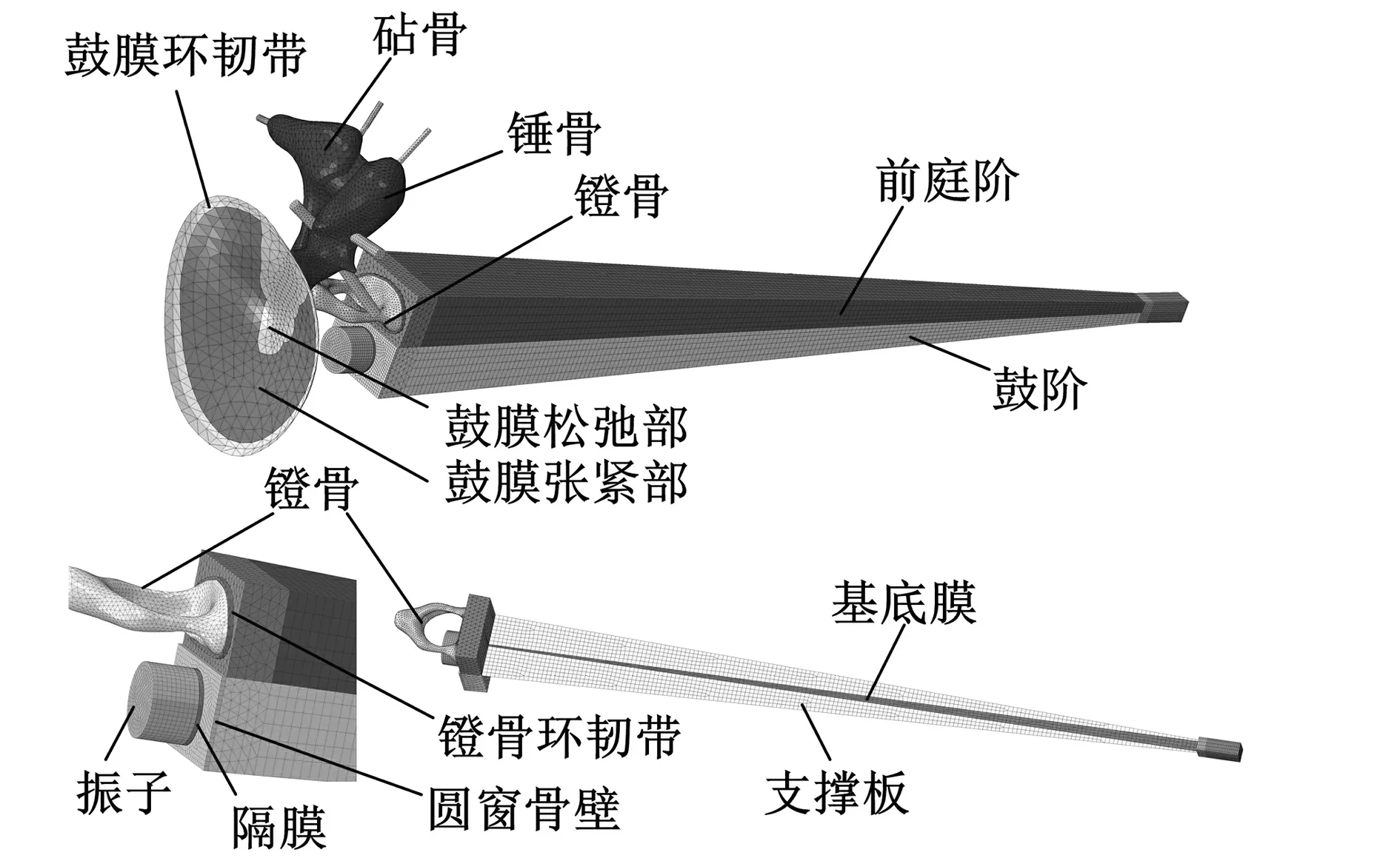
图1 人耳有限元模型Fig.1Finite element model of human ear
1.2 材料属性
人耳有限元模型中,中耳各部分结构泊松比均为0.3,除鼓膜张紧部中间层为正交异性的弹性材料外,其余各部分采用均匀和各项同性的弹性材料。主要参考GENTIL等[33-35],最终确定中耳有限元模型各部分材料属性如表1所示。前庭阶与鼓阶中流体部分的体积模量和密度分别取2 250 MPa和1 000 kg/mm3。基底膜沿长度方向刚度渐变,令其杨氏模量依次从底部40 MPa线性减小到中间的15 MPa和顶部的3 MPa。基底膜支撑部分的杨氏模量取为14 100 MPa,而圆窗的杨氏模量则为0.35 MPa。
对鼓膜张紧部(内外两层)、鼓膜松弛部、砧镫关节(Incudostapedial Joint, IS)、砧锤关节(Incudomallear Joint, IM)、镫骨环韧带(Stapedial Annular Ligament, SAL)以及圆窗的能量损耗,采用线性黏弹性材料模型对其进行模拟,其松弛模量E(t)为
(1)
式中,E0、E1和τ1为黏弹性参数,E1和τ1参考于文献[29],如表2所示,E0对应表1中的杨氏模量,E0、E1和τ1将在动态分析中保持不变。除上述软组织外,人耳其余各部分能量损耗均采用瑞利阻尼的形式,其中,中耳部分其余组织的阻尼系数为进行模拟阻尼系数α=0 s-1,β=0.75×10-4s;而耳蜗内基底膜的阻尼系数为α=0 s-1,β=1.00×10-3s。

表1 中耳组织结构材料属性
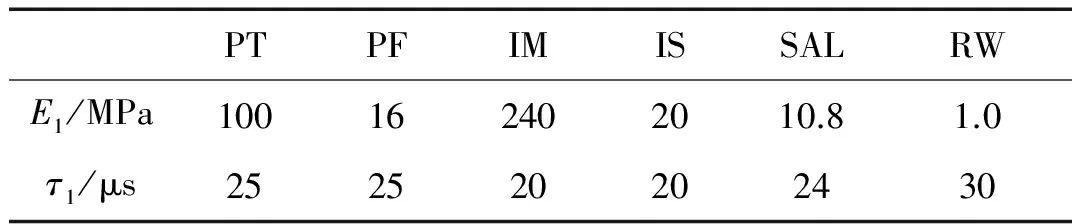
表2 人耳软组织的黏弹性材料参数
1.3 边界条件设定
在本文的人耳有限元模型,中耳的韧带和肌腱、基底膜支撑部分以及圆窗的外侧端均固定。对于耳蜗骨壁处的耳蜗流体,取其压力的法向梯度为零。对于耳蜗其余部分的流体,均采用流固耦合的方式,如:圆窗与耳蜗流体耦合,镫骨足底板表面与耳蜗流体耦合,耳蜗基底膜、支撑板与鼓阶流体和前庭阶流体的耦合。
1.4 圆窗激励式振子模型的建立
将圆窗激励式振子表达为放置在圆窗表面(近中耳端)的悬浮质量块,振子为圆柱实体结构,一端激励圆窗或隔膜,另一个自由端加载激振载荷,振子的轴向长度保持1 mm不变。隔膜面积始终与振子横截面积保持一致,两端分别与振子和圆窗耦合。本文将分为以下五个方面探讨振子及其耦合条件对圆窗激励式人工中耳性能的影响:
(1)振子横截面积变化的影响,振子横截面积分别取0.5 mm2、1 mm2、1.5 mm2和2 mm2,分别对应圆窗膜面积的25%、50%、75%和100%,隔膜的厚度取0.1 mm。
(2)隔膜杨氏模量变化的影响,隔膜杨氏模量分别取0.35 MPa、1.75 MPa、3.5 MPa、17.5 MPa和35 MPa,分别对应圆窗杨氏模量的1倍、5倍、10倍、50倍和100倍,隔膜厚度保持0.1 mm不变。
(3)隔膜厚度变化的影响,隔膜的厚度分别取0.1 mm、0.2 mm、0.3 mm和0.4 mm,分别对应圆窗膜厚度的1倍、2倍、3倍和4倍。
(4)振子质量变化的影响,振子质量分别取2.25 mg、4.5 mg、9 mg、18 mg、25 mg和35 mg。
(5)圆窗上恒定预压力的影响,除了振子的激振力外,在圆窗上施加10 μN的静力。
在振子横截面积为圆窗面积的25%时,取振子的材料为生物相容性的钛合金,其密度为4.5 g/mm3,此时振子质量为2.25 mg,为保证变量的单一性,(1)、(2)、(3)中振子质量均保持2.25 mg不变。
1.5 等效声压级
基底膜的振动能够使传到耳蜗内的机械振动转换成神经纤维的神经冲动。基底膜对于声波信号具有选频特性,即声波的激励频率与基底膜振动峰值所出现的位置是逐一对应的,此频率叫做该位置的特征频率。要使耳蜗逆向激励等效于耳蜗正向激励,在这两种激励途径中,基底膜对声波频率最大反应部位的位移(以下均称为“基底膜的位移”)应相等。因此,以基底膜位移为基准,引入等效声压级(Equivalent Sound Pressure, ESP),表征振子激振所对应的外耳道声激励的水平,并以此作为衡量圆窗激励式人工中耳植入性能的标准,如式(2)
(2)
式中,dac、drw分别为由外耳道100 dB声激励和圆窗激励式振子激励下的基底膜位移。
2 结果
2.1 模型可靠性
在鼓膜处施加90 dB SPL的声压激励,来模拟正常人耳的声激励,将本文的计算结果与相关实验测量的数据进行对比,以验证模型的可靠性。
中耳的声传递特性一般以镫骨足底板速度传递函数表征,即镫骨足底板的速度与鼓膜附近的声压比,将模型计算结果与AIBARA等[36]通过多普勒测振仪对12例颞骨样本测量所得的实验结果对比,如图2所示。虽然在中高频段(2 000~8 000 Hz),模型计算结果略低于实验值,但是在低频段,模型计算结果逼近于实验值,且在总体趋势上与实验值一致。上述结果可能是由于个体样本差异造成的,但是总体上并不影响模型的可信度。
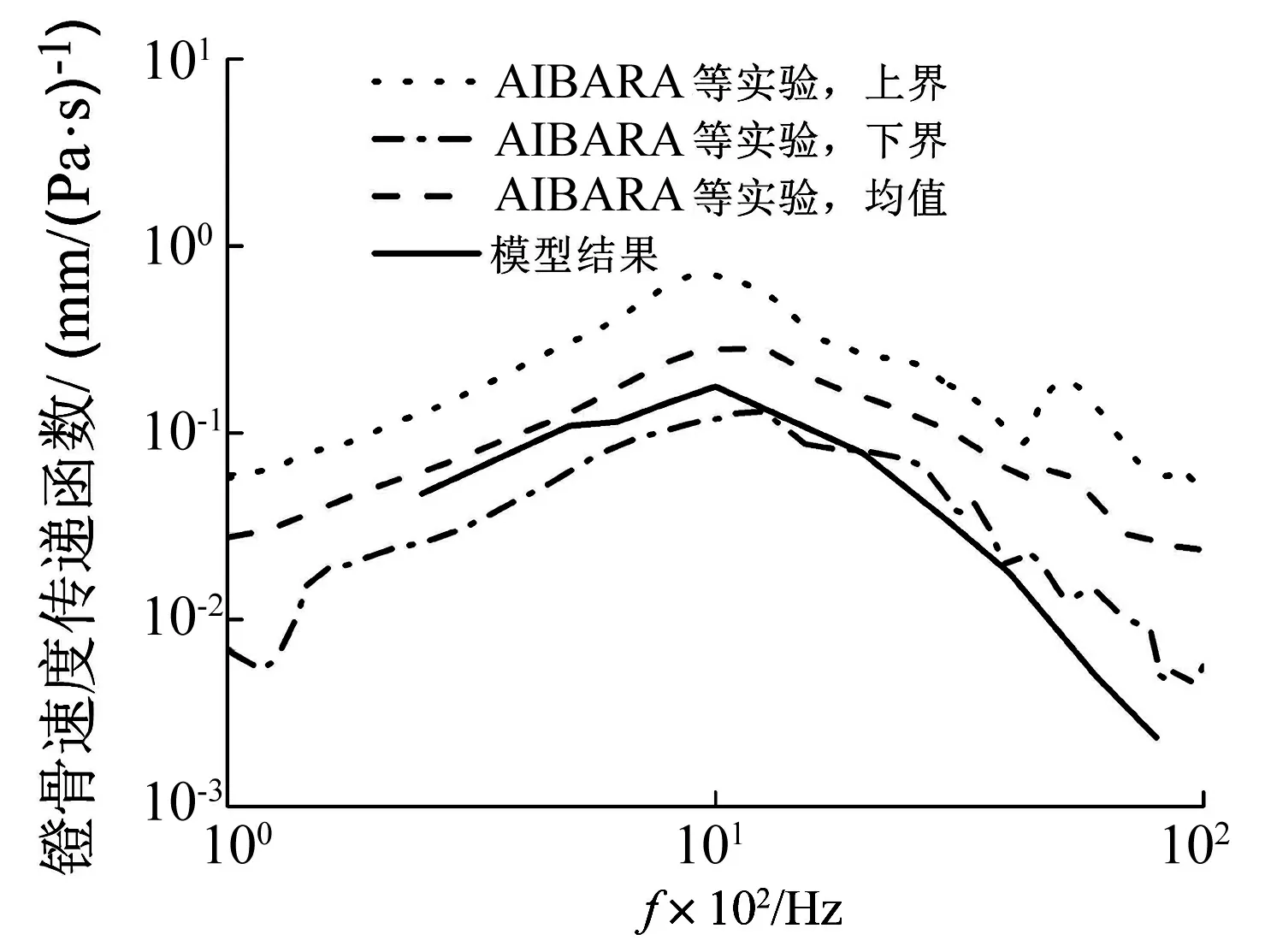
图2 镫骨足底板速度传递函数Fig.2 Stapes footplate velocity transfer function
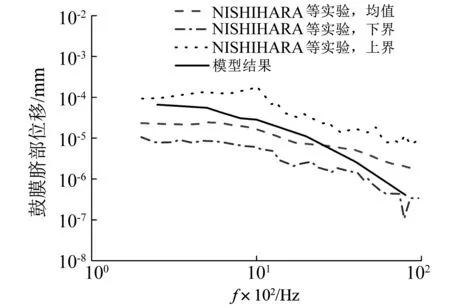
图3 鼓膜脐部位移频响曲线Fig.3 Displacement response of TM umbo
计算鼓膜脐部位移频响曲线(峰-峰值),与NISHIHARA等[37]基于64例正常人耳标本所测的实验数据对比,如图3所示。模型计算值在中低频段(<2 500 Hz)略高于实验均值,在高频段略低于实验均值,但在整个所测频段上,模型计算结果与实验值一致,并完全处于NISHIHARA等所得实验值的范围内。
基底膜的选频特性是验证模型中耳蜗部分可信度的重要依据,将模型计算结果与BÉKÉSY等[38-39]的实验报道进行比较,如图4所示。由图中可见,计算结果与实验曲线有着良好的一致性,表现为离镫骨的纵向距离越远,其所对应的特征频率越小,即基底膜上靠近蜗顶的位置对低频敏感,而靠近蜗底的位置对高频敏感,这证明了基底膜的选频特性。
为了进一步验证模型,本文还计算了基底膜纵向方向的特定部位的频响特性,以沿纵向距离蜗底12 mm处运动速度与镫骨足底板运动速度之比的幅值为例。对比模型计算结果与GUNDERSEN等[40]的实验值,如图5所示。可见,模型计算结果曲线与实验曲线吻合度良好,计算幅值最大值为在4 000 Hz处的20.83 dB,可见,4 000 Hz是基底膜上距离蜗底12 mm处的特征频率,此结论从图4也可以得出。
基底膜两侧的压差是其振动的动力,将此压差与外耳道激励声压的关系定义为耳蜗压力传递函数。在对耳蜗正向驱动时,耳蜗正向压力传递函数TFF可描述为式(3)
(3)
式中:PAC为外耳道鼓膜处的激励声压;PSV、PST分别为耳蜗前庭阶和鼓阶在蜗底的压力。将本文模型计算所得TFF与NAKAJIMA等[41]得到的实验数据进行对比,如图6所示。可见,在低频段模型计算曲线与实验曲线趋势一致,并且基本处于实验曲线内。在低频段(500~3 000 Hz),计算得到的正向压力传递函数曲线走势平稳,其幅值变化不超过2.5 dB。在整个测试频段内,幅值最大值为在500 Hz处的16.7 dB。
综合以上对比可知,本文模型的计算结果与实验测量值一致性良好,能够较为准确地模拟真实人耳尤其是耳蜗的传声特性。因此,本文所建人耳模型能够用于人工中耳植入特性的研究。
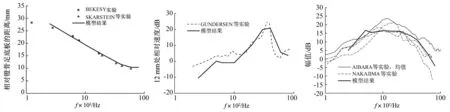

图4基底膜峰值响应的位置与频率的关系Fig.4Positionofpeakamplitudeonthebasilarmembrane 图5基底膜上距离蜗底12mm处相对速度Fig.5LevelofrelativeBMvelocityat12mmfromthebase图6正向压力传递函数幅值Fig.6Magnitudeofforwardpressuretransferfunctionversusfrequency
2.2 振子横截面积分析
参考TIAN等和ZHANG等,以下所有分析过程中,在振子自由端均施加50 μN的激振力,以激振起近似100 dB鼓膜声激振下的基底膜位移量。
振子横截面积变化对振子补偿听力的影响如图7所示,其中,图7(a)对应振子直接激励圆窗;图7(b)对应引入杨氏模量0.35 MPa的隔膜;图7(c)对应引入杨氏模量3.5 MPa的隔膜;图7(d) 对应引入杨氏模量35 MPa的隔膜。
如图7(a)所示,在振子直接激励圆窗时,其横截面积为圆窗面积75%和100%时,二者对ESP的影响几乎是等效的,均使ESP随着频率的增大而增大。其中, ESP最小值分别为250 Hz处的65.4 dB和62.3 dB,最大值为在8 000 Hz处的118 dB。在250~8 000 Hz,这两组曲线均低于其余两组曲线,尤其是在中低频段(250~2 000 Hz)与之相差较多,差值最多可达约55 dB(250 Hz处)。振子横截面积为圆窗面积的25%时,在高频段(6 000~8 000 Hz),ESP曲线随频率增大而略有下降;而为圆窗面积的50%时,ESP曲线随频率增大而平稳上升,ESP最小值位于250 Hz处的103.2 dB,最大值位于8 000 Hz处的130.6 dB。可见,振子直接激励圆窗时,振子横截面积的增大不利于提高其对耳蜗的激振效果。
如图7(b)所示,在引入杨氏模量为0.35 MPa的隔膜后,明显改善了横截面积为圆窗75%和100%时振子的激振性能,二者所对应的ESP曲线最小值分别被提高至位于250 Hz处的101.6 dB和92.8 dB,最大值分别被提高至位于8 000 Hz处的134.39 dB和137.35 dB。横截面积为圆窗面积的50%时,振子的激振性能在6 000~8 000 Hz略有下降,但是在8 000 Hz处的ESP值依然高达120.7 dB。横截面积为圆窗面积25%的振子所对应的ESP曲线,在2 000~8 000 Hz下降较为明显,但是整个曲线均位于100 dB以上。
如图7(c)和图7(d)所示,引入3.5 MPa和35 MPa的隔膜,对振子激振效果的影响在趋势上与引入0.35 MPa的隔膜是一致的,只是影响程度不同。通过综合对比图7,可知,在振子横截面积较小时(25%和50%),有无隔膜对振子激振性能影响较小;而对振子横截面积较大时(75%和100%),引入隔膜能够减小其与横截面积较小时振子激振性能之间的差别,即隔膜的引入减少了横截面积的变化对振子植入性能的影响。
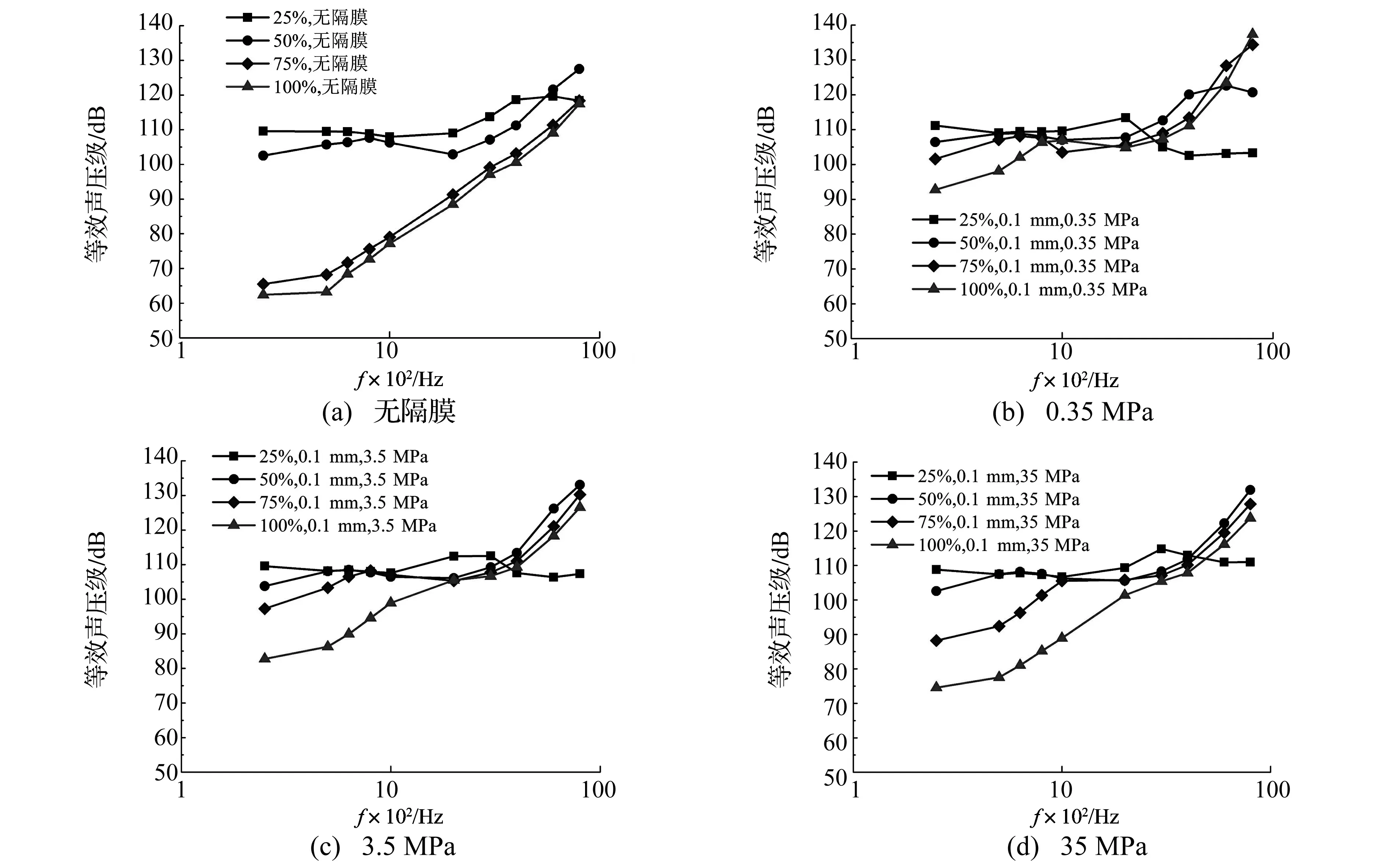
图7 振子横截面积对等效声压级的影响Fig.7 The effect of the actuator’s cross-section area on ESP
2.3 隔膜杨氏模量分析
为了更直观地反映出隔膜杨氏模量的变化对振子激振效果的影响,仅改变隔膜的杨氏模量,研究其对等效声压级的影响。圆窗结构十分微小,考虑到客观事实中振子制造的难易程度,本文在研究隔膜的杨氏模量以及厚度变化的影响时,取振子的横截面积为圆窗面积的100%,即2 mm2。
隔膜杨氏模量的变化对振子补偿听力的影响如图8所示。由图中可见,在250~8 000 Hz,ESP随着隔膜的杨氏模量增大而减小,尤其是在低频段(250~2 000 Hz)这一趋势更为明显,在250 Hz处,ESP值减小了18.17 dB。隔膜杨氏模量从1.75 MPa变化至35 MPa时,在中高频段(3 000~8 000 Hz)对ESP影响几乎是等效的,以8 000 Hz处为例,仅使ESP从127.78 dB变化至123.75 dB。从图中还可以发现,在250~8 000 Hz,引入隔膜后的ESP曲线明显均高于振子直接激励圆窗的ESP曲线。例如:ESP值在250 Hz处增大了12.17~30.34 dB;在1 000 Hz处的增大了11.72~29.72 dB;在8 000 Hz处增大了6.28~19.87 dB。因此,在研究范围内,较小的隔膜杨氏模量有利于提升振子的激振性能。
2.4 隔膜厚度分析
使隔膜杨氏模量保持0.35 MPa不变,取振子的横截面积为2 mm2,其厚度的变化对振子补偿听力的影响如图9所示。在1 000~2 000 Hz频段,隔膜厚度的变化对ESP的影响是等效的。在低频段(250~1 000 Hz)和中频段(2 000~4 000 Hz),ESP值随着隔膜厚度的增大而增大,除3 000~4 000 Hz频段增大幅度较大(10.67 dB,4 000 Hz处)外,其余频段增大幅度很小,最多仅有3.92 dB(250 Hz处)。在4 000~7 000 Hz频段,随着隔膜厚度的增大,ESP值变化较为复杂,且各ESP曲线(除隔膜厚度为0.1 mm外)在此频段均有一个转折点,使ESP曲线在此点后呈下降趋势。在高频段(7 000~8 000 Hz),隔膜厚度的增加会明显降低ESP值,以8 000 Hz处为例,隔膜厚度从0.1 mm变化到0.4 mm时,ESP值从137.35 dB降低至118.20 dB,对比中低频段,此减小值(19.15 dB)较大。而感音神经性耳聋多发生在高频段,因此,设计圆窗激励式人工中耳时,应尽量使隔膜更薄。
2.5 振子质量分析
使隔膜杨氏模量保持0.35 MPa、厚度保持0.1 mm不变,振子质量变化对振子补偿听力的影响如图10所示。在中低频段(250~3 000 Hz),振子质量变化对其激振性能影响较小,各ESP曲线相差最大值仅为4.6 dB(630 Hz处)。在3 000~6 500 Hz频段,ESP曲线随质量的变化较为复杂,但在总体变化趋势上表现为振子质量的增大不利于其激振性能的提升。在6 500~8 000 Hz频段,振子质量从2.25 mg变化至35 mg时,ESP值随之减小。在8 000 Hz处ESP值由137.35 dB变化至103.21 dB,对比中低频段,此减小值(34.14 dB)较大。由于感音神经性耳聋多发生在高频段,因此,设计圆窗激励式人工中耳时,应尽量减小振子的质量。


图8 隔膜杨氏模量变化对等效声压级的影响Fig.8TheeffectofthecouplinglayersYoungsmodulusonESP图9 隔膜厚度变化对等效声压级的影响Fig.9TheeffectofthecouplinglayersthicknessonESP图10 振子质量变化对等效声压级的影响Fig.10TheeffectoftheactuatorsmassonESP
2.6 预压力分析
在圆窗上施加的恒定预压力对圆窗激励的影响,如图11所示。为方便计算,仅计算250~4 000 Hz频段,纵坐标代表施加预压力与无预压力在等效声压级上的差值。由图11可知,在低频段(250~700 Hz),施加10 μN的恒定预压力会降低对耳蜗的激振效果;在700~4 000 Hz会提高对耳蜗的激振效果。总体来说,在250~4 000 Hz频段,该差值仅从-0.31 dB(250 Hz处)变化至0.38 dB(2 000 Hz处),变化较小。考虑到感音神经性听力损伤多发生在高频段,这种施加初始压力提高中、高频段等效声压级的特性对该类听力损伤的补偿特别有益。可见,为了提高圆窗激励式人工中耳的听力补偿效果,应在植入振子时给振子施加预压力。
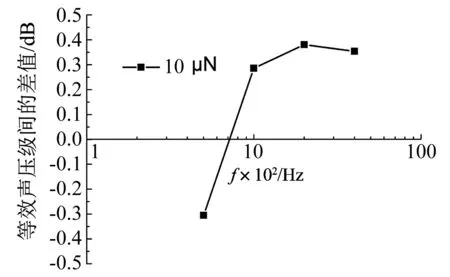
图11 在圆窗上施加预压力对等效声压级的影响Fig.11 The effect of the static force on the ESP
3 结 论
本文采用CT扫描以及逆向成型技术建立了包含中耳和内耳的人耳有限元模型,并且通过与相关实验数据进行对比,验证了该模型的可靠性。利用该模型分析了设计圆窗激励式人工中耳振子及其耦合方式时所面临的问题,结果表明:
(1)振子横截面积越大,其对耳蜗的激励效果越差,但可以通过在振子与圆窗之间引入隔膜来改善这一影响。
(2)隔膜的引入有利于提高振子的激振性能,在文中研究范围内,较小的隔膜杨氏模量和厚度有利于提升振子的激振性能。
(3)振子质量的增加会恶化振子在高频段的植入性能,故设计振子时,应使其质量尽可能小。
(4)在圆窗上施加的恒定预压力能够提高中高频段上对耳蜗的激振效果。
[ 1 ] MEISTER H, LAUSBERG I, KIESSLING J, et al. Determining the importance of fundamental hearing aid attributes [J]. Otology & Neurotology, 2002, 23(4): 457-462.
[ 2 ] KIM M K, YOON Y H, PARK I Y, et al. Design of differential electromagnetic transducer for implantable middle ear hearing device using finite element method [J]. Sensors and Actuators A Physical, 2006, 130(Sup1):234-240.
[ 3 ] HORLBECK D. Fully implantable ossicular stimulator [J]. Operative Techniques in Otolaryngology-Head and Neck Surgery, 2010, 21(3): 207-210.
[ 4 ] GAN R Z, DAI C, WANG X, et al. A totally implantable hearing system-design and function characterization in 3D computational model and temporal bones [J]. Hearing Research, 2010, 263(1): 138-144.
[ 5 ] BALL G R. The vibrant soundbridge: design and development [J]. Advances in Oto-Rhino-Laryngology, 2010, 69:1-13.
[ 6 ] LIU H G, TA N, MING X F, et al. Design of floating mass type piezoelectric actuator for implantable middle ear hearing devices [J]. Chinese Journal of Mechanical Engineering, 2009, 22(2): 221-226.
[ 7 ] 刘后广, 塔娜, 饶柱石. 新型人工中耳压电振子设计 [J]. 振动与冲击, 2011, 30(7): 112-115. LIU Houguang, TA Na, RAO Zhushi.Design of a new type of piezoelectric actuator for middle ear implant [J]. Journal of Vibration and Shock, 2011, 30(7): 112-115.
[ 8 ] TRINGALI S, PERGOLA N, BERGER P, et al. Fully implantable hearing device with transducer on the round window as a treatment of mixed hearing loss [J]. Auris Nasus Larynx, 2009, 36(3): 353-358.
[ 9 ] GOLL E, DALHOFF E, GUMMER A W, et al. Concept and evaluation of an endaurally insertable middle-ear implant [J]. Medical Engineering & Physics, 2013, 35(4): 532-536.
[10] KALTENBACHER D, SCHACHTELE J, GOLL E, et al. Design study of a miniaturized displacement transducer (MDT) for an active middle ear implant system [J]. Biomedical Microdevices, 2014, 16(6): 805-814.
[11] HAMANISHI S, KOIKE T, MATSUKI H, et al. A new electromagnetic hearing aid using lightweight coils to vibrate the ossicles [J]. IEEE Transactions on Magnetics, 2004,40(5): 3387-3393.
[12] SONG Y L, JIAN J T, CHEN W Z, et al. The development of a non-surgical direct drive hearing device with a wireless actuator coupled to the tympanic membrane [J]. Applied Acoustics, 2013, 74(12): 1511-1518.
[13] PERKINS R, FAY J P, RUCKER P, et al. The EarLens system: new sound transduction methods [J]. Hearing Research, 2010, 263(1/2): 104-113.
[14] NAKAJIMA H H, MERCHANT S N, ROSOWSKI J J. Performance considerations of prosthetic actuators for round-window stimulation[J]. Hearing Research, 2009, 263(1/2): 114-119. [15] SPRINZL G M, WOLF-MAGELE A, SCHNABL J, et al. The active middle ear implant for the rehabilitation of sensorineural, mixed and conductive hearing losses [J]. Laryngo-Rhino-Otologie, 2011, 90(9): 560-569.
[16] BELTRAME A M, MARTINI A S, GIARBINI N, et al. Coupling the vibrant soundbridge to cochlea round window: auditory results in patients with mixed hearing loss [J]. Otology & Neurotology, 2009, 30(2): 194-201.
[17] MAIER H, SALCHER R, SCHWAB B, et al. The effect of static force on round window stimulation with the direct acoustic cochlea stimulator [J]. Hearing Research, 2013, 301(7): 115-124.
[18] SALCHER R, SCHWAB B, LENARZ T, et al. Round window stimulation with the floating mass transducer at constant pretension [J]. Hearing Research, 2014, 314(8): 1-9.
[19] KOKA K, HOLLAND N J, LUPO J E, et al. Electrocochleographic and mechanical assessment of round window stimulation with an active middle ear prosthesis [J]. Hearing Research, 2009, 263(1/2): 128-137.
[20] GOSTIAN A O, PAZEN D, ORTMANN M, et al. Impact of coupling techniques of an active middle ear device to the round window membrane for the backward stimulation of the cochlea [J]. Otology & Neurotology, 2015, 36(1): 111-117.
[21] 刘迎曦, 李生, 孙秀珍. 人耳传声数值模型 [J]. 力学学报, 2008, 40(1): 107-113. LIU Yingxi, LI Sheng, SUN Xiuzhen. Numerical modeling of human ear for sound transmission [J]. Chinese Journal of Theoretical and Applied Mechanics, 2008, 40(1): 107-113.
[22] 王学林, 周健军, 凌玲, 等. 含主动耳蜗的人耳传声有限元模拟 [J]. 振动与冲击, 2012, 31(21): 41-45. WANG Xuelin,ZHOU Jianjun,LING Ling, et al. FE simulation of sound transmission in human ear with an active cochlea model [J]. Journal of Vibration and Shock, 2012, 31(21): 41-45.
[23] 姚文娟, 崔存玉, 陈懿强. 高压对耳蜗的影响 [J]. 医用生物力学, 2016, 31(1):40-49. YAO Wenjuan, CUI Cunyu, CHEN Yiqiang, et al. Effects of high pressure on the cochlea [J]. Journal of Medical Biomechanics, 2016, 31(1):40-49.
[24] 朱翊洲, 陈力奋, 张天宇, 等. 中耳有限元分析中内耳淋巴液作用的等效模型研究 [J]. 振动与冲击, 2010, 29(7): 79-82. ZHU Yizhou,CHEN Lifen,ZHANG Tianyu, et al. Equivalent model of cochlear lymphfluid in middle ear finite element analysis [J]. Journal of Vibration and Shock, 2010, 29(7): 79-82.
[25] FEI Z, KOIKE T, JIE W, et al. Finite element analysis of the middle ear transfer functions and related pathologies [J]. Medical Engineering & Physics, 2009, 31(8): 907-916.
[26] 王学林, 胡于进. 蜗窗激励评价的有限元计算模型研究 [J]. 力学学报, 2012, 44(3): 622-630. WANG Xuelin, HU Yujin. Evaluation of round window stimulation by a FE model of human auditory periphery [J]. Chinese Journal of Theoretical and Applied Mechanics, 2012, 44(3): 622-630.
[27] 刘后广, 塔娜, 饶柱石. 悬浮振子对中耳声传播特性影响的数值研究 [J]. 力学学报, 2010, 42(1): 109-114. LIU Houguang, TA Na, RAO Zhushi. Numerical study of the effect of the floating mass transducer on middle ear sound transmission [J]. Chinese Journal of Theoretical and Applied Mechanics, 2010, 42(1): 109-114.
[28] 田佳彬, 饶柱石, 塔娜, 等. 人工中耳悬浮式压电振子的优化设计[J].振动与冲击, 2015, 34(5):135-140. TIAN Jiabin, RAO Zhushi, TA Na, et al. Optimal design of a floating mass type piezoelectric actuator for implantable middle ear hearing devices [J]. Journal of Vibration and Shock, 2015, 34(5):135-140.
[29] ZHANG X M, GAN R Z. A comprehensive model of human ear for analysis of implantable hearing devices [J]. IEEE Transactions on Bio-Medical Engineering, 2011, 58(10): 3024-3027.
[30] TIAN J B, HUANG X S, RAO Z S, et al. Finite element analysis of the effect of actuator coupling conditions on round window stimulation [J]. Journal of Mechanics in Medicine and Biology, 2015, 15(4)1550048.
[31] ATTURO F, BARBARA M, RASK-ANDERSEN H. Is the human round window really round? An anatomic study with surgical implications [J]. Otology & Neurotology: Official Publication of the American Otological Society, American Neurotology Society and European Academy of Otology and Neurotology, 2014, 35(8): 1354-1360.
[32] ZWISLOCKI J. Analysis of the middle-war function. Part I: input impedance [J]. Journal of the Acoustical Society of America, 1962, 34(9B): 1514-1523.
[33] GENTIL F, PARENTE M, MARTINS P, et al. The influence of the mechanical behaviour of the middle ear ligaments: a finite element analysis [J]. Proceedings of the Institution of Mechanical Engineers Part H:Journal of Engineering in Medicine, 2011, 225(1): 68-76.
[34] GAN R Z, SUN Q L, FENG B, et al. Acoustic-structural coupled finite element analysis for sound transmission in human ear-pressure distributions [J]. Medical Engineering & Physics, 2006, 28(5): 395-404.
[35] VOLANDRI G, DI P F, FORTE P, et al. Biomechanics of the tympanic membrane [J]. Journal of Biomechanics, 2011, 44(7): 1219-1236.
[36] AIBARA R, WELSH J T, PURIA S, et al. Human middle-ear sound transfer function and cochlear input impedance [J]. Hearing Research, 2001, 152(1/2): 100-109.
[37] GAN R, WOOD T W, DORMER T J. Human middle ear transfer function measured by double laser interferometry system [J]. Otology & Neurotology, 2004, 25(4): 423-435.
[38] BÉKÉSY G V. Experiments in hearing [M]. New York:McGraw-Hill,1960.
[39] KRINGLEBOTN M, GUNDERSEN T, KROKSTAD A, et al. Noise-induced hearing losses. Can they be explained by basilar membrane movement? [J]. Acta Oto-Laryngologica, 1979, 360(Sup1):98-101.
[40] GUNDERSEN T, SKARSTEIN O, SIKKELAND T. A study of the vibration of the basilar membrane in human temporal bone preparations by the use of the mossbauer effect [J]. Acta Oto-Laryngologica, 2009, 86(3/4): 225-232.
[41] NAKAJIMA H H, DONG W, OLSON E S, et al. Differential intracochlear sound pressure measurements in normal human temporal bones [J]. Jaro-Journal of the Association for Research in Otolaryngology, 2009, 10(1): 23-36.
The effect of an actuator and its coupling conditions on round window-stimulated middle ear implants: a numerical analysis
XUDan1,LIUHouguang1,TIANJiabin2,RAOZhushi2,CHENGGang1,YANGJianhua1
(1.School of Mechatronic Engineering, China University of Mining and Technology, Xuzhou 221116, China; 2. Institute of Vibration,Shock and Noise,State Key Laboratory of Mechanical System and Vibration, Shanghai Jiao Tong University,Shanghai 200240,China)
Consisting of the actuator and a coupling layer, a finite element (FE) model of the human ear was used to analyze the effect of the actuator and its coupling conditions on the performance of round window-stimulated (RW-S) middle ear implants (MEIs). The model, based on the right ear of a healthy adult, was built via micro-computer tomography imaging and the technique of reverse engineering. The validity of the model was verified by comparing the model simulated results with experimental data. The influence of the constant pretension of the round window, two main design parameters of the actuator and two aspects of the coupling layer were investigated by the FE model. The results show that: the larger cross-section of the actuator, the worse effect on the implant performance of the RW-S MEI; the introduction of coupling layer between the actuator and RW could effectively improve the implant performance of RW stimulation; however, the degree of this improvement would be reduced with the increase of the thickness and the Young’s modulus of the coupling layer in the research scope; the actuator’s stimulated performance at high frequencies will be deteriorated with the increase of the actuator’s mass; the constant pretension applied to the round window is beneficial for sound transmission to the cochlear at middle-high frequency range.
middle ear implants; round window; actuator; coupling layer; finite element analysis
江苏省自然科学基金资助项目(BK20130194);国家自然科学基金资助项目(51305442);中国博士后科学基金资助项目(2015T80597;2013M530276)
2016-05-09 修改稿收到日期:2016-07-14
徐丹 女,硕士生,1991年生
刘后广 男,副教授,博士生导师,1982年生
R318.01
A
10.13465/j.cnki.jvs.2017.04.003
