磷酸催化β-D-吡喃葡萄糖热解脱水反应的密度泛函理论研究
2017-03-08蒋晓燕张镇西董长青
胡 斌, 陆 强, 蒋晓燕, 张镇西, 董长青
(华北电力大学 生物质发电成套设备国家工程实验室, 北京 102206)
磷酸催化β-D-吡喃葡萄糖热解脱水反应
的密度泛函理论研究

HU Bin
胡 斌, 陆 强*, 蒋晓燕, 张镇西, 董长青
(华北电力大学 生物质发电成套设备国家工程实验室, 北京 102206)
为揭示磷酸催化纤维素热解时可以显著促进脱水反应发生的催化机理,以β-D-吡喃葡萄糖为纤维素模型化合物,利用密度泛函理论方法研究了磷酸对其热解脱水反应的作用机理。结果表明:催化热解过程中β-D-吡喃葡萄糖和磷酸通过氢键作用形成多个可能的反应复合物,氢键能够稳定反应复合物结构,不同反应复合物引发β-D-吡喃葡萄糖不同位点的1,2-脱水反应和1,3-脱水反应。与非催化相比,磷酸催化作用下β-D-吡喃葡萄糖的脱水反应活化能显著降低,其中8个位点的1,2-脱水反应活化能降低了79~129 kJ/mol,2个位点的1,3-脱水反应活化能降低了28~60 kJ/mol。β-D-吡喃葡萄糖发生1,2-脱水反应的活化能更低,比1,3-脱水反应更容易发生,且以4-OH+3-H、1-OH+2-H、3-OH+2-H和3-OH+4-H这4个位点的1,2-脱水反应为主。
催化热解;磷酸;脱水反应;纤维素;葡萄糖;密度泛函理论
热化学转化是一种重要的生物质资源利用方式。在不同的生物质热化学转化技术中,催化剂常用于定向调控反应过程以获得特定的目标产物[1-4]。磷酸作为一种酸催化剂,可以显著改变生物质热解特性以及产物分布,在生物质催化热解制备高附加值化学品、生物质化学活化制备活性炭等领域均有应用[5-6]。对于生物质基本组分之一的纤维素,磷酸对其热解催化作用已有较多的研究。Nowakowski等[6]通过热重实验发现,当纤维素负载磷酸后,最大失重峰向低温区移动,焦炭产量由6.9%提高至22.4%。Skripchenteo等[7]发现磷酸催化纤维素热解不仅提高了焦炭产量,同时提高了焦炭中共轭双键的比例,这是由于磷酸促进了纤维素的脱水反应和脱水中间体的聚合反应[8]。纯纤维素快速热解生成的生物油中富含左旋葡聚糖,而Dobele等[8-9]以及其他团队[10-11]均发现,磷酸浸渍处理的纤维素热解生成的生物油中左旋葡聚糖含量明显降低,而其脱水产物则显著增加,这是由于磷酸可以显著促进脱水反应,从而促进左旋葡萄糖酮等脱水糖衍生物的生成。由此可知,磷酸在纤维素热解过程中,对脱水反应起到了关键作用,因此研究磷酸催化纤维素热解脱水反应的机理,是全面了解磷酸对于生物质热化学转化作用机理的基础。早期的机理研究中,学者们针对小分子醇类等模型化合物,研究了磷酸等质子酸对其脱水反应的影响,均认为磷酸等质子酸会首先解离出质子,随后反应物发生质子化,进而促进脱水反应的发生[12-13]。Bouchoux等[14]结合质谱和量化方法研究了乙二醇的脱水反应,提出了乙二醇质子化后经频哪醇重排脱水形成乙醛的反应机理。Nimlos等[15]计算了丙三醇在中性和酸性条件下的脱水反应机理,并指出丙三醇在中性条件下主要发生1,2-脱水和1,3-脱水反应,且1,3-脱水反应的活化能低于1,2-脱水反应;而在酸性条件下,丙三醇发生质子化,脱水反应主要发生质子转移。然而仅仅考虑质子的催化作用有很大的局限性,相关实验研究都已经证实不同的质子酸对纤维素表现出不同的催化热解特性[16-17],说明质子酸催化纤维素热解过程中并非只有质子参与催化反应,因此必须考虑质子酸分子整体对纤维素脱水反应的催化作用。Dobele等[18-19]指出浸渍过程中磷酸容易进入纤维内部,破坏其原有的氢键结构并形成新的氢键,磷酸和纤维素之间氢键的形成会影响纤维素热解特性,促进纤维素脱水反应。然而,目前还没有学者报道过磷酸和纤维素之间的氢键对纤维素热解反应的影响。密度泛函理论(DFT)[20-21]是一种行之有效的理论分析方法,可以从微观层面揭示反应机理,弥补实验方法的不足。基于此,本研究选取β-D-吡喃葡萄糖为纤维素模型化合物,利用量子化学手段——密度泛函理论研究了磷酸分子对其热解脱水反应的催化作用机理。
1 研究方法
1.1 计算方法
本研究所有计算均由Gaussian 09软件包[22]完成。选用密度泛函理论中B3LYP泛函[23-24]和6-31G(d)基组对反应物、过渡态和产物进行结构优化,然后在同一计算水平下进行振动分析[25],通过振动分析确定过渡态有唯一虚频,同时确定所有化合物具有正确的振动模式。随后经内禀坐标(IRC)[26-27]计算确定过渡态是势能面上的一阶鞍点,并连接着正确的反应物和产物。已有的研究[28-29]表明B3LYP泛函会低估反应活化能,Truhlar团队开发的M06-2X泛函[30]对此作了较大改进,因此,选取M06-2X泛函和def2-TZVP基组对所有已优化结构进行单点能计算,结合B3LYP/6-31G(d)理论水平下振动分析给出的热力学校正量得到热力学参数,并利用焓值计算反应活化能。
1.2 模型建立
β-D-吡喃葡萄糖(以下简称葡萄糖)的自由羟基可以绕C—C键轴自由旋转,形成3种旋转异构体,分别是gauche-gauche(GG)异构体、gauche-trans(GT)异构体和trans-gauche(TG)异构体。由于邻位交叉效应,GG旋转异构体是最稳定的构象[31]。本研究计算结果也得到相同的结论,其结构如图1所示,并对各原子进行了标号。此外,磷酸的结构也如图1所示,由于结构上的对称性,磷酸3个P—O单键键长均为0.161 1 nm,并且3个羟基的反应活性相同。

图1 葡萄糖(GG旋转异构体)及磷酸结构Fig.1 The structures of glucose (GG rotamer) and phosphoric acid


图2 脱水反应过渡态的结构预测Fig.2 Forecast for the structures of the transition states with dehydration reactions
由葡萄糖(GG异构体)结构分析可知,其可在8个位点(1-OH+2-H、2-OH+1-H、2-OH+3-H、3-OH+2-H、3-OH+4-H、4-OH+3-H、4-OH+5-H和6-OH+5-H)发生1,2-脱水反应,在2个位点(4-OH+6-H(OH)和6-OH+4-H(OH))发生1,3-脱水反应。
2 结果与分析
2.1 磷酸催化葡萄糖不同位点的1,2-脱水反应
在磷酸催化作用下,葡萄糖的5个羟基(1-OH、2-OH、3-OH、4-OH和6-OH)均可能和磷酸的羟基氢(H1(p))形成氢键,不同的氢键作用可形成5种反应复合物(RC1~RC5),分别引发葡萄糖在上述8个位点发生1,2-脱水反应,反应路径如图3所示,其中RC1和RC5分别只能引发葡萄糖在1个位点发生1,2-脱水反应,而RC2、RC3和RC4分别可以引发葡萄糖在2个位点发生1,2-脱水反应。

图3 磷酸催化的葡萄糖1,2-脱水反应Fig.3 1,2-Dehydration reactions of glucose catalyzed by phosphoric acid
1,2-脱水反应中反应复合物和过渡态的优化几何构型如图4所示,相关键长如表1所示。由图4和表1可知,脱水反应1中,葡萄糖在磷酸催化作用下发生1-OH+2-H位点的1,2-脱水反应。反应过程中,葡萄糖和磷酸首先通过氢键作用形成反应复合物RC1,并放出41.4 kJ/mol热量(ΔH=-41.4 kJ/mol)。复合物RC1中磷酸和葡萄糖之间形成3个氢键,分别为磷酸H1(p)和葡萄糖O1形成的氢键、磷酸O4(p)和葡萄糖H2形成的氢键、磷酸O3(p)和葡萄糖H12形成的氢键。前两个氢键的形成使得葡萄糖C1-O1键由0.139 6 nm伸长至0.142 1 nm,磷酸P-O1(p)键由0.161 1 nm缩短至0.159 2 nm,因此,磷酸通过RC1的形成会引发葡萄糖发生1-OH+2-H位点的1,2-脱水反应。

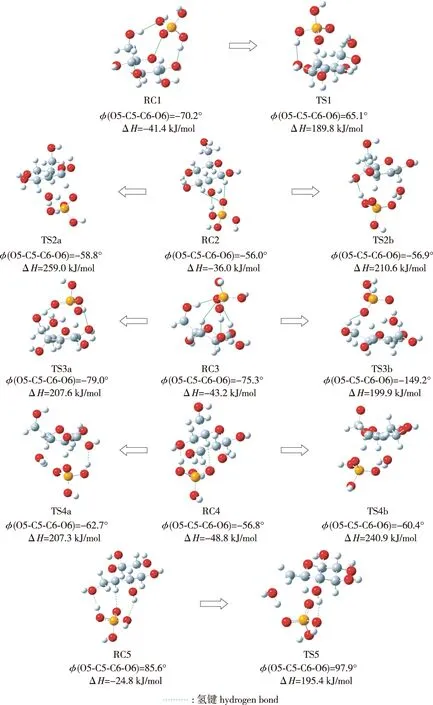
图4 1,2-脱水反应中反应复合物和过渡态的优化几何构型Fig.4 Optimized structure of reactant complexes and transition states in 1,2-dehydration reactions

脱水反应2~4中,葡萄糖和磷酸亦首先通过氢键作用形成反应复合物RC2、RC3和RC4,与脱水反应1不同的是复合物RC2、RC3和RC4的形成分别引发葡萄糖在2个位点发生1,2-脱水反应,反应过程中键长、二面角及能量变化如图4和表1所示。
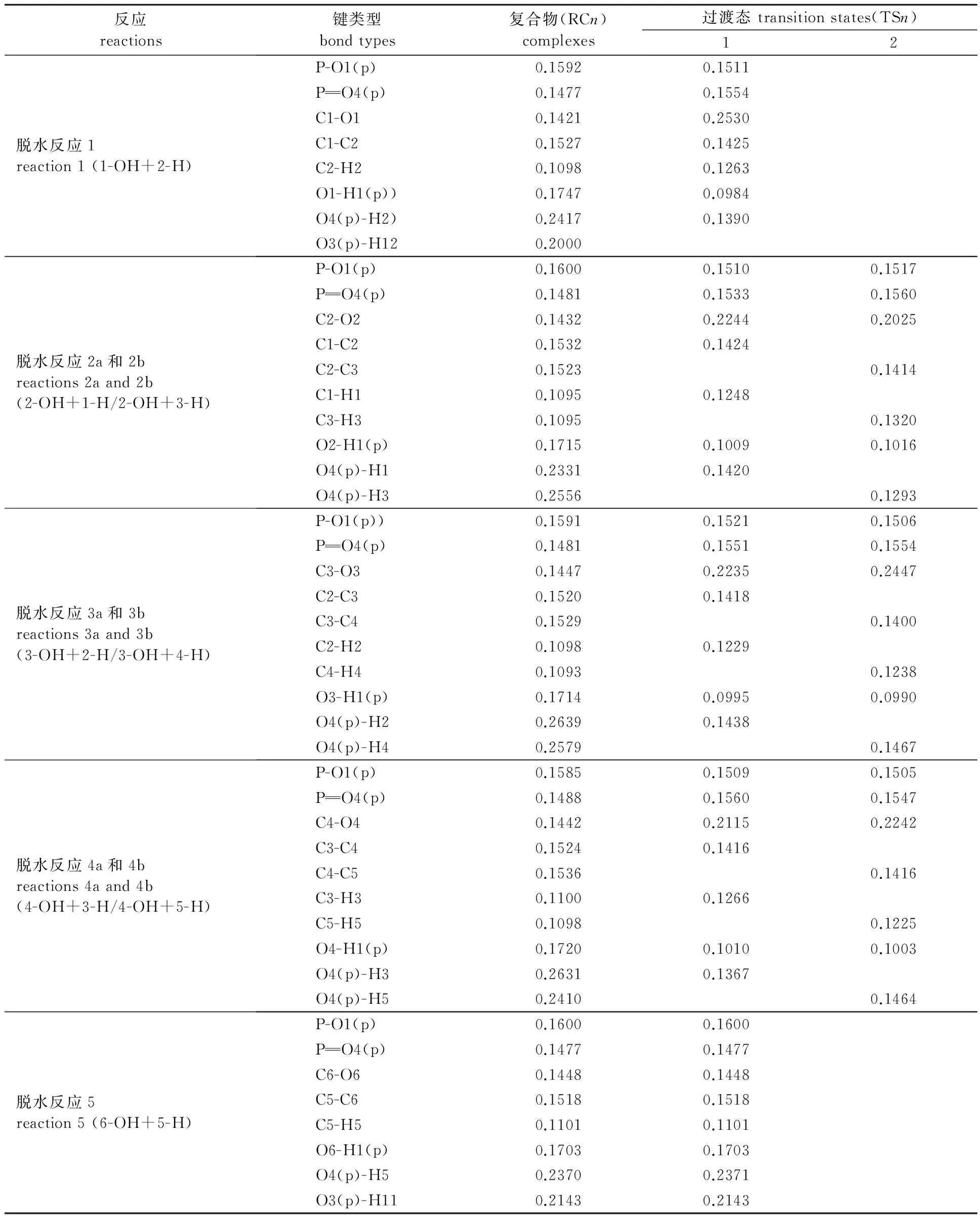
表1 1,2-脱水反应中反应复合物和过渡态的键长Table1 Bonds length of reactant complexes and transition states in 1,2-dehydration reactions nm



2.2 磷酸催化葡萄糖不同位点的1,3-脱水反应
在磷酸催化作用下,葡萄糖C4位和C6位羟基(4-OH和6-OH)均可能和磷酸的羟基氢(H1(p))形成氢键,形成2种反应复合物(RC6和RC7),分别引发葡萄糖在2个位点(4-OH+6-H(OH)和6-OH+4-H(OH))发生1,3-脱水反应,反应路径如图5所示。

图5 磷酸催化的葡萄糖1,3-脱水反应Fig.5 1,3-Dehydration reactions of glucose catalyzed by phosphoric acid
1,3-脱水反应中反应复合物和过渡态的优化几何构型如图6所示,相关键长如表2所示。由图6和表2可知,脱水反应6中,葡萄糖在磷酸催化作用下发生4-OH+6-H(OH)位点的1,3-脱水反应。反应过程中葡萄糖和磷酸首先通过氢键作用形成反应复合物RC6,并放出52.4 kJ/mol热量(ΔH=-52.4 kJ/mol)。复合物RC6中葡萄糖和磷酸间形成两个氢键,分别是磷酸H1(p)和葡萄糖O4形成的氢键、磷酸O4(p)和葡萄糖H12形成的氢键。RC6经过渡态TS6引发葡萄糖发生4-OH+6-H(OH)位点的1,3-脱水反应。过渡态TS6中葡萄糖和磷酸间没有氢键,并且过渡态结构过分扭曲,空间位阻很大,因此磷酸催化葡萄糖4-OH+6-H(OH)位点的1,3-脱水反应的活化能(ΔH)高达416.3 kJ/mol。
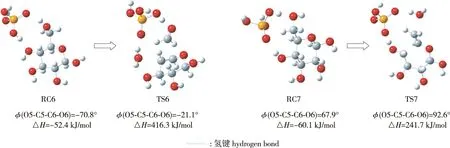
图6 1,3-脱水反应中反应复合物和过渡态的优化几何构型Fig.6 Optimized structure of reactant complexes and transition states in 1,3-dehydration reactions
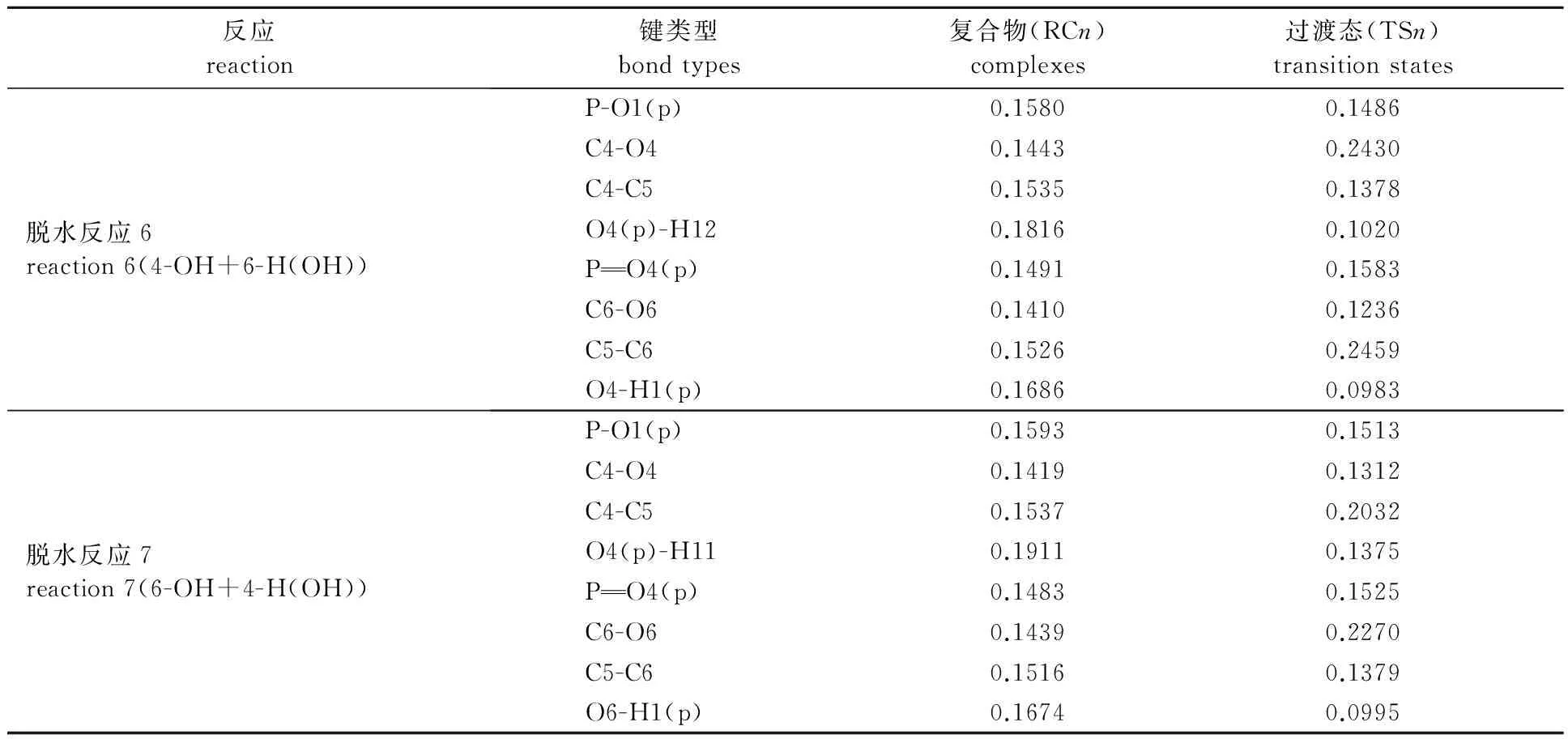
nm
脱水反应7中,葡萄糖和磷酸首先通过氢键作用形成反应复合物RC7,并放出60.1 kJ/mol热量(ΔH=-60.1 kJ/mol)。随后RC7经过渡态TS7发生6-OH+4-H(OH)位点的1,3-脱水反应,反应的活化能(ΔH)为241.7 kJ/mol。
2.3 磷酸催化葡萄糖热解脱水反应机理分析
由复合物结构分析可知,葡萄糖和磷酸之间会形成不同的氢键,因而可催化不同位点的脱水反应,证实了前人对磷酸催化纤维素热解机理的猜想[18-19]。氢键能够稳定反应复合物的结构,因此反应复合物的形成均会放出热量;而不同反应复合物形成的难易程度不同,所以其形成的焓变也不同。由图4可知,在1,2-脱水反应中,反应复合物RC4形成时放出的热量最多(ΔH=-48.8 kJ/mol),所以其最容易形成。由图6可知,在1,3-脱水反应中, RC6和RC7的形成均会放出大量的热量(ΔH=-52.4和-60.1 kJ/mol),所以两者均容易形成,而且RC6和RC7形成时释放的热量高于RC4形成时释放的热量,因此其比RC4更容易形成。
非催化和磷酸催化下各个位点1,2-脱水和1,3-脱水反应活化能如表3所示。对于1,2-脱水反应,非催化时, 6-OH+5-H位点的1,2-脱水反应的活化能最低,为297.5 kJ/mol;磷酸催化时,1-OH+2-H位点的1,2-脱水反应的活化能最低,为189.8 kJ/mol。与非催化相比,磷酸催化大幅降低了各个位点的反应活化能(降幅为79~129 kJ/mol),表明磷酸能够有效促进葡萄糖1,2-脱水反应的发生。对于1,3-脱水反应,非催化和磷酸催化时,葡萄糖均更容易在6-OH+4-H(OH)位点发生1,3-脱水反应,磷酸的加入也降低了反应活化能(降幅为28~60 kJ/mol),说明磷酸也会促进葡萄糖1,3-脱水反应的发生。对比上述两类脱水反应,磷酸催化时大多数位点1,2-脱水反应比1,3-脱水反应的活化能更低,说明1,2-脱水反应更容易发生,所需的反应温度更低。上述磷酸催化效果也与前人的实验研究结论相吻合:磷酸催化下纤维素的最大失重温度向低温区移动[6],且焦炭中碳碳双键的比例明显增加[7]。
磷酸催化时,不同位点的脱水反应活化能差别较大,其中2个位点的1,2-脱水反应(2-OH+1-H和4-OH+5-H)和2个位点的1,3-脱水反应(4-OH+6-H(OH)和6-OH+4-H(OH))活化能相对较高,尤其是4-OH+6-H(OH)位点的1,3-脱水反应无论在磷酸催化或者非催化条件下,活化能均超过400 kJ/mol,说明该反应几乎是不可能发生的。Hosoya等[32]指出反应复合物和过渡态氢键数目是造成活化能差别的重要原因。表3亦给出了所有脱水反应中反应复合物和过渡态中磷酸和葡萄糖之间的氢键数目,从表中可以看出,上述4个位点脱水反应的过渡态中磷酸和葡萄糖之间均没有氢键作用,而其他过渡态中均至少有一个氢键作用,氢键可以稳定过渡态的结构,因此其他位点的1,2-脱水反应活化能相差不多,且均低于上述4个位点脱水反应的活化能。4-OH+6-H(OH)位点的1,3-脱水反应具有最高的活化能则是由于不仅该反应的过渡态中没有氢键,而且过渡态结构扭曲、空间位阻大。
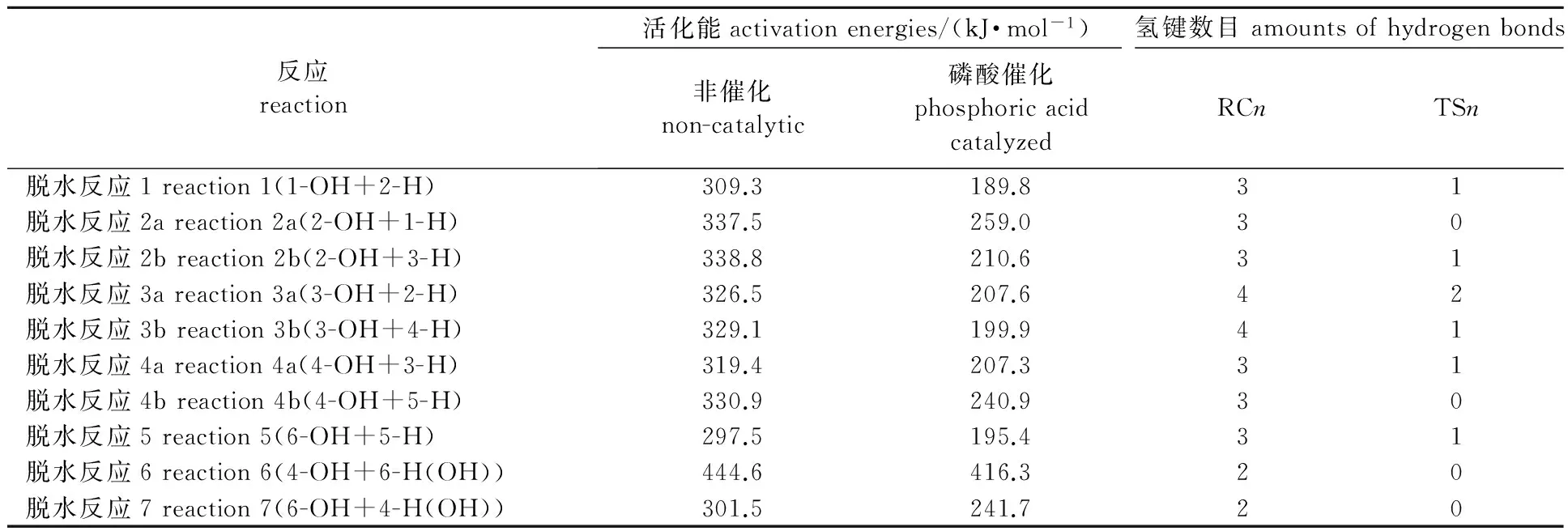
表3 不同反应条件下脱水反应活化能及化合物的氢键数目Table 3 Activation energies of dehydration reactions under different conditions and the number of hydrogen bonds in compounds
综上所述,磷酸催化葡萄糖发生1,3-脱水反应需要克服较高的反应能垒(尽管RC6和RC7的形成较容易),而1,2-脱水反应的能垒很低且可以在多个位点发生,因此磷酸催化条件下,葡萄糖更容易发生1,2-脱水反应。在1,2-脱水反应中,RC4的形成最容易(放出48.8 kJ/mol的热量),且由此引发的4-OH+3-H位点的1,2-脱水反应的活化能也较低(207.3 kJ/mol),因此该脱水反应会是磷酸催化葡萄糖热解脱水的主反应之一。此外,RC1和RC3的形成也比较容易(分别放出41.4和43.2 kJ/mol的热量),且由此引发的1-OH+2-H、3-OH+2-H和3-OH+4-H位点的脱水反应的活化能均较低(分别为189.8、207.6和199.9 kJ/mol),所以上述3个位点的1,2-脱水反应也会是磷酸催化葡萄糖热解脱水的主要反应。
3 结 论
本研究以β-D-吡喃葡萄糖为纤维素模型化合物,利用密度泛函理论方法对比研究了其在非催化和磷酸催化条件下的热解脱水反应,并分析了磷酸催化的作用机理。结果表明,磷酸催化葡萄糖热解过程中,磷酸和葡萄糖首先通过氢键作用形成多个可能的反应复合物,氢键能够稳定反应复合物结构,不同的反应复合物可以引发不同位点的1,2-脱水反应或1,3-脱水反应。与非催化相比,磷酸催化显著降低了脱水反应的活化能,其中8个位点的1,2-脱水反应活化能降低了79~129 kJ/mol,2个位点的1,3-脱水反应活化能降低了28~60 kJ/mol。氢键还能够稳定过渡态的结构,磷酸催化的1,3-脱水反应的过渡态中磷酸和葡萄糖之间没有氢键作用,而多数位点的1,2-脱水反应(2-OH+1-H和4-OH+5-H位点除外)的过渡态中均至少有一个氢键作用,因此葡萄糖发生1,2-脱水反应的活化能更低,也更容易发生,且以4-OH+3-H、 1-OH+2-H、 3-OH+2-H和3-OH+4-H位点的1,2-脱水反应为主。
[1]姚倩,徐禄江,张颖.催化快速热解生物质制备高附加值化学品研究进展[J].林产化学与工业,2015,35(4):138-144. YAO Q,XU L J,ZHANG Y.Production of high value-added chemicals by catalytic fast pyrolysis of biomass[J].Chemistry and Industry of Forest Products,2015,35(4):138-144.
[2]LIU C J,WANG H M,KARIM A M,et al.Catalytic fast pyrolysis of lignocellulosic biomass[J].Chemical Society Reviews,2014,43(22):7549-7623.
[3]YILDIZ G,RONSSE F,DUREN R,et al.Challanges in the design and operation of processes for catalytic fast pyrolysis of woody biomass[J].Renewable and Sustainable Energy Reivews,2016,57:1596-1610.
[4]FABA L,DIAZ E,ORDONEZ S.Recent developments on the catalytic technologies for the transformation of biomass into biofuels:A patent survey[J].Renewable and Sustainable Energy Reivews,2015,51:273-287.
[5]林冠烽,蒋剑春,吴开金,等.磷酸活化发制备纤维素基颗粒活性炭[J].林产化学与工业,2014,34(1):101-106. LIN G F,JIANG J C,WU K J,et.al.Preparation of cellulose-based cranular activated carbon using phosphoric acid as activator[J].Chemistry and Industry of Forest Products,2014,34(1):101-106.
[6]NOWAKOWSKI D J,WOODBRIDGE C R,JONES J M.Phosphorus catalysis in the pyrolysis behaviour of biomass[J].Journal of Analytical and Applied Pyrolysis,2008,83(2):197-204.
[7]SKRIPCHENTEO T,DOMBURG G,LUKSA R.Polyconjugated systems formed during thermal treatment of cellulose[J].Thermochimica Acta,1985,93:417-420.
[8]DOBELE G,MEIER D,FAIX O,et al.Volatile products of catalytic flash pyrolysis of celluloses[J].Journal of Analytical and Applied Pyrolysis,2001,58/59:453-463.
[9]DOBELE G,ROSSINSKAJA G,DIZHBITE T,et al.Application of catalysts for obtaining 1,6-anhydrosaccharides from cellulose and wood by fast pyrolysis[J].Journal of Analytical and Applied Pyrolysis,2005,74(1/2):401-405.
[10]ZANDERSONS J,ZHURINSH A,DOBELE G,et al.Feasibility of broadening the feedstock choice for levoglucosenone production by acid pre-treatment of wood and catalytic pyrolysis of the obtained lignocellulose[J].Journal of Analytical and Applied Pyrolysis,2013,103:222-226.
[11]ZHANG Z B,LU Q,YE X N,et al.Selective production of levoglucosenone from catalytic fast pyrolysis of biomass mechanically mixed with solid phosphoric acid catalysts[J].BioEnergy Research,2015,8(3):1263-1274.
[12]LEWIS D,KEIL M,SARR M.Gas phase thermal decomposition of tert-butyl alcohol[J].Journal of the American Chemical Society,1974,96(14):4398-4404.
[13]TSANG W.Thermal stability of alcohols[J].International Journal of Chemical Kinetics,1976,8(2):173-192.
[14]BOUCHOUX G,CHORET N,FLAMMANG R.Unimolecular chemistry of protonated diols in the gas phase:Internal cyclization and hydride ion transfer[J].The Journal of Physical Chemistry A,1997,101(23):4271-4282.
[15]NIMLOS M R,BLANKSBY S J,QIAN X,et al.Mechanisms of glycerol dehydration[J].The Journal of Physical Chemistry A,2006,110(18):6145-6156.
[16]JULIEN S,CHORNET E,OVEREND R P.Influence of acid pretreatment (H2SO4,HCl,HNO3) on reaction selectivity in the vacuum pyrolysis of cellulose[J].Journal of Analytical and Applied Pyrolysis,1993,27(1):25-43.
[17]PECHA B,ARAUZO P,GARCIA-PEREZ M.Impact of combined acid washing and acid impregnation on the pyrolysis of Douglas fir wood[J].Journal of Analytical and Applied Pyrolysis,2015,114:127-137.
[18]DOBELE G,DIZHBITE T,ROSSINSKAJA G,et al.Pre-treatment of biomass with phosphoric acid prior to fast pyrolysis :A promising method for obtaining 1,6-anhydrosaccharides in high yields[J].Journal of Analytical and Applied Pyrolysis,2003,68/69:197-211.
[19]DOBELE G,ROSSINSKAJA G,TELYSHEVA G,et al.Cellulose dehydration and depolymerization reactions during pyrolysis in the presence of phosphoric acid[J].Journal of Analytical and Applied Pyrolysis,1999,49(1/2):307-317.
[20]KOHN W,BECKE A D,G.PARR R.Density functional theory of electronic structure[J].The Journal of Physical Chemistry,1996,100(31):12974-12980.
[21]BECKE A D.Density-functional exchange-energy approximation with correct asymptotic behavior[J].Physical Review A,1988,38(6):3098-3100.
[22]FRISCH M J,TRUCKS G W,SCHLEGEL H B,et al.Gaussian 09,Revision D.01[M].Gaussian,Inc,Wallingford CT,2013.
[23]BECKE A D.Density-functional thermochemistry.III.The role of exact exchange[J].The Journal of Chemical Physics,1993,98(7):5648-5652.
[24]HAMPRECHT F A,COHEN A J,TOZER D J,et al.Development and assessment of new exchange-correlation functionals[J].The Journal of Chemical Physics,1998,109(15):6264-6271.
[25]WONG M W.Vibrational frequency prediction using density functional theory[J].Chemical Physics Letters,1996,256(4/5):391-399.
[26]GONZALEZ C,SCHLEGEL H B.An improved algorithm for reaction path following[J].The Journal of Chemical Physics,1989,90(4):2154-2161.
[27]GONZALEZ C,SCHLEGEL H B.Reaction path following in mass-weighted internal coordinates[J].The Journal of Physical Chemistry,1990,94(14):5523-5527.
[28]DOMINGO L R,ARN M,ANDR S J.Toward an understanding of molecular mechanism of domino cycloadditions.Density functional theory study of the reaction between hexafluorobut-2-yne and N,N′-dipyrrolylmethane[J].Journal of the American Chemical Society,1998,120(7):1617-1618.
[29]GOLDSTEIN E,BENO B,HOUK K N.Density functional theory prediction of the relative energies and isotope effects for the concerted and stepwise mechanisms of the Diels Alder reaction of butadiene and ethylene[J].Journal of the American Chemical Society,1996,118(25):6036-6043.
[30]PEVERATI R,TRUHLAR D G.Improving the accuracy of hybrid meta-GGA density functionals by range separation[J].The Journal of Physical Chemistry Letters,2011,2(21):2810-2817.
[31]UDDIN N,GHOSH M K,CHOI T H,et al.Gauche effects of glucopyranose by QM/MM-MD simulations[J].Theoretical Chemistry Accounts,2015,134:122.
[32]HOSOYA T,SAKAKI S.Levoglucosan formation from crystalline cellulose:Importance of a hydrogen bonding network in the reaction[J].ChemSusChem,2013,6(12):2356-2368.
Pyrolytic Dehydration Reactions ofβ-D-Glucopyranose Catalyzed by Phosphoric Acid Using Density Functional Theory
HU Bin, LU Qiang, JIANG Xiaoyan, ZHANG Zhenxi, DONG Changqing
(National Engineering Laboratory for Biomass Power Generation Equipment,North China Electric Power University, Beijing 102206, China)
:In order to investigate the catalytic mechanism that the dehydration reactions will be promoted by phosphoric acid in pyrolysis process,β-D-glucopyranose is selected as the model compound of cellulose, and the mechanism of pyrolytic dehydration reactions catalyzed by phosphoric acid is investigated using density functional theory method. The results indicate that during catalytic pyrolysis process,β-D-glucopyranose and phosphoric acid will interact to form several possible reaction complexes through hydrogen bonds. Different reaction complexes can initiate different 1,2-dehydration and 1,3-dehydration reactions ofβ-D-glucopyranose. Compared with the non-catalytic process, the activation energies of dehydration reactions decrease greatly in the phosphoric acid catalyzed process. The activation energies decrease by 79-129 kJ/mol for the eight 1,2-dehydration reactions, and 28~60 kJ/mol for the two 1,3-dehydration reactions. In addition, 1,2-dehydration is easier to occur than 1,3-dehydration in the catalytic process. And the 1,2-dehydration at 4-OH+3-H, 1-OH+2-H and 3-OH+2-H/4-H sites are predominant in the catalytic pyrolysis process.
catalytic pyrolysis;phosphoric acid;dehydration reactions;cellulose;glucose;density functional theory
10.3969/j.issn.0253-2417.2017.01.006
2016- 07-31
国家自然科学基金资助项目(51576064);中央高校基本科研业务费专项资金资助(2016YQ05,2015ZZD02)
胡 斌 (1992— ),男,河北保定人,博士生,主要从事生物质高效热化学转化机理的研究
*通讯作者:陆 强,副教授,硕士生导师,主要从事生物质高效热化学转化的研究;E-mail:qianglu@mail.ustc.edu.cn。
TQ35;TK6
A
0253-2417(2017)01- 0043- 11
胡斌,陆强,蒋晓燕,等.磷酸催化β-D-吡喃葡萄糖热解脱水反应的密度泛函理论研究[J].林产化学与工业,2017,37(1):43-53.
