离子液体中聚氧化乙烯(PEO)相变过程中的氢键效应
2019-04-28赵新军
赵新军,李 循
(1.伊犁师范学院 新疆凝聚态相变与微结构实验室, 伊宁 835000; 2. 伊犁师范学院微纳电传感器技术与仿生器械实验室, 伊宁 835000; 3. 新疆维吾尔自治区人民医院 泌尿外科, 乌鲁木齐 830000)
1 引 言
离子液体(IL)是由是由离子组成的液体, 在室温或室温附近温度下呈液态的由离子构成的物质,称为室温离子液体[1,2]. 与传统的有机溶剂相比, 室温离子液体具有优异的化学性能和热力学稳定性, 对有机和无机化合物有很好的溶解性. 由于离子液体几乎没有蒸气压, 而且不挥发、 无污染, 故也称之为“绿色溶剂”. 最近,聚合物/离子液体(IL)的二元系统以其独特的相行为和良好的应用前景已引起了相当大的关注,并引发了广泛的研究兴趣[3-7]. 在这样的系统中, 离子液体对于聚合物提供了绿色溶剂和特定的离子导体. 为了尽可能实现并优化实际应用功能, 深刻理解聚合物在离子液体中的相行为是非常必要的. 研究发现[9-18], 在聚合物/IL 体系中, 聚合物相变过程的低临界溶液温度(LCST)和上临界溶液温度(UCST)都可以被观察到.
聚氧化乙烯(PEO)又称聚环氧乙烷, 是一种结晶性、 热塑性的水溶性聚合物. 由于可以与水分子形成氢键, 使其成为一种溶性聚合物, 因此具有广泛的应用前景. 最近的研究发现[24-26], PEO 在室温离子液体中呈现出了独特的相行为, 其相变机理与实际应用有着密切联系, 已成为实验、 理论研究的热点[24-28]. Lee 等人[26]研究发现, PEO 在室温离子液体 [EMIM][BF4] 中呈现了异常的相行为,并且可由高浓度浊点的转移推断出临界体积分数. 通过热测量和 FT-IR 分析, Li 和 Wu[27]研究了 PEO 在 [EMIM][BF4] 中的热动可逆相变行为(dynamic thermally reversible phase transition). 研究发现, (a)PEO 在离子液体中呈现了相对较高的 LCST, 该温度不同于水溶液中的 LCST;(b)在该系统中发现了三种类型的氢键, 分别为 I 型氢键(形成于[EMIM]+环上的不饱和 C-H 基团和 PEO 的氧原子之间)、 II 型氢键(形成于 PEO 上的饱和 C-H 基团和 [BF4]-中的氟原子之间)和 III 型氢键(形成于[EMIM]+环上的不饱和 C-H 基团和 [BF4]-的氟原子之间); (c)观察到了一系列的相变滞后现象.
基于非常新颖而且有趣的实验结果[26,27], White 等人[28]应用平均场理论分析了 PEO/IL 中的奇异相变行为的起源, 定性地解释了实验结果. White 等人的模型认为, 由于 PEO 分子单体与 [EMIM]+或 [BF4]-间的作用, 体系中各种组分的凝聚会有效地减少混合熵, 还会出现较强的内聚能密度和较小的自由体积, 导致 PEO 在 [EMIM][BF4] 中出现了奇异相变行为. White 等人只是粗略地考虑了 PEO 分子单体与 [EMIM]+或 [BF4]-间的吸引和排斥作用, 分析了体系中能量竞争、 熵驱动的相变机制, 没有给出相变的微观本质, 也无法解释相变的滞后性. 事实上, 当 PEO 处在 [EMIM][BF4] 中, 系统中存在三种类型的氢键作用( I 型、 II 型和 III 型氢键), I 型、 II 型和 III 型氢键在其相变过程中发挥主导作用[27, 28]. 基于以上讨论分析, 可以认为, PEO 在 [EMIM][BF4] 中的相变行为应该与 I 型、II 型和 III 型氢键形成密切相关. 然而, 到目前为止还没有理论从形成这三种氢键的本质出发, 研究 PEO 在 [EMIM][BF4] 中的相变行为和相变的滞后性. 考虑三种氢键(I 型、 II 型和 III 型氢键)形成, 从分子层次研究 PEO 在 [EMIM][BF4] 中的相变行为和相变的滞后现象的本质, 对设计刺激响应的 PEO 材料是非常必要的.
本文我们将 Flory-Huggins 理论模型推广应用到 PEO/IL 体系, 研究 PEO 在 [EMIM][BF4] 中相变过程中的氢键效应. 理论模型考虑 PEO 在 [EMIM][BF4] 的三种类型的氢键(I 型、 II 型和 III 型氢键)作用. 形成氢键的思想源自于 Dormidontova、Ren 和 Zhao 等[29-31], 本文探讨氢键对 PEO 在[EMIM][BF4] 中相行为的影响, 并基于分子层次解释 PEO 在 [EMIM][BF4] 中的异常相变的机理、 以及相变的滞后性.
2 理论模型
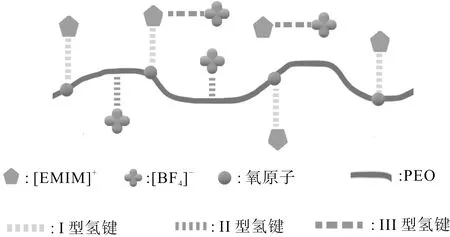
图 1 PEO/[EMIM][BF4]系统中三种氢键链接示意图.Fig.1 Schematic illustration of the three types of hydrogen bonds in PEO/[EMIM][BF4].
考虑 PEO/[EMIM][BF4] 二元系统. 每个 PEO 分子链有N≫1个单体, [EMIM][BF4] 分子中包含有一个 [EMIM]+和一个 [BF4]-, PEO、 [EMIM]+和 [BF4]-相应的单体单元为νP=0.065 nm3[31],νE=0.21 nm3和νF=0.03 nm3[32]. 为了从分子层次研究 PEO 在 [EMIM][BF4] 中的相变行为和相变的滞后性, 考虑 PEO 在 [EMIM][BF4] 的 I 型、 II 型和 III 型氢键作用, 以及考察三种类型氢键形成与 PEO 高分子构象的耦合特性. 另外, 值得提及的是, IV 型氢键([BF4]-和 PEO 链端羟基之间的氢键)也可以形成[27]. IV 型氢键关联会导致 PEO-氢键交联网络的形成, 这种氢键对于短链 PEO 在 [EMIM][BF4] 溶液中的相行为有一定的影响, 但是对于长链(单体数N≫1) PEO, IV 型氢键则不会影响 PEO 在 [EMIM][BF4] 中的相行为. 考虑长链 PEO 分子作为高斯链,体系中三种氢键作用、 各组分的平动熵[29,30]以及各种相互作用, PEO 在 [EMIM][BF4] 中的自由能可以表述为:
(1)
自由能第一项描述了体系的混合熵, 可以表示为:
(2)
式中β表示1/kBT,φ为 PEO 的体积分数.
自由能第二项Fint描述溶液中 PEO 单体与 [EMIM][BF4] 各离子之间的有效相互作用, 并可以表示为:
Fint=χφ(1-φ).
(3)
其中 χ 是 Flory 相互作用参数, 表示了相互作用强度.χ随温度的变化遵循以下标准形式
(4)
为了符合实验观测[26,27], 获得 PEO 在 [EMIM][BF4] 中的相行为机制, 可以取相应的参数值为:A=-0.39,B=139.
方程 (1) 右边的第三项是形成氢键对自由能的贡献. 根据文献[29-31], I 型、 II 型和 III 型氢键形成, 对自由能的贡献可以写为:
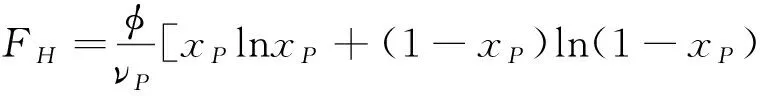
(5)
其中Fi(i=P,F,E)表示形成相应氢键的结合能与熵的损失[29-31], 不同的Fi对应于不同的氢键分数. 在上面的公式, 引入了三个额外的变量xP、xF和xE,可被定义为:
xP、xF和xE分别是 I 型、 II 型和 III 型氢键分数.nP,nF和nE分别是 I 型、 II 型和 III 型氢键的数目,NP、NF和NE分别是 PEO 单体、[EMIM]+和 [BF4]-数目.
对方程 (1) 的自由能取变分并最小化自由能可以得到三种氢键的分数xP、xF和xE分别为
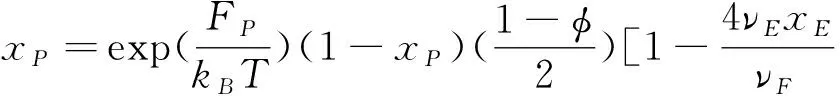
(7)

(8)
(9)
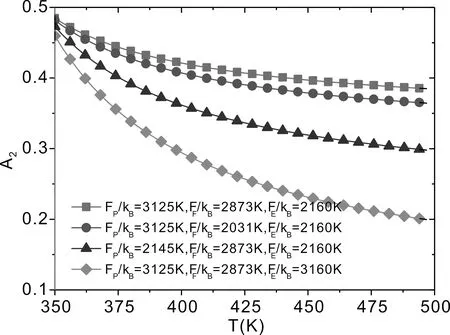
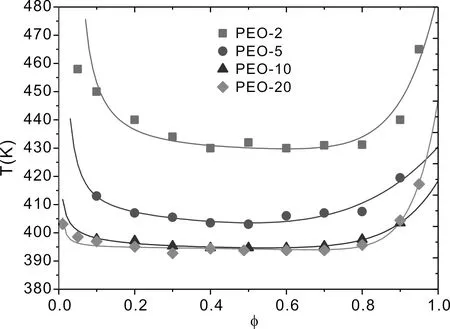
从方程可以看出,xP、xF和xE氢键分数之间的差别源于形成 I 型、 II 型和 III 型氢键的自由能, 如果FP>FF>FE, 那么xP大于xF和xE, 这意味着, I 型氢键比 II 型和 III 型氢键更易于形成; 反之, 如果FP 在本节中, 我们计算并讨论 PEO 在 [EMIM][BF4] 中相变过程中有关氢键效应的一些代表性结果. 为了详细地理解 I 型、 II 型和 III 型氢键在PEO/[EMIM][BF4]溶液中的作用, 我们研究三种类型的氢键分数随温度、 PEO 体积分数变化、 分析 PEO 在 [EMIM][BF4] 中的第二维里系数、 考察 PEO 在 [EMIM][BF4] 中的相图. 图 2 展现了在不同温度条件下, I 型、 II 型和 III 型氢键分数随 PEO 体积分数的变化关系, 从图中可以看出, 三种类型的氢键的分数在低温度时较大,随温度的升高三种氢键分数都在减小. 这是由于在温度较高时, 体系分子有较强的热运动, 减小了形成氢键的几率, 不利于分子间各种氢键形成. 图 2a 显示了随着 PEO 体积分数的增加, 在较小 PEO 体积分数条件下,I 型氢键分数只是轻微地降低, 并且在整个体积分数范围内保持较高的分数. 实验[32]报道了在 PEO 体积分数降低的过程, I 型的氢键链接会加强, 这是由于 PEO 在 [EMIM][BF4] 中 I 型氢键链接具有较强的结合能, 这使得 I 型氢键容易形成, 并且随着 PEO 体积分数的降低, 形成 I 型氢键的几率增多, 因此,在较小 PEO 体积分数条件下, I 型氢键具有较大的分数; 在较大 PEO 体积分数条件下, PEO 分子在溶液中占据了多数, 形成 I 型氢键的几率降低, 导致在较大 PEO 体积分数条件下φ>0.7, 随着 PEO 体积分数的增加, I 型氢键分数急剧减少. 图 2b 显示了随着 PEO 体积分数的增加, 在较小 PEO 体积分数条件下,II 型氢键分数也是轻微地降低, 但是, II 型的氢键分数少于 I 型的氢键分数.这是由于, I 型氢键链接比 II 型的氢键链接具有较强的结合能, 这使得 I 型氢键比 II 型氢键容易形成, 并且随着 PEO 体积分数的增加, 形成 II 型氢键的几率也会减少, 因此, 在当 PEO 体积分数φ>0.5 时, II 型氢键分数急剧降低. 图2 在不同温度条件下, I 型、II 型和 III 型氢键分数随 PEO 体积分数的变化关系.PEO 分子量为Mw=10500, 自由能参数为FP/kB=3125 K,FP/kB=2873 K,FP/kB=2061 K. Fig.2 The fractions of type I, type II and type III hydrogen bonds as a function of the volume fractions of PEO. The molecular weight of PEO isMw=10500. All curves are obtained using the same set of parameters:FP/kB=3125 K,FP/kB=2873 K,FP/kB=2061 K. 图 2c 显示了 III 型氢键分数随着 PEO 体积分数的增加急剧降低. 在相当大的 PEO 体积分数范围内(0<φ<0.5), I 型、II 型氢键分数保持较高的分数(图2a,图2b). 这是由于 [EMIM]+是 I 型与 III 型氢键的共同供体, 同时 [BF4]-也是 II 型和 III 型氢键的共同供体, 三种类型的氢键形成相互竞争, 因此, 随着温度或 PEO 聚合物浓度的增加, 三中氢键重组. 从图 2c 还可以看出, 随着 PEO 体积分数的增加, III 型氢键急剧减少趋近于零, 当 PEO 分子在溶液中的占据了多数. [EMIM]+和 [BF4]-在溶液中较少, III 型氢键链接几率降低, 因此, 在 PEO 体积分数较大条件下φ>0.6, III 型氢键减少到趋近于零. 下面分析 PEO 在 [EMIM][BF4] 中的第二维里系数, 第二维里系数反映了PEO与 [EMIM][BF4] 中各组分之间的相互作用. 由自由能方程 (1), 可以得到化学势(μ=∂F/∂φ)和渗透压(Π=μφ-F). 为了计算第二维里系数可以展开渗透压为: (10) 其中上式中的二次项为第二维里系数. (11) 取不同Fi(i=P,F,E)值, 即对于不同的 I 型、II 型和 III 型氢键分数,可以获得第二维里系数A2随温度变化的函数关系如图 3 所示. 图3 第二维里系数 A2 随温度变化的函数关系.Fig.3 Temperature dependence of the second virial coefficient A2. 从图 3 中可以看出, 第二维里系数A2随温度的增加而减少. 当FP和FF均较小的时候,A2减少量变得更加明显. 这导致 PEO 的溶解度随着温度的升高而降低.FP和FF越小,II 型和 III 型氢键结合对温度的依赖性越强(即随着温度的增加 II 型和 III 型氢键很快减少), 并且 III 型氢键结合有着更强的温度依赖性, 这是由于 PEO 和 [EMIM]+以及 PEO 和 [BF4]-之间氢键形成的再分配. 所以, 在低温时, I 型和 II 型氢键的形成会导致A2变大,这表明 PEO 的溶解度增大; 在温度升高时, I 型和 II 型氢键的破坏会导致A2降低, PEO 在 [EMIM][BF4] 中A2变小, PEO 在 [EMIM][BF4] 中的溶解度降低. III 型氢键的形成对A2的影响与 I 型和 II 型的氢键有相反的作用. 由以上分析可以得出, I 型和 II 型氢键减少, 同时 III 型氢键的增加, 导致了第二维里系数的减小, 从而降低了 PEO 在 [EMIM][BF4] 中的溶解度. 随着体系温度或 PEO 浓度的改变, 三种氢键会调整重组, 改变体系中的相互作用、 能量竞争和熵驱动, 诱导 PEO 在 [EMIM][BF4] 中出现奇异相变.应用化学势和渗透压平衡方程:μ(φ1)=μ(φ2) 和 Π(φ1)=Π(φ2) 可以获得 PEO 在 [EMIM][BF4] 中温度-体积分数相图, 进一步研究 PEO 在 [EMIM][BF4] 中的相行为变. 图4 PEO 在 [EMIM][BF4] 中不同分子量的PEO温度-体积分数相图.实验数据取自文献[26].Fig.4 Phase diagrams for PEO-2, PEO-5, PEO-10 and PEO-20 in EMIM][BF4]. Experimental data taken from Lee et al.[26]. 图 4 显示了 PEO在 [EMIM][BF4] 中不同分子量的 PEO 温度-体积分数相图. 从相图中可以获得PEO-2(Mw=2100)、PEO-5(Mw=4200)、PEO-10(Mw=10500) 和PEO-20(Mw=20500)的临界温度(TC)分别为 392.15 K、394.15 K、 403 K和430.15 K. 从图3可以看出,随着分子量从PEO-20(Mw=20500) 降到PEO-5(Mw=4200),TC轻微地上升. 在这个范围内,TC的变化较弱地依赖于分子量. 然而, 随着分子量从PEO-5(Mw=4200)降到PEO-2(Mw=2100),TC有较大的升高(ΔTC≈28K). 对于分子量较大的PEO, 有大量的供体/受体可用于形成 I 型和 II 型氢键. 在PEO/[EMIM][BF4]系统中, I 型和 II 型氢键的形成进一步增强了各种组分间的混合, 增加了额外的混合熵, 会导致体系自由能降低. 同时, I 型、 II 型和 III 型氢键的形成, 导致供体和受体分子的取向熵减少. 但是, 当温度升至高于 LCST, 自由能熵增加仍然占主导地位, 并且导致相分离. 因此, 这与PEO在水溶液中相行为类似[28-31], 体系混合熵驱动, 以及各组分之间的定向相互作用导致 PEO趋向溶解, 即典型的LCST相行为. 对于分子量较小的 PEO, 随着分子量的减小, III 型和 IV 型氢键比 I型和 II 型氢键更容易形成, 同时, PEO的OH端基比例增加, 这增加了体系中焓的贡献并提高PEO的总体溶解度, 这与PEO/水溶液的LCST相行为类似[30],并会使得相图变得更加不对称, 临界体积分数移位到较高体积分数, III型氢键和 IV 型氢键对混合熵的贡献决定了低分子量 PEO 的相行为. 根据 Li 等人[27]报道, 对长链 PEO, 端效应(IV型氢键效应)几乎不起作用, 可以忽略. 然而, 对于短的 PEO 链, 增加的 OH 端基数使得 IV 型氢键效应增强, 在一定程度上会影响 PEO 的相行为. 图4也显示出, 当 PEO 的体积分数大约从 0% 增加到 60% 时, PEO 在[EMIM][BF4]的相变温度降低. 在低的 PEO 体积分数条件下, III 型氢键在温度升高时容易趋于断裂, 继而 I 型和 II 型氢键则被破坏. 随着 PEO 体积分数的增加,更多的 PEO 链存在于 PEO/[EMIM][BF4] 溶液中, I 型、 II 型和III 型氢键形成可降低 PEO/[EMIM][BF4] 体系中的焓. 随着温度升高, I 型、 II型和 III 型氢键的断裂对混合熵的增加起着积极的作用. 当温度增加超过相变的温度时, 混合熵的贡献将成为相分离的主导因素. 随着 PEO 在 [EMIM][BF4] 中体积分数的增加, 混合熵增加, 使得相变温度降低. 从图4还可以看出, 当 PEO 的体积分数大于 60% 时, PEO 在 [EMIM][BF4] 的相变温度增大. 这是由于, 当 PEO 体积分数增加, 达到临界浓度时, PEO不能充分地均匀分散在 [EMIM][BF4] 中, I 型、 II 型氢键形成较多,III 型氢键形成减弱,并且将形成一些 PEO 浓度过高的区域. 这导致在相变过程中打破它需要一个相对更有序的混合结构和更高的能量, 因此相变温度升高. 理论计算结果符合实验观测[26,27]. 根据以上分析可以得出, 对于长链 PEO 在 [EMIM][BF4] 中, 当 PEO 浓度较低时, I 型、 II 型和 III 型氢键是 PEO 发生相变的主要驱动力; 在 PEO 聚合物浓度较高的条件下, I 型和 II 型氢键将会在 PEO 发生相变的过程中起到主导作用, III 型氢键效应可以忽略, 并且当 PEO 聚合物浓度较高时, I 和 II 型氢键形成将会是 PEO 在 [EMIM][BF4] 中发生相变的主要驱动力, 这一论断符合实验观测[26,27]. 实验研究[27]还发现, 在高浓度的 PEO 溶液中, PEO 在 [EMIM][BF4] 的相变出现滞后现象(相变的不可逆性). 由于温度降低, I 型、 II 型和 III 型氢键作用形成并加强, PEO/[EMIM][BF4] 体系中会形成三维氢键交联网络. 在升高温度过程中, 将会出现 I 型、 II 型和 III 型氢键链接的解离, 但是这种解离将不是完全的, 因此, 在高浓度的 PEO 溶液中, PEO 在 [EMIM][BF4] 的相变行为出现滞后性. Liu 和 Zhang[33]也报道了聚异丙基丙烯酰胺(PNIPAM)刷在加热/冷却过程中构象转变的滞后性. Cheng 等人[34]将滞现象的本质归因于氢键的形成. Mertens 等人[35]也发现单链 DNA(ssDNA)刷在增加水蒸气/减少水蒸气两个循环过程的构象转变的不可逆性, 这种构象转变的不可逆性可以通过 ssDNA-水氢键和水-水氢键解释[36]. 我们把 Flory-Huggins 模型推广应用到 PEO/[EMIM][BF4] 体系, 研究 PEO 在 [EMIM][BF4] 中相变过程中的氢键效应. 理论模型考虑了三种类型的氢键( I 型: PEO-[EMIM]+, II 型: PEO-[BF4]-和 III 型: [EMIM]+-[BF4]-氢键)的形成, 分析了三种类型的氢键分数随温度、 PEO 体积分数的变化. 结果表明, 三种类型的氢键的分数随着温度的升高而减少. 在较大 PEO 体积分数条件下, I 型、 II 型氢键形成几率降低, 随着 PEO 体积分数的增加, I 型、II 型氢键急剧减少, III 型氢键分数随着 PEO 体积分数增加出现急剧降低. 通过计算分析第二维里系数A2随温度变化发现, 当温度升高时, I 型和 II 型氢键的破坏会导致第二维里系数A2变小. III 型氢键的形成对A2的影响与 I 型和 II 型的氢键有相反的作用. 通过计算分析不同分子量的 PEO 在 [EMIM][BF4] 中的相图, 研究发现, 从 PEO-20 到 PEO-5,TC轻微地上升. 当从 PEO-5 到 PEO-2,TC有较大的升高.较大分子量的 PEO, 有较多的供体/受体可用于形成 I 型和 II 型氢键, I 型和 II 型氢键的形成进一步使得体系熵增加占主导地位, 导致相分离. 对于分子量较小的 PEO, III 型氢键比 I 型和 II 型氢键更容易形成, 增加体系中焓的贡献并提高 PEO 的总体溶解度. 在低的 PEO 体积分数条件下, III 型氢键较多, 并在温度升高时断裂, 继而 I 型和 II 氢键则被破坏. 随着 PEO 体积分数的增加, 更多的PEO聚合物链存在于PEO/[EMIM][BF4] 溶液中, I 型、 II 型和 III 型氢键形成降低了 PEO/[EMIM][BF4] 体系中的焓. 在高的PEO 体积分数条件下, 由于增加 PEO 体积分数, I 型、 II 型氢键形成增多, III 型氢键形成减少, 还会形成 PEO 浓度过高的区域. 导致在相变过程中打破它需要一个相对更有序的混合结构和更高的能量, 相变温度升高. 理论计算结果符合实验观测[26,27]. 分析理论结果可以得出, 对于长链 PEO 在 [EMIM][BF4] 溶液中, PEO 体积分数较低的条件下, I 型、 II 型和 III 型氢键是 PEO 发生相变的主要驱动力; 在 PEO 体积分数较高的条件下, I 和 II 型氢键将会在 PEO 发生相变的过程中起到主导作用, III 型氢键效应可以忽略. 根据理论结果还可以解释,在高浓度 PEO/[EMIM][BF4] 的溶液中, PEO 在 [EMIM][BF4] 的相变出现滞后现象(相变的不可逆性), 其本质也是由于 I 型、 II 型和 III 型氢键作用的结果.3 结果与讨论



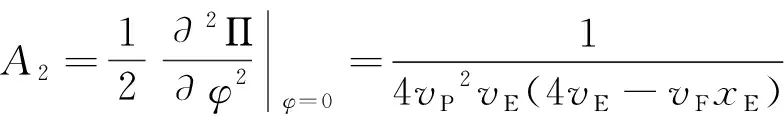
4 结 语
