伊立替康联合顺铂化疗对进展期胃癌复治患者的疗效评价
2017-03-07李莹刘芬
李莹 刘芬
中国是胃癌疾病高负担国家,据2015年中国癌症统计数据显示,因胃癌造成的人群死亡率在所有恶性肿瘤中列居第三位[1-2]。胃癌已经成为中国重大的公共卫生问题。在中国庞大的人口基数下,胃癌的发病率高达679.1/10万,死亡率高达498.0/10万。其中男性发病率和死亡率均超过女性[1,3]。胃癌患者的生存率与胃癌发展程度存在密切联系[4]。最新的中国早期胃癌筛查及内镜诊治共识意见也强调早期胃癌筛查的重要性及可行方法[5]。但由于早期胃癌的报警症状不明显、内镜筛查普及性不强,大多数胃癌患者确诊时已为中晚期。中国早期胃癌检出率<10%,而晚期胃癌患者的5年存活率 <20%[1,6]。胃癌晚期治疗的主要手段之一是药物化疗,但目前国内尚无统一的标准化治疗方案。目前,常用的化疗药物包括奥沙利铂、奈达铂、替吉奥、卡培他滨、多西他赛、伊立替康(irinotecan,CPT-11)、顺铂(cisplatin,DDP)等[7-9]。此外,联合用药已经成为主要的化疗药物选择方式。笔者对胶州市人民医院2012年6月至2014年6月收治的60例进展期胃癌复治患者,分别应用了CPT-11和CPT-11+DDP的二线化疗方案,评估其疗效和用药安全性,为一线化疗失败的进展期胃癌患者的复治化疗方案选择提供依据和参考。
资料与方法
一、一般资料
以胶州市人民医院2012年6月至2014年6月收治的60例进展期胃癌复治患者为研究对象,进行前瞻性随机对照研究,其中男性41例,女性19例;年龄18~65岁[(48.91±5.77)岁]。纳入标准:(1)年龄18~65岁。(2)经一线化疗方案治疗失败的进展期胃癌患者。(3)经组织病理学证实,一线化疗方案中不涉及CPT-11和DDP。(4)影像学检查证实存在至少1个可测量病灶部位。(5)卡氏评分>60分,预计生存期应>3个月。(6)患者肝、肾及心脏功能均正常。(7)没有化疗禁忌症。排除标准:(1)存在严重的心脏疾病或者肝、肾损害。(2)对CPT-11和DDP存在药物过敏的患者。(3)患者对化疗的耐受性极差。(4)存在合并其他恶性肿瘤的并发症患者。采用完全随机分组原则,将60例患者分为CPT-11组和CPT-11+DDP组,每组30例。本研究通过本院伦理委员会同意,所有患者均自愿参与并签属了知情同意书。
入组患者转移灶分布情况:腹腔淋巴结转移29例,肝转移21例,骨转移5例,卵巢转移2例,胰腺转移3例。两组患者在性别比例、年龄范围、肿瘤转移病灶分布方面差异均无统计学意义(P均 >0.05),具有可比性。见表1。
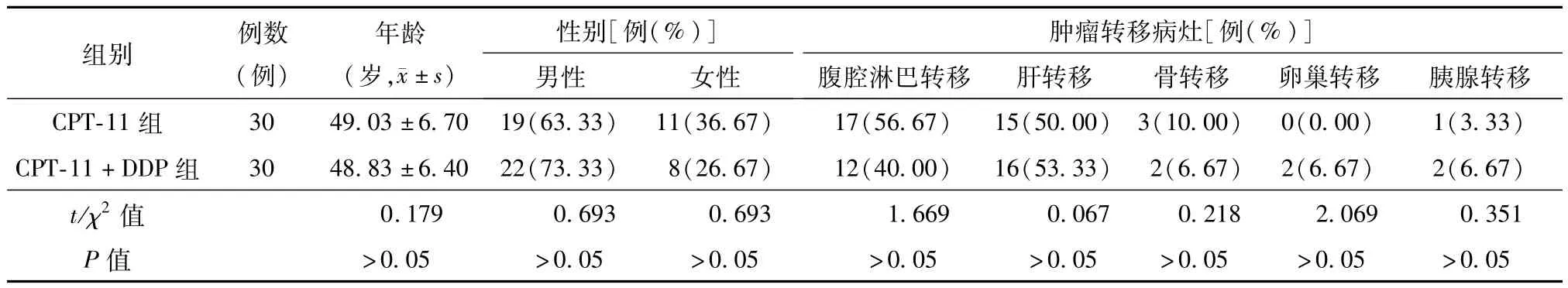
表1 两组进展期胃癌复治患者化疗前的基本情况比较
二、治疗方法
1.CPT-11组采取 CPT-11单药治疗:CPT-11 180 mg/m2+0.9%氯化钠注射液 250 mL,30~90 min内静脉滴注完毕,d1。
2.CPT-11+DDP组采取CPT-11+DDP联合方案治疗:CPT-11 180 mg/m2+0.9%氯化钠注射液250mL,于90min内静脉滴注;加用DDP 25mg/m2+0.9%氯化钠注射液500 mL,静脉滴注,d1。
所有患者在化疗前均行 5-羟色胺(5-hydroxytryptamine,5-HT3)受体拮抗剂、地塞米松和胃复安镇吐治疗。两组化疗方案均以3周为1个化疗周期。如在化疗过程中发生白细胞数目大量减少,必要时给予患者重组人粒细胞集落刺激因子治疗。如化疗过程中出现症状持续进展及严重不良反应,则终止当前化疗方案。
三、观察指标
对至少连续完成2个化疗周期的患者进行化疗效果和不良反应评价。
1.疗效评价:(1)血清肿瘤标志物水平。患者首次化疗前和最终化疗2周后,分别留取患者静脉血样检测糖类抗原199(carbohydrate antigen 199,CA 199)、血清癌胚抗原 (carcinoembryonic antigen,CEA)及糖类抗原 242(carbohydrate antigen 242,CA 242)水平。(2)短期有效率(response rate,RR)和疾病控制率(disease control rate,DCR)。依据实体瘤疗效评价标准(RECIST)[6]评估并记录两组患者化疗后不同转归的例数,包括完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、病变稳定(stable disease,SD)和疾病进展(progressive disease,PD)。分别计算两组患者的RR(公式1)和DCR(公式2)。
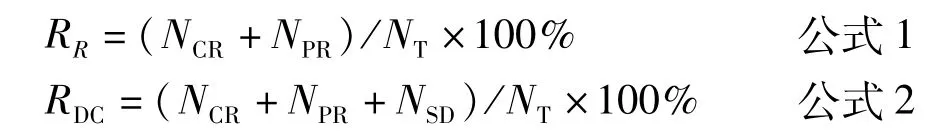
其中RR为短期有效率,RDC为疾病控制率,NCR为完全缓解例数,NPR为部分缓解例数,NSD为病变稳定例数,NT为总例数。(3)无进展生存期(progression free survival,PFS)和 总 生 存 时 间(overall survival,OS)。PFS为从患者化疗开始至任一部位出现肿瘤进展或死亡的时间;OS为从患者化疗开始至因任何原因引起死亡或最后一次随访的时间。分别记录两组患者的PFS和OS以评估两种化疗方案的远期有效率。
2.随访:对所有入组患者进行随访记录,随访分为近期随访和长期随访,最长随访时间为2年。(1)近期随访:在每个化疗周期进行血常规、肝功能、肾功能及心电图的检测,并记录患者毒副反应类型、发生和持续时间(毒副作用和不良反应依据美国NCI-NTC3.0的评价标准进行判定,分为0~4级[10])。每2个化疗周期进行胸腹CT扫描,依据实体瘤疗效评价标准(RECIST)[11]病灶进行评估。(2)长期随访:化疗终止后,每月进行电话随访,每6个月进行一次门诊随访,并对随访患者进行血清学肿瘤标准物CA 199,CEA,CA 242监测。
四、统计学分析
结 果
一、两组近期疗效评价
所有患者均完成了2个及2个以上周期的化疗治疗,平均化疗周期为(3.6±1.1)个周期。CR 5例(8.33%),PR 17例(28.33%),SD 21例(35.00%),PD 17例(28.33%);总 RR为 36.67%(22/60),总DCR为 71.67%(43/60)。CPT-11组与 CPT-11+DDP组相比,RR和DCR差异无统计学意义(P均>0.05)。见表2。
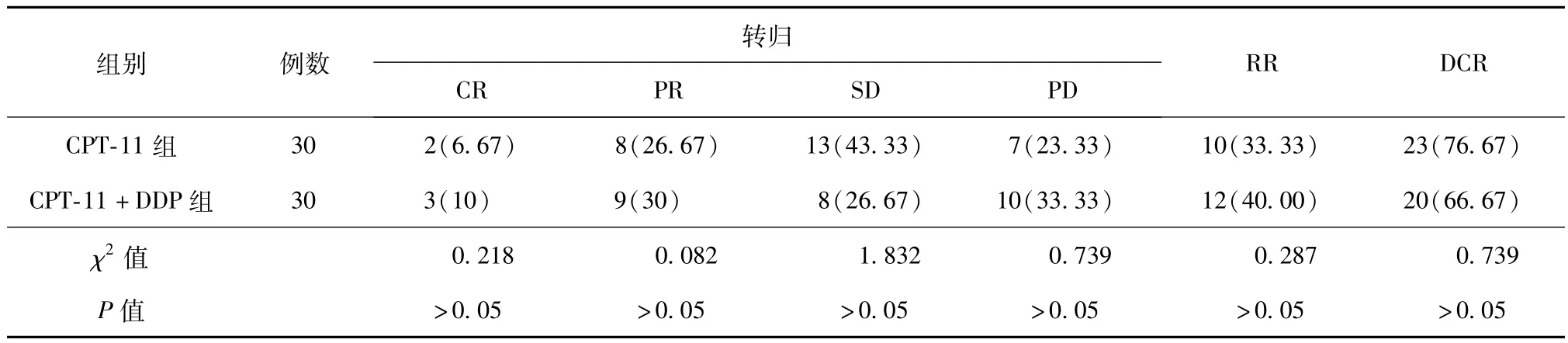
表2 两组进展期胃癌复治患者化疗后的近期疗效评价[例(%)]
二、两组化疗前后血清肿瘤标志物水平比较
与化疗前相比,两组患者化疗后CA199、CEA及CA242的表达水平均显著降低(CPT-11组化疗前后各指标水平比较的t值分别为1.731,2.176,1.225;CPT-11+DDP组化疗前后各指标水平比较的t值分别为1.894,1.138,1.295,P<均0.05)。与CPT-11组相比,CPT-11+DDP组患者的血清CA199、CEA及CA242水平明显降低(t值分别为1.285,1.229,2.573,P均 <0.05)。见图1。
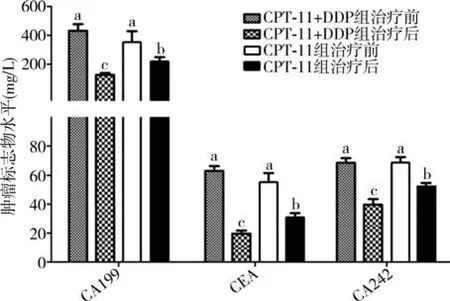
图1 两组进展期胃癌复治患者治疗前后血清肿瘤标准物水平的比较
三、两组远期疗效评价
所有入组患者在有效随访期内,未出现失访病例。CPT-11+DDP组患者PFS为(8.49±2.43)个月,长于 CPT-11组患者的 PFS[(6.21±1.96)个月],差异有统计学意义(t=2.256,P<0.05)。但CPT-11+DDP组和CPT-11组OS[(15.8±3.37)个月vs(14.1±3.11)个月]差异无统计学意义(P>0.05)。
四、不良反应分析
所有入组患者化疗过程及近期随访中均未出现危及生命的严重不良反应及因不良反应终止化疗的情况。患者出现的主要不良反应为白细胞减少、恶心、呕吐、腹泻、贫血、乏力、乙酰胆碱能综合征、肝功能损害、肾功能损害,其中严重毒性分级(3~4度)高发生率的不良反应主要集中在白细胞减少(18.33%)、贫血(8.33%)和恶心(5%)。见表3。相比 CPT-11组,CPT-11+DDP组患者恶心[76.67%(29/30)vs 70.00%(21/30),χ2=7.680,P<0.05]和乏力[70.00%(21/30)vs 26.67%(8/30),χ2=11.279,P<0.05]发生率较高,腹泻[16.67%(5/30)vs 46.67%(14/30),χ2=6.239,P<0.05]发生率较低,差异有统计学意义。
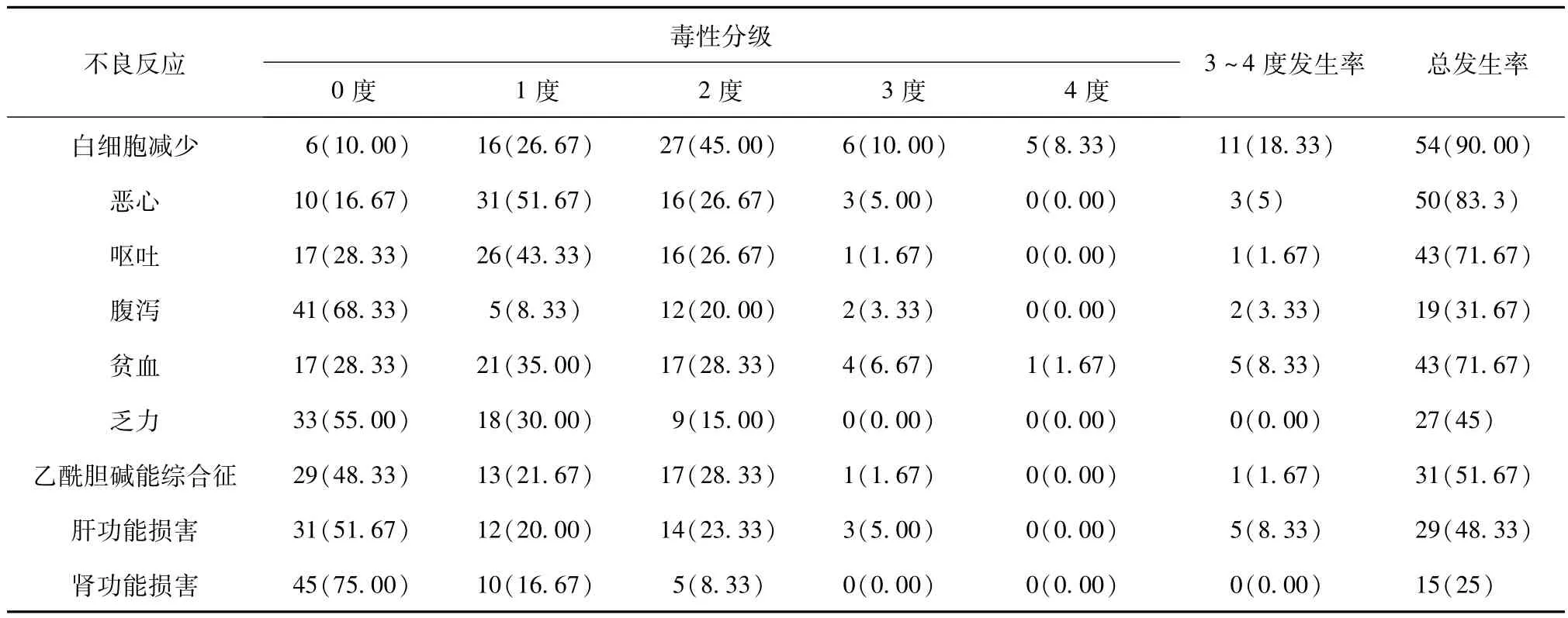
表3 60例进展期胃癌复治患者化疗后的不良反应发生状况[例(%)]
讨 论
在中国,胃癌的治疗方式集中于药物化疗。多数研究表明,单一药物的化疗疗效存在异质性和局限性,尤其是对中晚期胃癌患者而言,最佳的化疗方式将给患者带来更多的生存获益[12]。目前,两药联合化疗在胃癌一线化疗方案中的应用已经日益成熟,而两药联合的二线化疗方案相关研究较少,对方案有效性和安全性评估的研究更少。本研究,对60例初次化疗失败的胃癌进展期患者分别进行了基于CPT-11单药和CPT-11+DDP联合用药的化疗,获得结果和数据将对当前胃癌复治患者的临床治疗方案选择具有指导意义。
CPT-11作为一种半合成喜树碱的衍生物,其抗肿瘤效果已被逐渐认知。介于其特异性的DNA拓扑异构酶I抑制剂特性,能够阻断细胞DNA复制,干扰细胞转录,造成肿瘤细胞死亡[12]。自2011年以来,陆续有临床研究发现,CPT-11在治疗晚期胃癌的二线方案中显示出较高的生存率和较低的毒副作用[12-14]。在鼠肿瘤模型的体内实验中,CPT-11呈现出广谱抗肿瘤特性,对鼠肿瘤细胞系的细胞毒性也低于其他抗肿瘤药物[14]。另一项集合了578项晚期胃癌患者二线化疗的Meta分析结果显示,CPT-11减少了部分胃癌晚期患者的死亡风险[15]。此外,相比其他化疗药物,CPT-11具有较长的PFS和OS[15]。但近期许多研究比较了CPT-11单药与CPT-11联合用药的疗效,结果显示CPT-11单药和联合用药所带来的RR及DCR差异不具有统计学意义,但能够提高胃癌进展期患者的PFS[12]。本研究中,CPT-11联合 DDP获得的 RR[40.00%(12/30)]和 DCR[66.67%(20/30)]与 CPT-11单药[RR为 33.33% (10/30),DCR为 76.67% (23/30)]差异无统计学意义,与以往的研究结果一致。在OS方面,CPT-11单药和联合DDP用药差异也无统计学意义,但是联合用药明显延长了患者的PFS[(8.49±2.43)个月 vs(6.21±1.96)个月]。此外,相比应用CPT-11单药,联合用药明显降低了肿瘤标志物 CA 199[(220.18±59.93)mg/L vs(154.12±23.77)mg/L]、CEA[(31.24±6.15)mg/L vs(15.29±3.84)mg/L]及 CA242[(50.17±5.86)mg/L vs(36.46±6.44)mg/L]的表达。因此,CPT-11联合DDP的应用相比CPT-11单药化疗,能够给一线化疗失败的胃癌进展期患者带来更多的生存获益。
不良反应的发生是药物化疗安全性的主要体现之一。研究发现,基于CPT-11药物化疗的主要副作用为中性粒细胞减少、肝肾功能损害、贫血、便秘、血小板减少、恶心、乏力及腹泻等[10]。本研究中,CPT-11涉及的化疗,出现3~4级不良反应较多的症状/体征主要为白细胞减少,达到18.33%(11/60),其次为贫血[8.33%(5/60)]和恶心[5%(3/60)]。尽管CPT-11+DDP联合用药所引起腹泻有所减少,但是同样存在发生率较高的其他不良反应(如恶心和乏力,联合用药组的不良反应发生率高于CPT-11单药化疗组)。
综上所述,CPT-11联合DDP在胃癌进展期患者的二线化疗可明显提高CPT-11单药化疗患者的PFS并降低血清肿瘤标志物CA199、CEA、CA242水平,且延续了CPT-11低腹泻毒副作用的优势,但恶心、乏力的发生率增高。
1 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer JClin,2016,66(2):115-132.
2 Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].Int JCancer,2015,136(5):E359-386.
3 谭美英,甘润良.EBV相关胃癌临床及病理机制的研究进展[J].中南医学科学杂志,2013,41(2):191-195.
4 屠江锋,潘文胜,陈小君,等.胃癌早期筛查的研究进展[J].实用肿瘤杂志,2016,31(6):560-564.
5 廖专,孙涛,吴浩,等.中国早期胃癌筛查及内镜诊治共识意见(2014年4月,长沙)[J].中华消化杂志,2014,34(7):408-427.
6 罗琼,许洪伟,郝菁华,等.shRNA-FHIT对胃癌细胞株BGC-823增值和凋亡的影响[J].山东大学学报医学版,2010,48(5):44-48.
7 Feng ZL,Chen LB,Liu ZY,et al.DCF intraperitoneal and intravenous dual chemotherapy regimen for advanced gastric cancer:A feasibility study[J].Oncol Lett,2015,9(1):491-497.
8 Van Cutsem E,BoniC,Tabernero J,etal.Docetaxel plus oxaliplation with or without fluorouracil or capecitabine in metastatic or locally recurrent gastric cancer:a randomized phase II study[J].Ann Oncol,2015,26(1):149-156.
9 刘云军,何志江,黄毅超,等.多西他赛联合希罗达在晚期胃癌的疗效分析[J].中南医学科学杂志,2012,40(6):585-587.
10 陈一兴,曾昭冲,孙菁,等.基于螺旋断层放疗技术的立体定向放疗治疗肝细胞肝癌的疗效及安全性评价[J].肿瘤,2017,37(4):365-371.
11 陈欣,顾康生,李敏.替吉奥联合伊立替康治疗晚期胃癌的临床观察[J].中华全科医学,2017,15(9):1496-1498.
12 李建旺,黄春珍,元建华,等.伊立替康联合顺铂对比伊立替康单药二线治疗晚期胃癌的临床研究[J].临床肿瘤学杂志,2016,21(6):540-544.
13 Kanagavel D,Fedyanin M,Tryakin A,et al.Second-line treatment of metastatic gastric cancer:Current options and future directions[J].World JGastroenterol,2015,21(41):11621-11635.
14 Hultman B,Mahteme H,Sundbom M,et al.Benchmarking of gastric cancer sensitivity to anti-cancer drugs ex vivo as a basis for drug selection in systemic and intraperitoneal therapy[J].JExp Clin Cancer Res,2014,33(1):110.
15 Kim HS,Kim HJ,Kim SY,et al.Second-line chemotherapy versus supportive cancer treatment in advanced gastric cancer:a metaanalysis[J].Ann Oncol,2013,24(11):2850-2854.
