雷公藤红素对非小细胞肺癌细胞株H1975的增殖抑制及其相关机制研究
2017-03-02王莹陈浩杰曹帆帆彭彬张雪张登海
王莹 陈浩杰 曹帆帆 彭彬 张雪 张登海


[摘要] 目的 研究雷公藤红素对非小细胞肺癌细胞株H1975的增殖抑制作用及相关机制。 方法 以不同浓度雷公藤红素(0.1、0.25、0.5、1.0、2.0 μmol/L)分别作用于H1975细胞12 h或24 h,CCK-8法检测细胞增殖活性;小室侵袭法检测细胞的侵袭能力;Western blot法检测雷公藤红素对H1975细胞EGFR信号通路蛋白及其下游基因表达水平的调控作用;裸鼠成瘤体内验证雷公藤红素对H1975细胞增殖的抑制作用。 结果 雷公藤红素对H1975细胞增殖有较明显的抑制作用,且这种抑制作用呈浓度和时间依赖性;雷公藤红素能够显著抑制H1975细胞的侵袭能力;雷公藤红素对EGFR通路蛋白及其下游基因表达水平均有不同程度的抑制作用。 结论 雷公藤红素通过同时抑制EGFR及其下游信号通路蛋白的表达抑制H1975细胞的增殖与侵袭能力。
[关键词] 雷公藤红素;非小细胞肺癌;T790突变;EGFR通路
[中图分类号] R285.5;R734.2 [文献标识码] A [文章编号] 1673-9701(2016)32-0033-04
酪氨酸激酶抑制剂(EGFR-TKI)是治疗含有EGFR突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)的一个有效措施,但是几乎所有的患者最终均会产生耐药导致治疗失败,研究发现50%的EGFR-TKI耐药与T790位点的突变有关[1-3]。
雷公藤红素(celastrol)是从中药雷公藤中提取的生物活性成分,常用来治疗炎性和自身免疫性相关的疾病[4-6],近年来其在肿瘤方面的作用受到研究者的关注。本研究通过体内体外实验研究雷公藤紅素对含有T790突变的非小细胞肺癌细胞株H1975增殖能力的影响,并对其相关机制进行了探索,为临床NSCLC治疗提供有效治疗策略。
1 材料与方法
1.1 材料
H1975细胞株为本实验室保存;本实验所使用试剂:雷公藤红素(Sigma,美国);抗体(Cell Signaling Technology,美国);化学发光法检测试剂(ECL)(Santa Cruz Biotechnology);侵袭小室(Millipore);CCK-8试剂盒(日本同仁化学);5周龄BALB/c雄性裸鼠(上海斯莱克实验动物中心)。
1.2细胞培养
H1975细胞培养于含10%的胎牛血清和1%双抗(100 U/mL链霉素和100 U/mL青霉素)的RPMI 1640 完全培养基中,置于37℃、5% CO2细胞培养箱中培养。
1.3 Western blot
收集细胞,RIPA缓冲液裂解后离心取上清。Bradford法测定蛋白浓度,10%SDS-PAGE分离后将蛋白转至PVDF膜上,5%脱脂牛奶室温封闭1 h,抗体(1∶1000)室温保温1 h,辣根过氧化物酶标记的二抗(1∶10000)室温保温1 h,ECL化学发光,显影。
1.4 CCK-8分析实验
收集对数生长期细胞,接种于96孔细胞培养板(1×104/100 μL/孔)。24 h后加入不同浓度的雷公藤红素,以含等体积 DMSO的培养液作为空白对照,于培养箱中继续培养相应时间后,每孔加入CCK-8 10 μL,震荡混匀后于培养箱中静置30 min~2 h,于450 nm测定吸光度。细胞存活率=(对照组-实验组)/(对照组-空白组)×100%。
1.5小室侵袭实验
收集细胞,调整细胞浓度为5×105/mL,取 200 μL加入到小室内,于培养箱继续培养24 h后,擦去膜上层细胞,将膜取下。甲醛室温固定30 min,结晶紫染色后用刀片裁下膜,置于载玻片上,封片观察。
1.6荷瘤鼠模型的建立
收集对数生长的细胞,PBS 洗涤2~3次。用PBS 稀释为2×107/mL,接种至裸鼠背部皮下,每只小鼠接种0.15 mL。接种后5 d 选取1.5×1.5×1.5 mm3大小的肿瘤块的裸鼠进行随机分组。按照1 mg/(kg·d)给药,连续给药18 d,对照组注射和实验组同等体积和浓度的DMSO,隔天测量肿瘤的体积,肿瘤体积(mm3)=1/2×长×宽2。
1.7 统计学方法
采用SPSS 13.0 统计学软件对数据进行处理,计量资料以(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
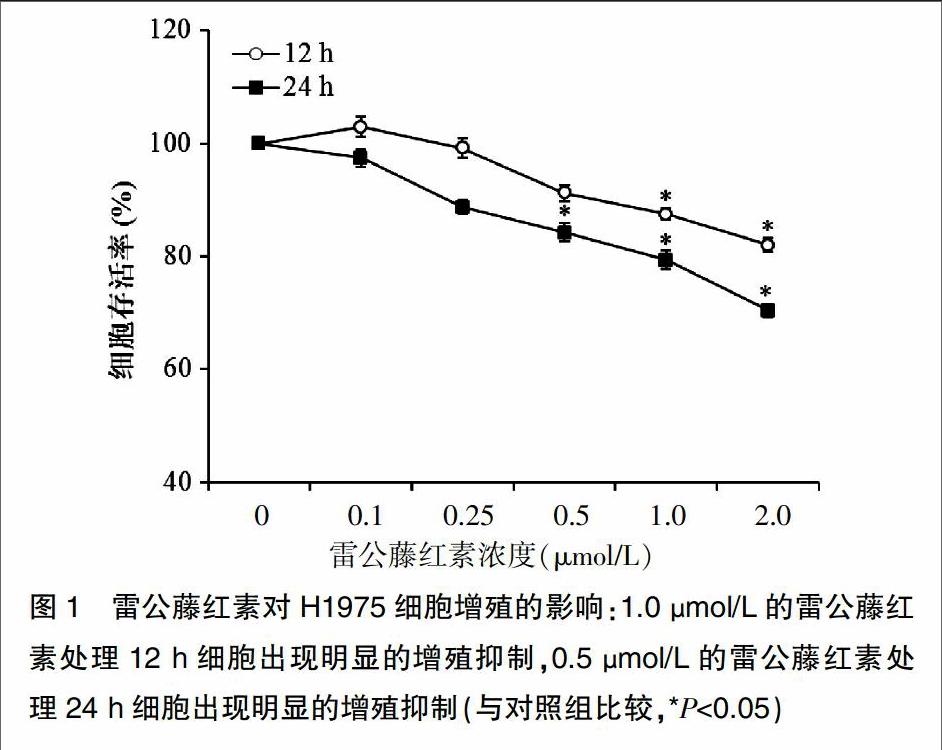
2.1雷公藤红素对H1975细胞增殖的影响
如图1所示,0.25 μmol/L的雷公藤红素处理24 h后,H1975细胞的增殖活性受到一定程度的抑制(84.22±3.05)%,雷公藤红素达到1.0 μmol/L时,其存活率受到的抑制明显增强(79.39±1.86)%,差异具有统计学意义(t=4.303,P=0.038)。随着雷公藤红素浓度的增加和作用时间的延长,这种增殖抑制作用明显增强,呈明显的时效和量效关系。1.0 μmol/L雷公藤红素处理12 h和24 h细胞存活率分别降至(87.48±1.92)%(t=5.085,P=0.024)和(79.39±1.86)%(t=4.597,P=0.032),2.0 μmol/L雷公藤红素处理12 h和24 h细胞存活率分别降至(82.01±2.15)%(t=4.252,P=0.039)和(70.36±1.54)%(t=5.085,P=0.024)(图1)。
2.2 雷公藤红素对H1975细胞侵袭能力的影响
小室侵袭实验结果显示(图2),与对照组比较,1.0 μmol/L的雷公藤红素处理后穿过基质膜的H1975细胞数量明显减少,由(487±47)降至(272±36),与DMSO对照组比较,差异有统计学意义(t=4.303,P=0.038);2.0 μmol/L的雷公藤红素处理后穿过基质膜的H1975细胞数量更是降至(98±14),与DMSO对照组比较,差异有统计学意义(t=11.649,P=0.00064),以上结果说明雷公藤红素对H1975细胞的侵袭能力有显著的抑制作用。
2.3雷公藤红素对EGFR及其下游信号通路的影响
为了进一步揭示雷公藤红素抑制H1975细胞增殖侵袭能力的可能机制,我们探讨了雷公藤红素对H1975细胞EGFR及其下游信号通路的影响。结果显示(图3),与对照组比较,1.0 μmol/L雷公藤红素处理 H1975细胞24 h后p-EGFR的表达量明显减少,下降(14.18±3.11)%,差异有统计学意义。其下游的p-STAT3、p-AKT、p-ERK各自受到不同程度的抑制,活性分别减少(31.61±4.51)%、(78.32±2.84)%和(42.75±3.72)%。结果说明,雷公藤红素可能是通过同时抑制EGFR及其下游信号通路的活性对H1975细胞的恶性增殖发挥遏制作用。
2.4 雷公藤红素对H1975细胞成瘤能力的影响
结果显示(图4),与注射DMSO的对照组相比,注射雷公藤红素的小鼠肿瘤生长速度从第5天开始明显降低,最后一次给药后DMSO组肿瘤体积(2189.156±217.925)mm3,实验组肿瘤体积为(1158.386±209.364)mm3,说明雷公藤红素能够显著降低肿瘤的生长速度,与DMSO组比较,差异有统计学意义(t=8.754,P=0.0031)。
3 讨论
肺癌是目前最常见的恶性肿瘤之一,其中NSCLC约占肺癌75%~80%。NSCLC对常规化疗药的敏感性较差,因此,到目前为止NSCLC的死亡率仍居高不下[7]。近年来以酪氨酸激酶抑制剂为代表的靶向治疗为临床治疗带来了希望,但是由于T790M突变引起的继发耐药成为NSCLC治疗的障碍,因此寻找能够有效克服T790M突变引起的EGFR-TKI耐受的药物仍是目前亟待解决的重要任务。
EGFR正常表达于哺乳动物的上皮细胞膜上,其异常表达将导致其下游信号通路的激活,促进细胞的增殖,抑制细胞凋亡。研究发现其在多种肿瘤中的表達发生上调,其中包括NSCLC。T790M突变引起的EGFR-TKI耐受使EGFR下游信号通路持续活化,从而促进NSCLC发展。EGFR的激活突变常见于NSCLC中,在美国每年有超过20 000的患者检测到EGFR发生激活突变。EGFR活化主要通过PI3K/AKT/mTOR信号通路[8]、MAPK/MEK/ERK信号通路[9]、Src信号通路[10]以及JAK/STAT3信号通路[11-14]。其中,PI3K/AKT/mTOR信号通路和MAPK/MEK/ERK信号通路是EGFR最重要的两条下游通路,EGFR的激活突变导致该信号通路的活化,通过磷酸化凋亡调节分子Bad、Bim、Bcl-2等调节细胞的凋亡。
生物活性小分子雷公藤红素具有显著的抗炎作用,近年来其在抗肿瘤方面的作用受到了研究者的关注[15],研究表明celastrol能够抑制包括NSCLC在内的多种肿瘤细胞的增殖,体内试验也证实其对多种肿瘤的发生、发展和转移具有显著的抑制作用[16-18],另外,celastrol能够增加肿瘤细胞对化疗药物[19]和放射治疗的敏感性[20]。
本研究及其他研究组的研究结果均表明celastrol对EGFR下游的多种信号蛋白具有抑制作用,其中包括PI3K/AKT、ERK/MEK。Celastrol是否对含T790突变NSCLC细胞的恶性增殖有抑制作用及该作用是否是通过对EGFR及其下游信号途径调控发挥作用目前尚不清楚。本实验结果提示,雷公藤红素能显著抑制含T790突变的H1975细胞的增殖侵袭能力,体内裸鼠成瘤实验也验证了这一观点。进一步的研究发现雷公藤红素虽然对H1975细胞中EGFR的活性抑制能力不是很强(14.18±3.11)%,却能够直接阻断EGFR下游JAK/STAT3、MAPK/ERK和PI3K/AKT信号通路的激活,尤其是对PI3K/AKT信号通路,抑制率达到(78.32±2.84)%。因此采用雷公藤红素进行治疗,有可能通过直接抑制EGFR的活性,同时抑制其下游的JAK/STAT3、MAPK/ERK和PI3K/AKT信号通路,共同发挥抑制H1975细胞恶性增殖的作用,达到治疗NSCLC的效果。
[参考文献]
[1] Hammerman PS,Janne PA,Johnson BE. Resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer[J]. Clinical Cancer Research:An Official Journal of the American Association for Cancer Research,2009,15(24):7502-7509.
[2] Kobayashi S,Boggon TJ,Dayaram T,et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J].The New England Journal of Medicine,2005,352(8):786-792.
[3] Pao W,Miller VA,Politi KA,et al. Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J]. PLoS Medicine,2005,2(3):e73.
[4] Salminen A,Lehtonen M,Paimela T,et al. Celastrol:Molecular targets of Thunder God Vine[J]. Biochemical and Biophysical Research Communications,2010,394(3):439-442.
[5] Kim DH,Shin EK,Kim YH,et al. Suppression of inflammatory responses by celastrol,a quinone methide triterpenoid isolated from Celastrus regelii[J]. European Journal of Clinical Investigation,2009,39(9):819-827.
[6] Jung HW,Chung YS,Kim YS,et al. Celastrol inhibits production of nitric oxide and proinflammatory cytokines through MAPK signal transduction and NF-kappaB in LPS-stimulated BV-2 microglial cells[J]. Experimental & Molecular Medicine,2007,39(6):715-721.
[7] Jain K,Padley SP,Goldstraw EJ,et al. Primary ciliary dyskinesia in the paediatric population: Range and severity of radiological findings in a cohort of patients receiving tertiary care[J]. Clinical Radiology,2007,62(10):986-993.
[8] Zou M,Xia S,Zhuang L,et al. Knockdown of the Bcl-2 gene increases sensitivity to EGFR tyrosine kinase inhibitors in the H1975 lung cancer cell line harboring T790M mutation[J]. International Journal of Oncology,2013, 42(6):2094-2102.
[9] Pratilas CA,Hanrahan AJ,Halilovic E,et al. Genetic predictors of MEK dependence in non-small cell lung cancer[J].Cancer Research,2008,68(22):9375-9383.
[10] Gao SP,Mark KG,Leslie K,et al. Mutations in the EGFR kinase domain mediate STAT3 activation via IL-6 production in human lung adenocarcinomas[J]. The Journal of Clinical Investigation,2007,117(12):3846-3856.
[11] Masaki T,Igarashi K,Tokuda M,et al. pp60c-src activation in lung adenocarcinoma[J]. European Journal of Cancer,2003,39(10):1447-1455.
[12] Song L,Morris M,Bagui T,et al. Dasatinib(BMS-354825) selectively induces apoptosis in lung cancer cells dependent on epidermal growth factor receptor signaling for survival[J]. Cancer Research,2006,66(11):5542-5548.
[13] Zhang J,Kalyankrishna S,Wislez M,et al. SRC-family kinases are activated in non-small cell lung cancer and promote the survival of epidermal growth factor receptor-dependent cell lines[J]. The American Journal of Pathology,2007,170(1):366-376.
[14] Chung BM,Dimri M,George M,et al. The role of cooperativity with Src in oncogenic transformation mediated by non-small cell lung cancer-associated EGF receptor mutants[J]. Oncogene,2009,28(16):1821-1832.
[15] Gullett NP,Ruhul Amin AR,Bayraktar S,et al. Cancer prevention with natural compounds[J]. Seminars in Oncology,2010,37(3):258-281.
[16] Petronelli A,Pannitteri G,Testa U. Triterpenoids as new promising anticancer drugs[J]. Anti-Cancer Drugs,2009, 20(10):880-892.
[17] Yang H,Chen D,Cui QC,et al. Celastrol,a triterpene extracted from the Chinese "Thunder of God Vine" is a potent proteasome inhibitor and suppresses human prostate cancer growth in nude mice[J]. Cancer Research,2006,66(9):4758-4765.
[18] Sethi G,Ahn KS,Pandey MK,et al. Celastrol,a novel triterpene,potentiates TNF-induced apoptosis and suppresses invasion of tumor cells by inhibiting NF-kappaB-regulated gene products and TAK1-mediated NF-kappaB activation[J]. Blood,2007,109(7):2727-2735.
[19] Chen M,Rose AE,Doudican N,et al. Celastrol synergistically enhances temozolomide cytotoxicity in melanoma cells[J]. Molecular Cancer Research:MCR,2009,7(12):1946-1953.
[20] Dai Y,DeSano JT,Meng Y,et al. Celastrol potentiates radiotherapy by impairment of DNA damage processing in human prostate cancer[J]. International Journal of Radiation Oncology,Biology,Physics,2009,74(4):1217-1225.
(收稿日期:2016-09-06)
