静脉抗氧化剂治疗对中度重症和重症急性胰腺炎患者预后影响的Meta分析
2017-02-20孙文武王金龙孙钦龙毛恩强
孙文武 王金龙 孙钦龙 毛恩强
·论著·
静脉抗氧化剂治疗对中度重症和重症急性胰腺炎患者预后影响的Meta分析
孙文武 王金龙 孙钦龙 毛恩强
目的 评价静脉抗氧化剂治疗中度重症急性胰腺炎 (MSAP) 和重症急性胰腺炎 (SAP) 的疗效。方法 采用计算机和手工方法检索PubMed、EMbase、Cochrane Database和CNKI数据库,检索时间截至2016年3月18日。收集静脉抗氧化物治疗MSAP和SAP的临床随机对照研究。纳入数据为胰腺炎相关病死率及住院天数。采用Cochrane系统评价法评价纳入文献的质量。结果 最终纳入15项研究,共620名患者,其中5篇文献提供了详细的随机分配方案,1篇文献随机分配方案存在高度偏倚。在结局指标的评估是否采用盲法、结果数据报告是否完整、研究结果报告是否存在选择性方面,3篇文献存在不详及高度偏倚。未发现其他偏倚。分析结果显示,与对照组比较,静脉抗氧化剂治疗MSAP和SAP不影响患者的病死率(12.1%比9.7%,RD=-0.02, 95%CI-0.08~-0.03,P=0.44;RR=0.83, 95%CI0.51~1.34,P=0.44),但可显著缩短患者的住院天数(MD=-2.02,95%CI-4.00~-0.05,P=0.04)。结论 静脉抗氧化剂治疗可以显著缩短MSAP和SAP患者的住院天数。
胰腺炎,急性坏死性; 抗氧化剂; 输注,静脉内; 预后; Meta分析
急性胰腺炎(AP)是一种炎症递质介导的炎性紊乱疾病,它起始于局部炎症导致的腺泡细胞损伤,进而引发全身炎症反应综合征(SIRS)甚至导致多脏器功能衰竭(MODS)[1]。在这个过程中,炎症递质刺激产生氧化应激反应,生成活性氧自由基(reactive oxide species, ROS)。如果生成的ROS超过了组织器官的抗氧化能力,就会不可避免地损伤脂质、蛋白质以及DNA[2]。多个研究表明,体内抗氧化物质缺乏在AP的发生和发展中起重要作用[3-4]。因此有人提出额外补充抗氧化剂是否可以改善AP患者预后的假说。有实验研究证明[5-6],补充抗氧化剂维生素C可以减轻AP的胰腺损伤,褪黑素治疗可以促进大鼠胰腺组织的再生。然而在临床研究中并没有观察到抗氧化剂治疗AP的疗效[7-8]。由于这些研究的样本量较小,抗氧化剂给予的路径不同,本研究对相关文献进行Meta分析,以客观评估静脉应用抗氧化剂治疗中度重症急性胰腺炎(MSAP)和重症急性胰腺炎(SAP)的效果。
资料与方法
一、检索策略与选择标准
遵循文献[9]的推荐标准,以“抗氧化剂”“胰腺炎”为主题词检索中国期刊全文数据库(CNKI);以“antioxidant”、“pancreatitis”、“pancreatic inflammation”为主题词检索Cochrane Database、PubMed以及EMbase。同时手工检索相关期刊、会议论文集及尽可能多的参考文献。截至日期为2016年3月18日。所有纳入研究均为随机对照研究,所有患者的MSAP及SAP的诊断皆符合2012亚特兰大胰腺炎诊断指南[10]的标准。排除标准:(1)非人类研究;(2)患者年龄<18周岁;(3)慢性胰腺炎患者;(4)非随机对照研究;(5)抗氧化剂非经静脉途径给药。
二、资料提取
通过EndNote X5文献管理软件去重复文献后,由2名研究者按照纳入和排除标准浏览题目和摘要,对可能符合标准的文献获取全文,并通过阅读全文进一步筛选。按照预先设计的资料提取表格对纳入文献进行数据提取。2名研究者交叉核对,若出现分歧经第三方讨论解决。提取的资料包括:(1)文献第一作者及发表时间;(2)抗氧化剂类型;(3)给药天数;(4)患者平均年龄与性别;(5)胰腺炎严重程度;(6)治疗组及对照组例数; (7)胰腺炎相关病死率与住院天数;(8)死亡原因。
三、质量评估
采用The Cochrane Collaboration′s tool for assessing risk of bias中的评价标准[11]对所纳入文献的方法学质量进行评价,共分为以下6个方面:(1)随机分配方法是否正确;(2)是否有分配隐藏方案;(3)研究对象是否采用盲法;(4)结局指标的评估是否采用盲法;(5)结果数据是否完整;(6)研究结果是否存在选择性;(7)其他偏倚来源。由2名研究者按照以上条目对每篇文献进行评价,分为“是”(低度偏倚)、“否”(高度偏倚)或“不详”(缺乏相关信息或偏倚情况不确定)3个等级,若出现分歧经由第三方协商解决。
四、统计学处理
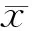
结 果
一、检索结果
检索到中文及英文文献4 531篇,其中Cochrane Datebase 51篇,EMbase 1 181篇,PubMed 1 710篇以及CNKI 1 589篇。通过去重复文献、摘要筛选,初步纳入29篇文献。仔细阅读全文,排除3篇包含慢性胰腺炎,3篇非静脉输入抗氧化剂,4篇未设置合适对照组,3篇未提供病死率和住院天数以及1篇未能获取全文的文献,最终纳入15篇文献[16-30],其中6篇中文文献、9篇英文文献,共620名患者。对这15篇文献进行参考文献追踪均未发现可用文献。2012年之前发表文献所诊断的SAP,均分别符合2012亚特兰大胰腺炎分类指南中的MSAP、SAP诊断标准[31]。
二、纳入研究一般特征
纳入的15篇文献中,1篇为横断面研究[32],1篇为三臂RCT研究[33]。根据Cochrane handbook[12],横断面研究中第1阶段的数据被纳入分析,三臂RCT研究中与本次Meta分析相关的两组数据被纳入。在蔡笃雄等[25]和Sharer等[30]的研究中,只有SAP组的数据被纳入。各研究在年龄和性别方面无明显差异,纳入的大部分患者为SAP(表1)。
三、质量评估
15篇文献中仅5篇文献提供了详细的随机分配方案[17,19,22-23,29]。1篇文献采用APACHEⅡ评分将AP分类,所以随机分配方案及分配隐藏方案评估为高度偏倚。在结局指标评估是否采用盲法、结果数据是否完整、研究结果是否存在选择性方面,3篇文献存在不详以及高度偏倚。未发现其他偏倚。
四、统计分析结果
1.病死率:抗氧化剂治疗组、对照组患者病死率分别为9.7%、12.1%,抗氧化剂治疗组较对照组低,但差异无统计学意义[RD(95%CI)为-0.02(-0.08,-0.03),P=0.44] ;RR(95%CI)为0.83(0.51,1.34),P=0.44]。各研究间不存在异质性(RD值的χ2=17.13,df=11,P=0.1,I2=36%;RR值的χ2=12.26,df=10,P=0.27,I2=18%,图1、2)。
2.住院天数:12篇文献提供患者的住院天数,共489例。抗氧化剂治疗组患者住院天数较对照组显著缩短,差异有统计学意义[MD(95%CI)为-2.02(-4.00,-0.05),P=0.04]。但文献间存在高度异质性(χ2=58.6,df=11,P< 0.0001,I2=81%),故采用随机效应模型(图3)。
3.发表偏倚:病死率和住院天数均无明显发表偏倚(图4、图5)。

表1 纳入文献的基本情况
注:LOS:住院时长

图1 静脉应用抗氧化剂对MSAP和SAP病死率影响的Meta分析森林图
图2 静脉应用抗氧化剂对病死率效果的分析(RR)

图3 静脉应用抗氧化剂对MSAP和SAP患者住院天数影响的Meta分析森林图
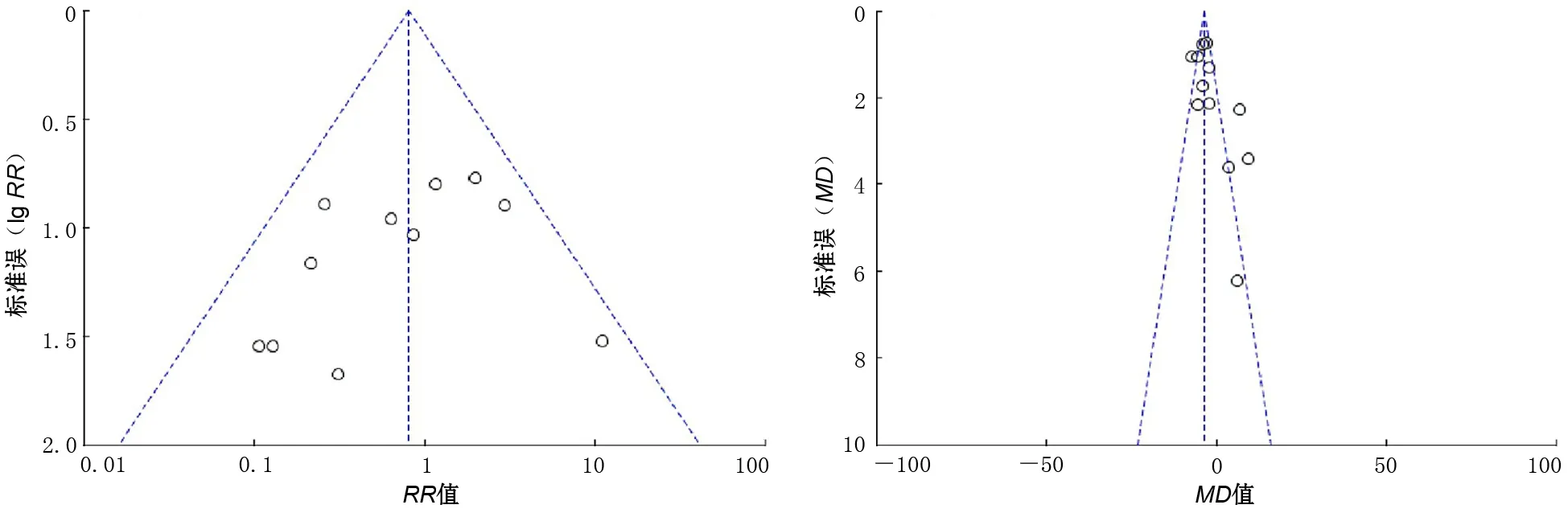
图4 病死率发表偏倚漏斗图 图5 住院天数发表偏倚漏斗图
讨 论
Wisner等[32]在雨蛙素诱导AP模型中发现,过氧化物与自由基在AP发病中起重要作用。大量的NO可与周围的超氧根(O2-)迅速反应,生成过氧亚硝基阴离子(ONOO-)。ONOO-可氧化蛋白质巯基,硝基化蛋白质的酪氨酸残基,使得许多重要的蛋白质或酶失活,影响细胞代谢、呼吸链酶、线粒体结构,并使DNA链断裂,启动脂质过氧化,导致组织和细胞损伤[33]。而脂质过氧化可破坏细胞膜稳定性,使得胰腺细胞破坏,激活多种胰酶,进一步造成胰腺组织损伤。
目前在临床中常用的抗氧化剂有维生素C、维生素E、褪黑激素、N-乙酰半胱氨酸(NAC)、谷氨酰胺、谷胱甘肽以及微量元素硒。不同的抗氧化剂参与体内清除ROS的不同环节,并且这些抗氧化剂之间也互为前体,或者互为对方的辅助因子[34]。如维生素C与维生素E可以直接与自由基相结合,稳定细胞膜,清除自由基;褪黑激素通过抑制炎症递质的释放,减少下游自由基产物的生成;NAC可以作为谷胱甘肽的前体,促进谷胱甘肽的生成;硒则可以作为谷胱甘肽过氧化物酶的辅助因子,间接清除自由基等。由于自身的药理作用,以及胰腺炎病程中存在的肠道黏膜受损,大部分的抗氧化剂要想达到合适的清除自由基的效果,只能通过静脉输入的途径[35-36]。通过静脉途径,体内抗氧化剂的浓度可以达到经口途径的几倍以致几十倍。但静脉输入抗氧化剂带来的另一项弊端是体内抗氧化剂的浓度过大,会对机体本身存在的氧化-抗氧化的平衡带来不可预知的作用效果,所以目前并没有确切的研究数据能够表明静脉输入抗氧化剂是否会对AP患者的预后产生影响。Jeurnink等[37]的Meta分析结果显示,静脉应用抗氧化剂治疗并不能降低AP患者的病死率和减少住院天数。然而,该研究对象包含轻症急性胰腺炎(MAP)患者,这会对结果造成影响。MAP只会导致局部的胰腺水肿及渗出,并不会释放大量的ROS造成SIRS。此外,该Meta分析中只有8篇文献,共334例MSAP和SAP患者的抗氧化剂是从静脉途径输入,与本研究的620名患者相差较大。
[1] Sah RP, Garg P, Saluja AK, et al. Pathogenic mechanisms of acute pancreatitis[J]. Curr Opin Gastroenterol, 2012,28(5):507-515.DOI: 10.1097/MOG.0b013e3283567f52.
[2] van Stijn MF, Ligthart-Melis GC, Boelens PG, et al. Antioxidant enriched enteral nutrition and oxidative stress after major gastrointestinal tract surgery[J]. World J Gastroenterol, 2008,14(45):6960-6969.
[3] Esrefoglu M, Gul M, Ates B, et al. Ultrastructural clues for the protective effect of ascorbic acid and N-acetylcysteine against oxidative damage on caerulein-induced pancreatitis[J]. Pancreatology, 2006,6(5):477-485.
[4] Bonham MJ, Abu-Zidan FM, Simovic MO, et al. Early ascorbic acid depletion is related to the severity of acute pancreatitis[J]. Br J Surg, 1999,86(10):1296-1301.
[5] Sidhu S, Pandhi P, Malhotra S, et al. Melatonin treatment is beneficial in pancreatic repair process after experimental acute pancreatitis[J]. Eur J Pharmacol, 2010,628(1-3):282-289.DOI: 10.1016/j.ejphar.2009.11.058.
[6] Esrefoglu M. Experimental and clinical evidence of antioxidant therapy in acute pancreatitis[J]. World journal of gastroenterology: WJG, 2012,18:5533-5541.
[7] Sateesh J, Bhardwaj P, Singh N, et al. Effect of antioxidant therapy on hospital stay and complications in patients with early acute pancreatitis: a randomised controlled trial[J]. Trop Gastroenterol, 2009,30(4):201-206.
[8] Xue P, Deng LH, Xia Q, et al. Impact of alanyl-glutamine dipeptide on severe acute pancreatitis in early stage[J]. World J Gastroenterol, 2008,14(3):474-478.
[9] Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement[J]. Int J Surg, 2010,8(5):336-341.DOI: 10.1371/journal.pmed.1000097.
[10] Banks PA, Bollen Tl, Dervenis C, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013,62(1):102-111.DOI: 10.1136/gutjnl-2012-302779.
[11] Higgins JPT AD, Steme JAC. Assessing risk of bias in included studies.∥Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0(updated March 2011)[M]. Higgins JPT, Green S(Eds). The Cochrane Collaboration 2013.
[12] The Cochrane Collaboration: Cochrane Handbook for Systematic Reviews of Interventions 2005 [http://www.cochrane.org/resources/handbook/]. Oxford: The Cochrane Collaboration.
[13] Friedrich JO,Adhikari NK,Beyene J.Inclusion of zero total event trials in meta-analyses maintains analytic consistency and incorporates all available data[J].BMC Med Res Methodol,2007,7:5.
[14] Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample[J]. BMC Med Res Methodol, 2005,5:13.
[15] Higgins JP,Thompson SG,Deeks JJ,et al.Measuring incon-sistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[16] 李春燕,廖东平,李仕强,等.丙氨酰- 谷氨酰胺对重症急性胰腺炎患者IL-6、TNF-α、D-二聚体的影响及临床意义[J].胃肠病学和肝病学杂志,2015,24(3):351-353.DOI: 10.3969/j.issn.1006-5709.2015.03.035.
[17] 丁金囡.还原型谷胱甘肽联合生长抑素在重症急性胰腺炎治疗中的临床研究[J].实用药物与临床,2014,17(10):1353-1357.
[18] 陈科全,邹原方. 丙氨酰谷氨酰胺治疗重症急性胰腺炎肠道衰竭效果研究[J].社区医学杂志,2013,11(11):4-5.
[19] Hajdu N, Belagyi T, Issekutz A, et al. Intravenous glutamine and early nasojejunal nutrition in severe acute pancreatitis-a prospective randomized clinical study[J]. Magy Seb, 2012,65(2):44-51.DOI: 10.1556/MaSeb.65.2012.2.2.
[20] 姜山.抗氧化剂治疗重症急性胰腺炎的临床研究[J]. 实用心脑肺血管病杂志,2011,19(2):217-219.DOI: 10.3964/j.issn.1008-5917.2011.02.031.
[21] 韩梅,刘彤,刘刚,等. 免疫营养剂对重症胰腺炎患者疗效观察[J].天津医科大学学报,2011,17(2):227-229. DOI: 10.3969/j.issn.1006-8147.2011.02.026
[22] Fuentes-Orozco C, Cervantes-Guevara G, Mucino-Hernandez I,et al. L-alanyl-L-glutamine-supplemented parenteral nutrition decreases infectious morbidity rate in patients with severe acute pancreatitis[J]. JPEN J Parenter Enteral Nutr, 2008,32(4):403-411.DOI: 10.1177/0148607108319797.
[23] Siriwardena AK, Mason JM, Balachandra S, et al. Randomised, double blind, placebo controlled trial of intravenous antioxidant (n-acetylcysteine, selenium, vitamin C) therapy in severe acute pancreatitis[J]. Gut, 2007,56(10):1439-1444.
[24] Sahin H, Mercanligil SM, Inanc N, et al. Effects of glutamine-enriched total parenteral nutrition on acute pancreatitis[J]. Eur J Clin Nutr, 2007,61(12):1429-1434.
[25] 蔡笃雄,陈卫昌,温晓持,等.急性胰腺炎患者血清抗坏血酸水平及维生素C辅助治疗的临床研究[J].苏州大学学报(医学版),2006,26(1):78-80.DOI:10.3969/j.issn.1673-0399.2006.01.025.
[26] Xian-li H, Qing-jiu M, Jian-guo L, et al. Effect of total parenteral nutrition (TPN) with and without glutamine dipeptide supplementation on outcome in severe acute pancreatitis (SAP)[J]. Clin Nut Suppl, 2004,1(1):43-47.
[27] Lindner D, Lindner J, Baumann G, et al. Investigation of antioxidant therapy with sodium selenite in acute pancreatitis. A prospective randomized blind trial[J]. Med Klin (Munich), 2004,99(12):708-712.
[28] Ockenga J, Borchert K, Rifai K, et al. Effect of glutamine-enriched total parenteral nutrition in patients with acute pancreatitis[J]. Clin Nutr, 2002,21(5):409-416.
[29] de Beaux AC, O′Riordain MG, Ross JA, et al. Glutamine-supplemented total parenteral nutrition reduces blood mononuclear cell interleukin-8 release in severe acute pancreatitis[J]. Nutrition, 1998,14(3):261-265.
[30] Sharer NM, Scott PD, Deardon DJ, et al. Clinical trial of 24 hours′ treatment with glutathione precursors in acute pancreatitis[J]. Clin Drug Investi, 1995,10(3):147-157.DOI: 10.2165/00044011-199510030-00003.
[31] Huang J,Qu HP,Zheng YF,et al. The revised Atlanta criteria 2012 altered the classification, severity assessment and management of acute pancreatitis[J].Hepatobiliary Pancreat Dis Int, 2016,15(3):310-315.
[32] Wisner J,Green D,Ferrell L,et al. Eveidence for a role of oxygen derived free radicals in the pathogenasis of caerulein induced acute pancreatitis in rats[J].Gut, 1988,29(11):1516-1523.
[33] Zong WX, Thompson CB. Necrotic death as a cell fate[J]. Genes Dev, 2006,20(1):1-15.
[34] Berger MM, Oudemans-van Straaten HM. Vitamin C supplementation in the critically ill patient[J]. Curr Opin Clin Nutr Metab Care, 2015,18(2):193-201.DOI: 10.1097/MCO.0000000000000148.
[35] Buur JL,Diniz PP,Roderick KV,et al.Pharmacokinetics of N-acetylcysteine after oral and intravenous administration to healthy cats[J].Am J Vet Res,2013,74(2):290-293.DOI:10.2460/ajvr.74.2.290.
[36] Padayatty SJ, Sun H, Wang Y,et al. Vitamin C pharmacokinetics: implications for oral and intravenous use[J]. Ann Intern Med, 2004,140(7):533-537.
[37] Jeurnink SM,Nijs MM,Prins HA,et al.Antioxidants as a treatment for acute pancreatitis:A meta-analysis[J].Pancreatology,2015,15(3):203-208.DOI:10.1016/j.pan.2015.03.009.
(本文编辑:冀凯宏)
Meta analysis on intravenous antioxidants therapy in the treatment of moderately severe and severe acute pancreatitis
SunWenwu,WangJinlong,Sunqinlong,MaoEnqiang.
DepartmentofEmergencyIntensiveCareUnit,RuijinHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200025,China
MaoEnqiang,Email:maoeq@yeah.net
Objective To investigate the efficacy of intravenous antioxidants therapy in treating moderately severe acute pancreatitis (MSAP) and severe acute pancreatitis (SAP). Methods Pubmed, Embase, Cochrane library and CNKI databases for all randomized control trials published before March 18st, 2016 manually was searched by computer. Data on AP associated mortality and length of stay (LOS) were collected. The quality of the trials included was assessed by the Cochrane systematic review method. Results Fifteen trials with data of 620 patients were eligible for final inclusion. Among the 15 trials, detailed randomization for grouping was clearly described in 5 studies and obvious bias was observed in 1 study. Three studies had obvious biases considering whether outcome assessment was blinded, outcome data was incomplete and outcome report was selective. No other apparent bias was found. Statistical analysis showed that compared with control group, intravenous antioxidants administration did not significantly reduce mortality (12.1vs9.7,RD=-0.02, 95%CI-0.08~-0.03,P=0.44;RR=0.83. 95%CI0.51~1.34,P=0.44), but could shorten LOS (MD=-2.02; 95%CI-4.00~-0.05;P=0.04). Conclusions Intravenous antioxidants could greatly shorten LOS of patients with MSAP and SAP.
Pancreatitis, acute necrotizing; Antioxidants; Infusions, intravenous; Prognosis; Meta-analysis
10.3760/cma.j.issn.1674-1935.2017.01.007
200025 上海,上海交通大学医学院附属瑞金医院急诊重症监护
毛恩强,Email:maoeq@yeah.net
2016-07-01)
