T7噬菌体p10融合蛋白表达及自组装VLP观察
2017-02-17王义伟侯继波
徐 悦,徐 海,鲍 熹,王义伟,卢 宇,侯继波
(1.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
T7噬菌体p10融合蛋白表达及自组装VLP观察
徐 悦1,2,徐 海1,2,鲍 熹1,2,王义伟1,2,卢 宇1,2,侯继波1,2
(1.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
原核表达T7噬菌体p10融合蛋白, PCR扩增p10基因并在基因下游连接口蹄疫病毒(FMDV)VP1抗原表位基因;将融合基因插入pET-28a载体,构建重组质粒;用IPTG诱导重组菌表达目标蛋白,通过电镜观察病毒样颗粒(VLP)的形成。结果成功构建了pET-p10-VP1表达菌株。SDS-PAGE、Western-blot检测显示目标蛋白高效表达并与VP1特异性抗体产生免疫反应。回收p10-VP1蛋白样品经透射电镜观察,有40 nm VLP生成。表明T7噬菌体p10蛋白具有良好的VLP自组装功能,并可用于抗原表位的表面展示。
T7噬菌体;口蹄疫;表达; VLP
口蹄疫是由口蹄疫病毒(Foot and mouth disease virus, FMDV)引起的偶蹄兽急性高度接触性传染病,对动物及人类健康都构成了严重的威胁,给发病国家和地区带来了重大的经济损失[1]。FMDV为单股正链RNA病毒,共分为7个血清型,在我国境内暴发的疫情以O、A型为主[2]。FMDV包含4个结构蛋白,其中VP1是主要保护性抗原[3]。口蹄疫合成肽疫苗利用VP1[120~160]位抗原表位能够激发抗感染免疫,成为一种更安全高效的新型疫苗[4]。但由于该抗原表位是一段40个氨基酸的抗原决定簇,自身免疫原性弱,需要偶联大分子的半抗原载体来增加免疫原性[5-6],例如血蓝蛋白、牛血清白蛋白、IgG重链等。如果能将抗原表位与载体蛋白融合表达并形成病毒样颗粒(virus-like particles, VLP)的结构,则展示在颗粒表面的抗原表位就能很好地被免疫细胞识别与递呈,从而提高免疫效力[7]。
T7噬菌体是一种侵染大肠杆菌的烈性噬菌体,其基因组为线性双链DNA,全长39 kb[8]。T7噬菌体头部由gp8、9、10、14、15、16六种蛋白装配而成,其中支架蛋白(gp9)、主要衣壳蛋白(gp10)在装配中起主要作用。当T7噬菌体完成基因复制与蛋白翻译后,gp9、gp10首先装配成一个无DNA、无尾的前衣壳,其形态比成熟噬菌体粒子显得圆且小[9]。据Cerritelli等报道,单独表达gp9、gp10蛋白并按比例混合反应可以组装出噬菌体前衣壳[10]。衣壳蛋白gp10由主要头部蛋白p10A和次要头部蛋白p10B组成,gp10正常翻译生成344个氨基酸的p10A,但在341位氨基酸处阅读框漂移通读后生成397个氨基酸的p10B,在野生型T7噬菌体中p10B约占总衣壳蛋白的10%。改造去除漂移位点,并在其后融合表达外源多肽,可使其展示在衣壳蛋白的表面。噬菌体衣壳蛋白自组装成颗粒样结构的能力在VLP研究中得到了广泛应用。
本研究尝试表达gp10与口蹄疫VP1[120~160]融合蛋白,通过电镜观察该蛋白自我组装成VLP的能力。
1 材料与方法
1.1 试验材料
质粒和菌株: pMD19-T克隆载体购于TAKARA公司;原核表达载体pET-28a(+)由本实验室保存;宿主菌DH5α、BL21(DE3)购于诺唯赞公司。
主要试剂:限制性核酸内切酶、Taq酶购自TaKaRa公司; T7 Tag-HRP抗体购自默克公司; DNA琼脂糖凝胶回收试剂盒和质粒小量制备试剂盒皆购于上海捷瑞生物工程有限公司;其他所需试剂均为分析纯;色谱柱填料Sephadex G-50购自Amersham Bioseienee公司。
主要仪器: TDZ5-WS水平离心机; AIRTECH超净工作台;隔水式电热恒温培养箱为上海跃进医疗器械厂产品; PCR仪购自TAKARA公司;超声破碎仪购自宁波新芝生物科技有限公司。
1.2 pET-p10-VP1质粒的构建验证
通过SOE-PCR方法将T7噬菌体p10基因和FMDV VP1(120~160)基因片段连接起来,扩增产物经胶回收试剂盒进行回收纯化,并与pMD19-T连接,转化至感受态细胞DH5α中,抽提质粒,进行双酶切验证并测序。将p10-VP1基因片段插入至pET-28a的NcoⅠ和EcoRⅠ位点之间,转化大肠杆菌BL21(DE3)感受态细胞,构建重组表达质粒pET-p10-VP1。
1.3 p10-VP1蛋白的诱导表达
诱导表达过程参照pET系统操作手册,将含有pET-p10-VP1质粒的重组菌接种至含有卡那霉素的LB培养基中,37 ℃培养至OD600≈0.8;加入IPTG至终浓度为1 mmol/mL,在25 ℃下诱导培养4 h;诱导结束后收集菌体,用PBS洗涤2遍,按1/2比例浓缩体积。超声破碎菌体,离心收集沉淀和上清,使用PBS重悬沉淀至破碎前原体积,取样进行SDS-PAGE电泳,检测表达产物。
1.4 p10-VP1蛋白的Western-blot鉴定
将待检蛋白样品进行SDS-PAGE电泳,然后转印至硝酸纤维素膜。使用含有5%BSA的PBST于4 ℃封闭过夜;用PBST洗涤3遍,加入T7 Tag-HRP抗体在37 ℃下作用1 h,用PBST洗涤5遍,使用DAB显色试剂盒显色。
1.5 p10-VP1蛋白的纯化
将蛋白样品冻干后重新溶解,使用Sephadex G-50进行分离纯化,洗脱液为Tris-HCI缓冲液(0.02 mol/L, pH 7.8)。分离条件:上样质量浓度100 mg/mL,上样量3 mL,流速为0.3 mL/min。每管收集3 mL,测定A280值,当A280小于0.05时停止洗脱。收集各峰组分进行冻干,溶解后通过SDS-PAGE电泳检测得到的目的蛋白。
1.6 p10-VP1蛋白的电镜观察
将20 μL p10-VP1蛋白溶液置载样铜网上,吸附1 min,用滤纸从侧面吸去多余液体,滴加0.5%醋酸铅溶液,在室温下负染10 min;然后吸去多余负染液,于白炽灯下干燥10 min,在电子显微镜下观察并照相。
2 结果与分析
2.1 表达质粒载体pET-p10-VP1的构建
以T7噬菌体基因组为模板,扩增p10基因,产物经1%琼脂糖凝胶电泳后,扩增片段大小与预期相符;纯化回收目的片段,与pMD19-T连接后测序,测序结果与预期结果一致。将PCR产物和质粒pET-28a分别进行双酶切,之后在37 ℃下连接,构建原核表达载体pET-p10-VP1,并将连接产物转化至感受态细胞BL21(DE3);扩增培养重组菌并抽提质粒后,进行酶切验证,得到的目的片段为1250 bp左右(图1)。
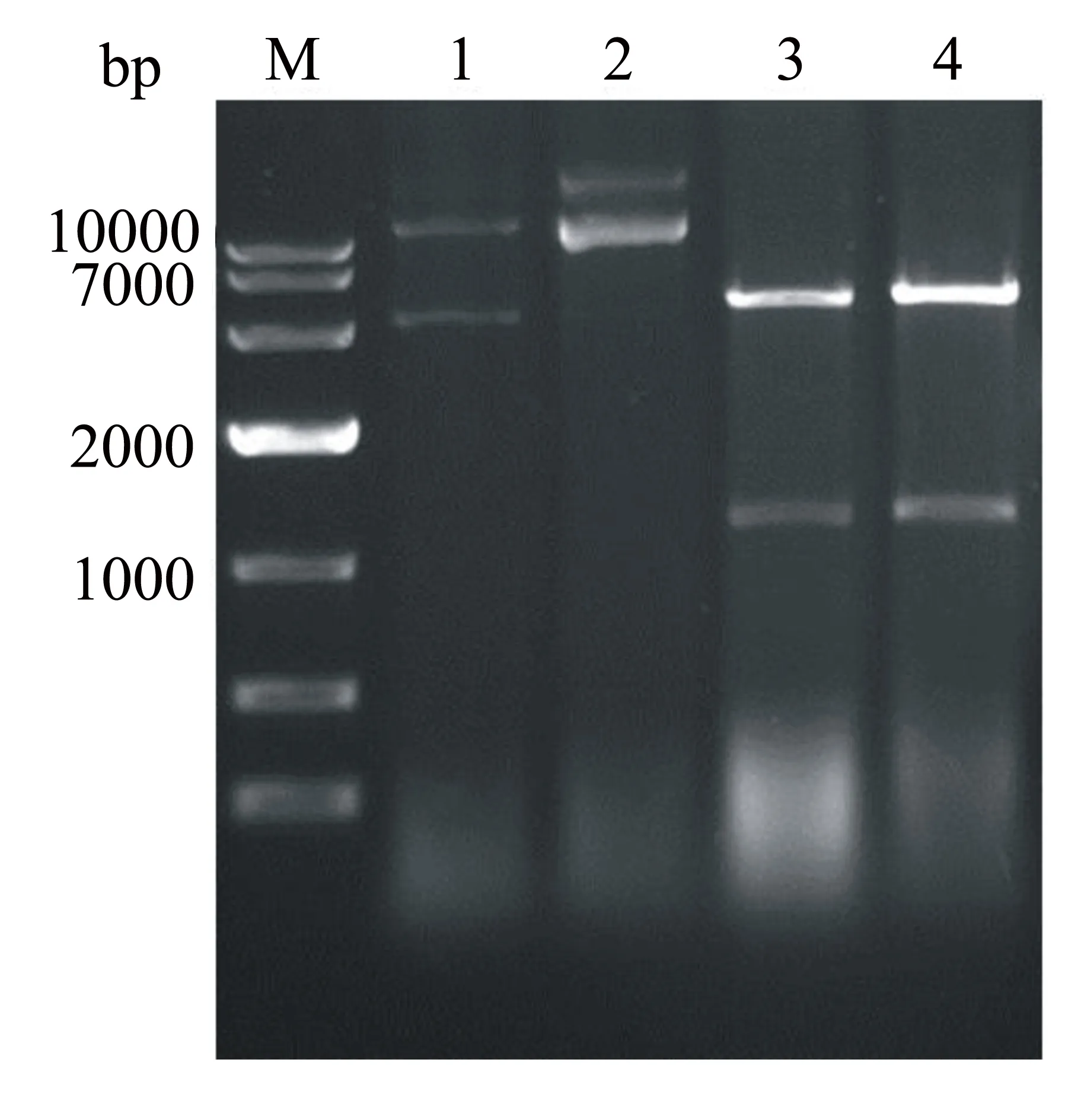
Lane M: Marker; Lane 1~2:未酶切的pet28-p10-VP1质粒;
2.2 p10-VP1蛋白的表达与鉴定
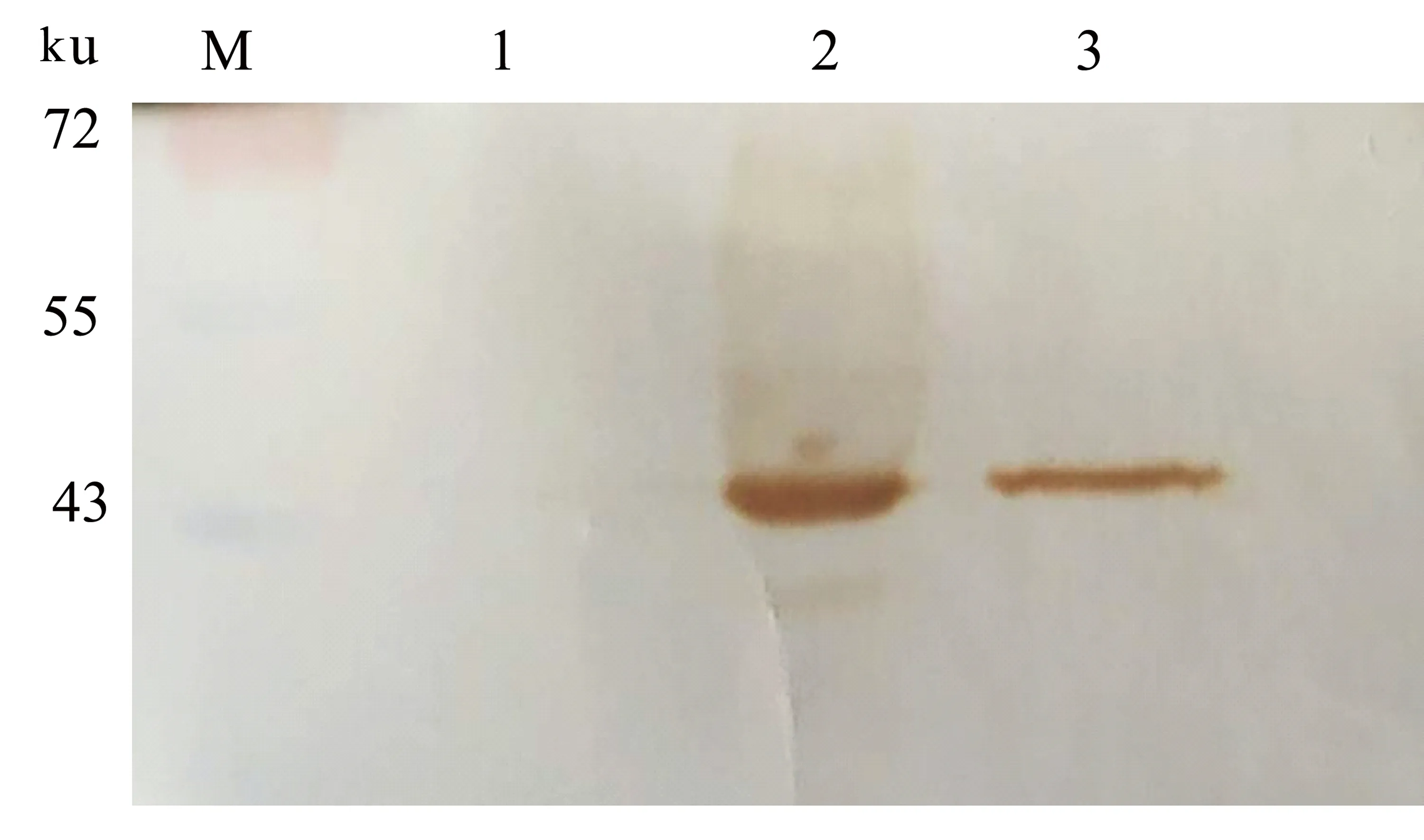
将含有质粒pET-p10-VP1的大肠杆菌BL21(DE3)接种于LB培养基,经IPTG诱导、超声破碎,取沉淀和上清进行检测。SDS-PAGE电泳结果显示,在相对分子质量为45000附近有明显的蛋白带,与预期蛋白大小相符(图2)。由图2可见,在25 ℃下表达蛋白在上清中条带较深,而在沉淀中条带不明显,说明在该温度下目的蛋白部分以可溶性蛋白的形式存在。
对表达蛋白进行Western-blot分析,结果(图3)表明,重组表达产物能够被特异性识别,在47 ku处有特异性蛋白条带。
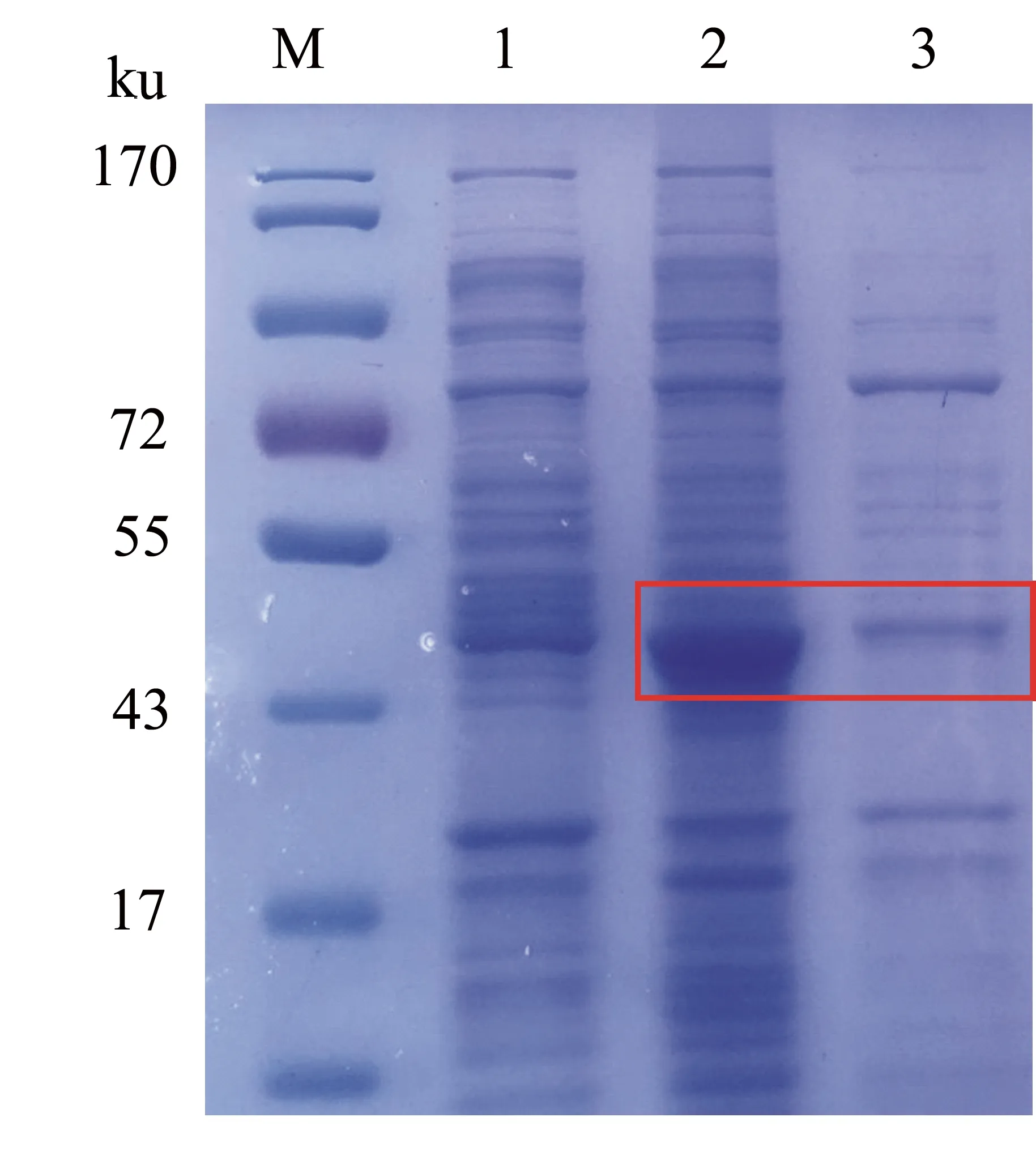
Lane M: Marker; Lane 1:未诱导的BL21(DE3)/pET-p10-VP1菌体; Lane 2:在25 ℃下用IPTG诱导的BL21(DE3)/pET-p10-VP1菌体上清; Lane 3:在25 ℃下用IPTG诱导的BL21(DE3)/pET-p10-VP1菌体沉淀。
图2 BL21(DE3)/pET-p10-VP1表达产物的SDS-PAGE电泳结果
Lane M: Marker; Lane 1:未诱导的BL21(DE3)/pET-p10-VP1菌体; Lane 2:在25 ℃下用IPTG诱导的BL21(DE3)/pET-p10-VP1菌体上清; Lane 3:在25 ℃下用IPTG诱导的BL21(DE3)/pET-p10-VP1菌体沉淀。
图3 BL21(DE3)/pET-p10-VP1表达蛋白的Western-blot分析结果
2.3 p10-VP1蛋白的纯化
按照1.6中的方法对蛋白冻干样品进行凝胶层析,在280 nm处测定波长,得到色谱图(图4)。收集各峰处溶液,将其冻干,溶解后通过SDS-PAGE检测发现符合目的蛋白分子量的条带主要存在于峰Ⅰ(图5)。

图4 BL21(DE3)/pET-p10-VP1表达蛋白经Sephadex G-50分子筛凝胶层析
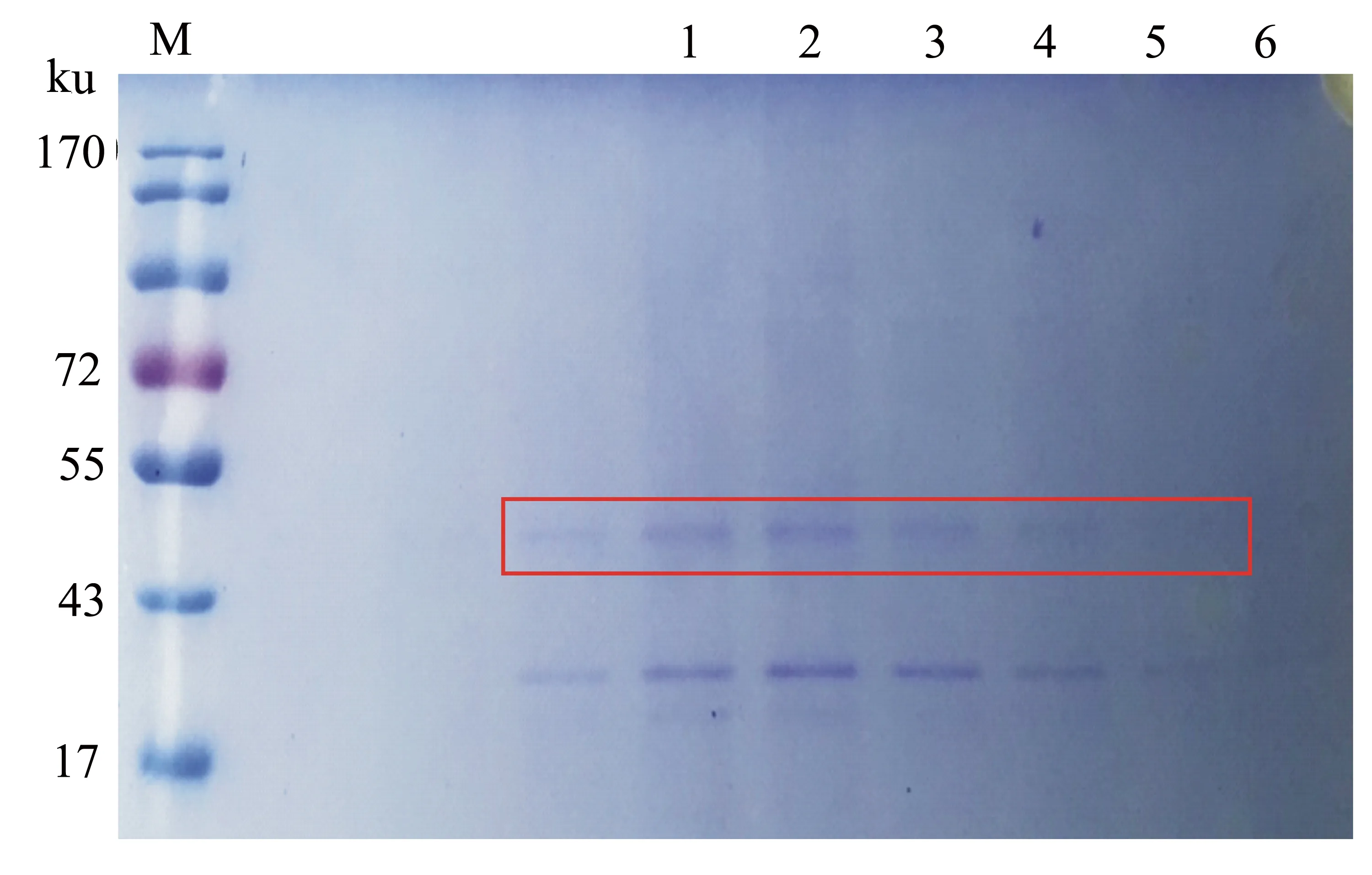
Lane M: Marker; Lane 1~6: BL21(DE3)/pET-p10-VP1表达产物经Sephadex G-50分子筛凝胶层析后峰Ⅰ中58~62管。
图5 BL21(DE3)/pET-p10-VP1表达蛋白经Sephadex G-50分子筛凝胶层析后的SDS-PAGE电泳结果
2.4 p10-VP1蛋白的电镜观察
将峰Ⅰ中收集蛋白置于电镜下观察,可见经过纯化的p10B-VP1融合蛋白能够聚集形成形状不规则的完整VLP粒子,直径在20~40 nm(图6)。该结果与预期相符合。
3 讨论
T7噬菌体作为原核生物的病毒,在感染BL21后可以利用细菌蛋白元件启动自身蛋白的表达[11]。本研究将p10蛋白基因克隆至pET-28表达载体并导入BL21-DE3进行诱导表达,其蛋白表达过程与噬菌体自然感染启动表达相类似,这不仅能够保证较高的蛋白表达量,其相同的表达环境还便于p10蛋白的正确折叠,使其保持自然状态。SDS-PAGE分析结果显示,诱导表达的p10-VP1蛋白以可溶性表达为主。这为自组装成VLP提供了依据。
抗原递呈是启动免疫应答的第一步,VP1中和性抗原表位因受其自身大小的限制不能引起足够的免疫应答。为了用有效的递呈抗原刺激机体,使之产生针对抗原的特定抗体,需要偶联大分子载体蛋白[12]。VLP是由病毒衣壳蛋白装配而成不含病毒核酸的空壳,具有病毒的结构和免疫原性,能够诱导机体产生很强的免疫反应;由于其不携带遗传信息,因此可以避免病毒感染风险,提高安全性。本研究选择以E.coliBL21为单一宿主的T7噬菌体作为VLP研究对象,通过表达p10衣壳蛋白并利用其表面展示特性,尝试自组装VLP,一方面提高VLP使用的安全性,另一方面有效递呈表面展示的抗原表位。抗原颗粒的大小影响免疫应答的效率与类型[13];20~200 nm的颗粒抗原不仅能够直接进入淋巴管并快速转运至B细胞聚集区,还能进行有效的APC识别与递呈。本研究选取的T7噬菌体头部约50 nm,是理想大小的免疫原。

图6 BL21(DE3)/pET-p10-VP1表达蛋白的透射电镜形态
T7噬菌体头部的组装需要多个蛋白的协同,其中包括gene 8编码的接头蛋白、gene 9编码的折叠蛋白、gene 10编码的主要衣壳蛋白和次要衣壳蛋白。有文献[14]报道T7噬菌体在缺失gene 9和gene 10的情况下不能形成衣壳;当缺失gene 8和一些内核蛋白如gene 14、15、16时不能够形成衣壳,但能够不规则地聚集形成多聚衣壳。本研究试图验证在单独表达衣壳蛋白的情况下,是否能够组装成有颗粒结构的VLP粒子。电镜观察结果表明,经过纯化的p10B-VP1融合蛋白能够随机聚集形成形状不规则的完整粒子,其大小、形状与T7噬菌体头部有差异,但与文献报道相符合,因此该方法可以用于VLP的制备。
[1] 杨春华,王强,王毅,等.猪口蹄疫的诊断及其综合防控[J].畜牧与饲料科学,2009,30(7):12-17.
[2] 施建明,胡惠根,张晓红.猪口蹄疫的发生与防制[J].现代农业科技,2012(2):332-332.
[3] Bittle J L, Houghten R A, Alexander H, et al. Protection against foot-and-mouth disease by immunization with a chemically synthesized peptide predicted from the viral nucleotide sequence[J]. Nature, 1982, 298(5869): 30-33.
[4] Rodriguez L L, Barrera J, Kramer E, et al. A synthetic peptide containing the consensus sequence of the G-H loop region of foot-and-mouth disease virus type-O VP1 and a promiscuous T-helper epitope induces peptide-specific antibodies but fails to protect cattle against viral challenge[J]. Vaccine, 2003, 21(25-26): 3751-3756.
[5] Meloen R H, Casal J I, Dalsgaard K, et al. Synthetic peptide vaccines: success at last[J]. Vaccine, 1996, 13(10): 885-886.
[6] Li G, Chen W, Yan W, et al. Comparison of immune responses against foot-and-mouth disease virus induced by fusion proteins using the swine IgG heavy chain constant region or β-galactosidase as a carrier of immunogenic epitopes[J]. Virology, 2004, 328(2): 274-281.
[7] 张庆勋,刘新生,周鹏,等.口蹄疫病毒病毒样颗粒研究进展[J].中国畜牧兽医,2014,41(11):258-262.
[8] Clark J R, March J B. Bacterial viruses as human vaccines?[J]. Expert Review of Vaccines, 2004, 3(4): 463-476.
[9] Agirrezabala X, Martín-Benito J, Castón J R, et al. Maturation of phage T7 involves structural modification of both shell and inner core components[J]. Embo Journal, 2005, 24(21): 3820-3829.
[10] Cerritelli M E, Trus B L, Smith C S, et al. A second symmetry mismatch at the portal vertex of bacteriophage T7: 8-fold symmetry in the procapsid core[J]. Journal of Molecular Biology, 2003, 327(1): 1-6.
[11] 王义伟,徐海,陈瑾,等.重组T7噬菌体生物学特性的研究[J].动物医学进展,2014,35(1):36-40.
[12] Clarke B E, Newton S E, Carroll A R, et al. Improved immunogenicity of a peptide epitope after fusion to hepatitis B core protein[J]. Nature, 1987, 330(6146): 381-384.
[13] Bachmann M F, Jennings G T. Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns.[J]. Nature Reviews Immunology, 2010, 10(11): 787-796.
[14] Masker W E, Serwer P. DNA packaging in vitro by an isolated bacteriophage T7 procapsid.[J]. Journal of Virology, 1982, 43(3): 1138-1142.
(责任编辑:黄荣华)
Expression of p10 Fusion Protein from Bacteriophage T7 and Observation of Self-assembled VLP
XU Yue1,2, XU Hai1,2, BAO Xi1,2, WANG Yi-wei1,2, LU Yu1,2, HOU Ji-bo1,2*
(1. National Research Center of Engineering and Technology for Veterinary Biological Products, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. Jiangsu Provincial Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The prokaryotic expression of the fusion protein p10 from bacteriophage T7 was studied, and the formation of self-assembled virus-like particle (VLP) was observed under the electron microscope. The p10 gene was amplified through PCR, and it was linked to the VP1 antigenic epitope gene in foot and mouth disease virus (FMDV). The fusion gene in downstream was inserted into pET-28a vector to construct the recombinant plasmid, and IPTG was used to induce the recombinant bacteria expressing target protein. The VLP formation was observed by electron microscopy. The results showed that the pET-p10-VP1 expression strain was constructed successfully. SDS-PAGE and Western-blot analysis showed the target protein was high-efficiently expressed, and it generated an immune response to the VP1 specific antibody. A 40-nm VLP was produced in the recovered p10-VP1 protein samples observed by transmission electron microscopy. The above results suggested that the fusion protein p10 from bacteriophage T7 could self-assemble VLP and could be used for the surface display of antigenic epitope.
Bacteriophage T7; Foot and mouth disease virus; Expression; VLP
2016-09-06
江苏省农业科技自主创新资金项目[CX(14)2085];公益性行业(农业)科研专项(201303046)。
徐悦(1986─),女,江苏南京人,硕士研究生,研究方向为预防兽医。*通讯作者:侯继波。
Q78
A
1001-8581(2017)02-0014-04
