抗丙型肝炎病毒药物
2017-02-16仲兆金李卓荣
仲兆金,李卓荣
抗丙型肝炎病毒药物
仲兆金,李卓荣
丙型肝炎病毒(hepatitis C virus,HCV)是肝脏疾病的主要病因,全球范围约有 1.85 亿人感染,连同隐匿性感染可能再增加 20% ~ 30%[1]。持久性 HCV 感染与肝纤维化和肝硬化、肝功能衰竭或肝癌的发展有关,并且是肝移植最常见的适应证。
HCV 是一种小包膜病毒,是黄病毒家族的一个成员。来源于不同地域个体的 HCV 核苷酸序列比较表明,存在7 个主要 HCV 基因型,且至少有 67 种亚型[2]。
HCV 是一个含约 9600 个核苷酸的正单链 RNA 病毒。HCV 基因组包含一个大的开放读码框,编码约 3100 个氨基酸的多蛋白。该多蛋白被病毒和宿主蛋白酶加工为结构HCV 蛋白核(C)、包膜糖蛋白 1 和 2(E1,E2)、p7 和6 个非结构 HCV 蛋白(NS2、NS3、NS4A、NS4B、NS5A 和 NS5B)。核蛋白携带 E1 和 E2 形成病毒核衣壳,是病毒附着与侵入宿主细胞的受体。非结构蛋白是 HCV 病毒周期的多功能蛋白基础。p7 是一个小的疏水蛋白,其寡聚成圆形六聚体,最有可能服务于一个通过病毒脂质膜的离子通道。HCV 基因组中多数翻译部分由高度保守的 HCV 3' 和5' 非翻译区(UTR)相伴左右。5' UTR 是由形成内部核糖体进入位点(IRES)的四个高度结构域组成,它在 HCV 复制中起重要作用(图 1)[3-4]。
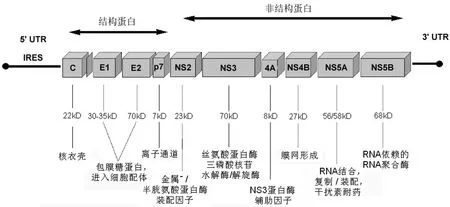
图 1 HCV 基因组示意图
HCV 药物研究包括干扰素、抗病毒药物、治疗疫苗和宿主靶向药物(host targeting agents,HTAs)等。除聚乙二醇干扰素(peginterferon,PegIFN)α 和利巴韦林(ribavirin)为基础的 HCV 药物,发展最快的是直接作用抗病毒药物(direct-acting antivirals,DAAs)。原则上,HCV 基因组中4 个结构蛋白、6 个非结构蛋白、特异性 RNA 结构如IRES 以及 HCV 依赖的宿主因素是 DAAs 药物适合的靶点。目前已上市和研发中最多的 HCV 药物类别,根据作用靶点可分为 NS3/4A 蛋白酶抑制剂、(非)核苷类 NS5B 聚合酶抑制剂和 NS5A 复制复合物抑制剂等。
2011 年以前,临床上主要用干扰素及利巴韦林治疗HCV 感染。2011 年以后,靶点确定的 NS3/4A 蛋白酶抑制剂、(非)核苷类 NS5B 聚合酶抑制剂和 NS5A 抑制剂等 DAAs 药物成为治疗 HCV 的主要药物。这些药物包括telaprevir、boceprevir、simeprevir、vaniprevir、asunaprevir、 paritaprevir、grazoprevir、sofosbuvir、dasabuvir、elbasvir、ledipasvir、ombitasvir、daclatasvir 和 velpatasvir 等(图 2)。这些药物或适当组合或与 PegIFN-α-2a、PegIFN-α-2b 和利巴韦林联合对不同 HCV 基因型感染患者治疗有效。HCV感染的基因型、经验治疗、肝肾功能、剂量与疗程、不良反应、药物相互作用和耐药等均能影响患者的治疗效果。本文就目前临床常用和在研的抗 HCV 药物综述如下。
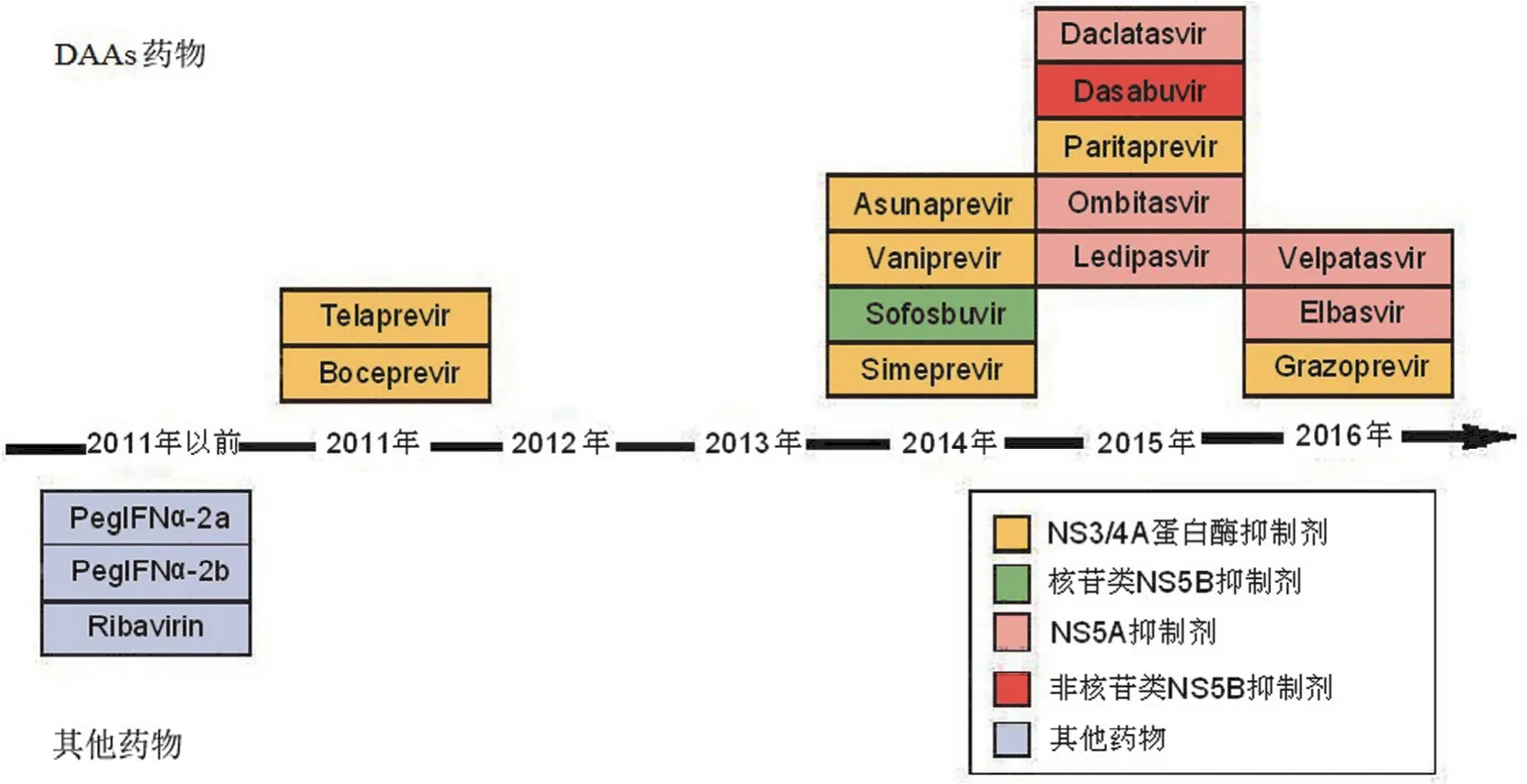
图 2 临床常用的抗丙型肝炎病毒药物
1 NS3/4A 蛋白酶抑制剂
目前临床常用的 HCV NS3/4A 蛋白酶抑制剂包括telaprevir、boceprevir、simeprevir、vaniprevir、asunaprevir、 grazoprevir 和 paritaprevir(图 3)。处于临床不同发展阶段的 NS3/4A 蛋白酶抑制剂日益增多[5-6],如 faldaprevir(BI 201335)、vedroprevir(GS-9451)、GS-9256、GS-9857、IDX-320、sovaprevir(ACH-1625)、danoprevir(ITMN-191,RG-7227)、deldeprevir(neceprevir,ACH-2684)、narlaprevir (SCH-900518)、PHX1766、furaprevir(TG-2349)和glecaprevir(ABT-493)等。
1.1 Telaprevir
Telaprevir(VX-950,商品名 Incivek)由 Vertex 和Johnson & Johnson 制药公司研发,于 2011 年 5 月 23 日被 FDA 批准用于成人基因 1 型慢性丙型肝炎和代偿性肝病的治疗。剂型为 375 mg 片剂,推荐剂量为 1125 mg,每日 2 次,与食物(非低脂肪)同服,间隔 10 ~ 14 h。轻度、中度或重度肾损伤或轻度肝受损患者无需剂量调整。与PegIFN 和利巴韦林合用 12 周,初治和先前经验治疗复发的患者,若 4 周和 12 周 HCV RNA 检测不到,再继续服用 PegIFN 和利巴韦林 12 周;若 4 周 HCV RNA 可检测(< 1000 IU/ml),12 周检测不到,则继续服用 PegIFN 和利巴韦林 36 周;先期经验治疗部分和无应答或初治肝硬化患者再服用 36 周 PegIFN 和利巴韦林。以下情况患者应终止治疗:在 4 或 12 周 HCV RNA 水平大于 1000 IU/ml;在第 24 周可检测到 HCV RNA。
Telaprevir 显著的不良反应为皮疹、肛肠不适和贫血,组合疗法要考虑 PegIFN 和利巴韦林的不良反应。Telaprevir 是细胞色素 P450 3A4(CYP3A)强抑制剂,也可抑制 P-糖蛋白(P-gp)、有机阴离子转运肽 OATP1B1 和OATP2B1,且主要由 CYP3A 代谢,应注意药物相互作用。该药物不单独使用。治疗出现耐药突变是常见的,在未达到持续病毒学应答(SVR)的分析中,出现变种基因 1a 型比1b 型的患者更多见。常见的基因突变是 V36M/A/L、T54A/S、R155K/T 和 A156S/T,这些突变可单独或组合发展[7-9]。
1.2 Boceprevir
Boceprevir(SCH503034,商品名 Victrelis)由Schering-Plough 和 Merck 公司开发制造,2011 年 5 月13 日,FDA 批准与 PegIFN-α 和利巴韦林联合用于治疗成人基因 1 型慢性丙型肝炎感染和代偿性肝病。剂型为200 mg 的胶囊,推荐剂量口服 800 mg,每日 3 次与食物同服。治疗初始 4 周只用 PegIFN 和利巴韦林,再用该药物联合 PegIFN 和利巴韦林,疗程(44 周)取决于患者病毒学应答、先前响应状态和是否有肝硬化。HCV RNA 水平在治疗 4 或 12 周大于 100 IU/ml 或在 24 周时可检测到,治疗即终止[10-11]。
常见不良反应有贫血、中性粒细胞计数减少、味觉障碍、呕吐等,其代谢主要通过醛酮还原酶,部分通过 CYP3A4/5,与相关代谢药物可发生显著相互作用。该药物是低耐药屏障,耐药取决于患者是否具有基因 1a 或 1b 型的 HCV,临床常见的患者治疗相关的耐药发展突变,基因 1a 型是V36M、T54S 和 R155K,基因 1b 型是 T54A、T54S、V55A、A156S 和 V170A[9, 12]。
1.3 Simeprevir
Simeprevir(TMC 435350,商品名 Olysio)由 Janssen、Medivir AB 和 Idenix 制药公司研发,于 2013 年 11 月22 日被 FDA 批准用于治疗基因 1 型慢性丙型肝炎。剂型为 150 mg 的胶囊,与食物口服,每日 1 次。联合 PegIFN-α和利巴韦林 12 周治疗后,再 PegIFN-α 和利巴韦林治疗,初治和既往复发患者 12 周,前期部分或无应答者 36 周。若患者治疗 4、12 或 24 周的 HCV RNA 水平大于25 IU/ml,应终止治疗。若患者有 Q80K 多态性基线,则不应使用此三联疗法。轻、中或重度肾功能不全患者和轻度肝受损患者剂量不需调整。该药物不单一用药,先前蛋白酶抑制剂治疗失败,严重肝功能不全患者限制使用[13-14]。

图 3 NS3/4A 蛋白酶抑制剂
常见不良反应有皮疹、皮肤瘙痒和恶心等。有“磺胺过敏”者应关注风险。应注意诱导 CYP3A 的药物(如利福平等)、抑制 CYP3A 的药物(如克拉霉素等)、由 CYP3A4进行初级代谢的药物和 HIV 抗逆转录病毒等药物的相互作用。耐药和交叉耐药是一个显著问题。该药物三联疗法未能使 SVR12 患者中超过 90% 出现 NS3/4 蛋白酶突变。突变主要出现在 NS3 的位置:Q80、S122、R155 和 D168,治疗失败常见的是基因 1a 型 R155K 突变(单一或与突变Q80、S122 和 D168 组合),基因 1b 型是 D168V 突变。R155K、I170T 和 A156T/V 突变可出现在与 boceprevir 或telaprevir 的交叉耐药中,该两药物未达到 SVR 的患者,不建议使用本药物,特别是基因 1a 型患者[15-17]。
1.4 Vaniprevir
Vaniprevir(MK-7009,商品名 Vanihep)由默沙东研发,于 2014 年 9 月 26 日由日本厚生劳动省批准上市。用于治疗基因 1 型慢性丙肝感染。口服胶囊每粒含 150 mg,与PegIFN 和利巴韦林联用,推荐剂量为每日 300 mg,1 或2 次服用,疗程 12 或 24 周。临床上对 HCV 基因 1 型感染,12 周组(该药物与干扰素 PegIFN-α-2b 和利巴韦林联用 12 周,然后干扰素和利巴韦林联用 12 周);24 周组(该药物与干扰素和利巴韦林联用 24 周);对照组(干扰素和利巴韦林);24 周后,初治 12 周、24 周和对照组患者 SVR24 分别为 83.7%、84.5% 和 55.1%,先前干扰素治疗后复发的患者,12 和 24 周组 SVR24 为 92.0% 和96.2%;先前治疗无应答患者 24 周组 SVR24 为 61.9%[18]。
临床中观察到包括干扰素和利巴韦林的不良反应主要有发热、头痛、恶心、萎靡、脱发、皮肤瘙痒症、皮疹以及中性粒细胞减少、白细胞减少、血红蛋白减少和血小板减少等。老年人、儿童、妊娠及哺乳期妇女、乙肝病毒感染或有既往史患者、中度肝功能不全患者慎用。严重肝功能不全患者不推荐使用。该药物主要由 CYP3A 代谢,并为 OATP1B1及 OATP1B3 的底物,与相关药物如利福平和阿扎那韦等共用有相互作用。病毒学失败主要与治疗上出现的 R155 或 D168 突变相关[18-19]。
1.5 Asunaprevir
Asunaprevir(BMS-650032,商品名 Sunvepra)由Bristol-Myers Squibb 公司开发,2014 年7 月 4 日在日本上市,与 daclatasvir 合用治疗 HCV 基因 1 型感染,包括有代偿性肝硬化的患者。它是无需联用干扰素和利巴韦林的口服药物。成人每日 2 次,每次 100 mg,与 daclatasvir 60 mg 每日 1 次联用,疗程 24 周。临床试验显示,慢性丙型肝炎基因 1b 型、干扰素不适合(不耐受)、干扰素联合利巴韦林治疗不适合或无效患者接受此药物组合。干扰素不适合(不耐受)患者 SVR24 为 87.4%,前治疗无效患者为 80.5%,无失代偿期肝硬化患者为 84.0%,失代偿期肝硬化患者为 90.9%。另一项 307 例患者的临床研究得到类似结果[20-21]。
Asunaprevir 不良反应主要是 ALT 升高、AST 升高、头痛、发烧等。孕产妇及婴幼儿尚不推荐使用。中或重度肝功能不全或失代偿性肝病患者、有乙肝病毒感染或感染史者应注意风险。该药物是 CYP3A 代谢,对 CYP2D6、OATP1B1(或 1B3、2B1)及 P-gp 有抑制作用和 CYP3A4的诱导效应。联合用药治疗前后需分析 NS3 蛋白酶取代氨基酸残基 155、156、168 和 NS5A 取代氨基酸残基 L31、Y93 的变异。HCV 复制子细胞培养发生 asunaprevir 耐药,NS3 蛋白酶取代氨基酸残基,基因 1a 型主要为 R155K、 D168G 和 I170T,低到中等水平耐药,基因 1b 型在 D168 (D168A/G/H/V/Y),高水平耐药[22-23]。
2 NS5A 复制复合物抑制剂
目前临床常用的 HCV NS5A 复制复合物抑制剂包括daclatasvir、elbasvir、ledipasvir、ombitasvir 和 velpatasvir(图 4)。它们多与 NS3/4A 蛋白酶抑制剂或 NS5B 聚合酶抑制剂等组成复合药物用于临床。在研的 NS5A 复制复合物抑制剂包括 ravidasvir(PPI-668)、PPI-461、PPI-1301、JNJ-56914845(GSK-2336805)、samatasvir(IDX-719)、BMS-824393、AZD-7295、TD-6450、odalasvir(ACH-3102)、pibrentasvir(ABT-530)和 ruzasvir(MK-8408)等[5-6]。
图 4 NS5A 复制复合物抑制剂
2.1 Daclatasvir
Daclatasvir(BMS-790052,商品名 Daklinza)是 HCV NS5A 抑制剂,为 Bristol-Myers Squibb 产品,2015 年7 月 24 日,FDA 批准与 sofosbuvir 组合用于治疗慢性HCV 基因 3 型感染。推荐剂量为口服 60 mg,每日 1 次,sofosbuvir 为 400 mg,每日 1 次。无肝硬化患者的治疗推荐疗程为 12 周。
Daclatasvir 有很好的耐受性,与 sofosbuvir 组合使用,常见的不良反应是疲劳、头痛、恶心和腹泻等。禁忌是同时使用 CYP3A 强诱导剂如苯妥英钠、卡马西平和利福平等。与 sofosbuvir 和胺碘酮联合用药,特别是患者还使用 β-阻断剂,可能会导致严重的心动过缓。体内产生耐药的主要氨基酸取代在残基 M28、Q30、L31 与 Y93(基因 1a 型)和 L31 与 Y93(基因 1b 型)上,类似于体外复制子系统。临床与耐药相关的病毒学失败有 NS5A-Y93H 耐药突变和出现 NS5A-L31I[24-25]。
2.2 Elbasvir-grazoprevir
Elbasvir-grazoprevir(商品名 Zepatier)是 elbasvir (MK-8742)和 NS3/4A 蛋白酶抑制剂 grazoprevir (MK-5172)的固定剂量组合(50 mg/100 mg),由 Merck 公司制造。2016 年 1 月 28 日,被 FDA 批准治疗成人基因1 或 4 型慢性丙型肝炎感染。推荐剂量为口服每日 1 次1 粒。用药前 HCV 基因 1a 型感染患者要做耐药检测,NS5A 耐药相关多态性决定疗程和是否加入利巴韦林。基因1a 型,初治或 PegIFN/利巴韦林经验治疗失败(无基线NS5A 多态性),疗程 12 周,或(有基线 NS5A 多态性)联合利巴韦林 16 周。基因 1b 型,初治或 PegIFN/利巴韦林经验治疗失败,疗程 12 周。基因 1a 或 1b 型,PegIFN/利巴韦林/HCV NS3/4A 蛋白酶抑制剂经验治疗失败,联合利巴韦林治疗 12 周。基因 4 型初治疗程 12 周;PegIFN/利巴韦林经验治疗失败,联合利巴韦林治疗 16 周。临床试验显示,有或无利巴韦林,SVR12 率在 92% ~ 97%,且 HCV 和 HIV 合并感染同样有效,对包括血液透析的肾病患者有高 SVR12 率。中度或重度肝功能不全患者禁用[26-29]。
常见不良反应是疲劳、头痛、恶心等。忌与 OATP1B 抑制剂、CYP3A 强诱导剂和依法韦仑共用。50 名治疗失败患者耐药分析表明,突变出现在 NS3 取代,HCV 基因 1a 型 78%、1b 型 25% 和 4 型 40%,基因 1a 型常见的相关突变 A156T 和 D168A 可对 grazoprevir 等蛋白酶抑制剂耐药。NS5A 取代发生在 81% 基因 1a 型、88%1b 型和所有基因 4 型治疗失败患者中。Elbasvir体外保持 M28V 和 Q30L 基因 1a 型 NS5A 变体和 L28M/V、R30Q、L31V 及 Y93C 活性,它们可对其他 NS5A 抑制剂耐药[27, 30-31]。
2.3 Ledipasvir-sofosbuvir
Ledipasvir-sofosbuvir(商品名 Harvoni)是 ledipasvir (GS-5885)与 NS5B 聚合酶抑制剂 sofosbuvir 的固定剂量组合,由 Gilead Sciences 公司制造。2014 年 10 月10 日,该组合被 FDA 批准用于治疗成人慢性丙型肝炎基因 1 型感染,推荐剂量片剂(90 mg/400 mg)每日 1 次1 片,疗程(8 ~ 24 周)取决于先前经验治疗和是否存在肝硬化。临床 12 周治疗慢性 HCV 基因 1 型感染患者,SVR12 率大于 90%[32-33]。
该组合有良好的耐受性,常见的不良反应是疲劳和头痛,与 P-gp 的诱导剂(如利福平)有显著相互作用。III 期临床试验失败最常见的突变,HCV 基因 1a 型是 Q30R、Y93H(或 Y93N)和 L31M,基因 1b 型是 Y93H,且未检测到 S282T 突变。该组合药物也被推荐治疗 HCV 基因4、5 或 6 型感染以及 HIV 合并感染患者[34-35]。
2.4 Ombitasvir-paritaprevir-ritonavir
固定剂量组合 ombitasvir-paritaprevir-ritonavir(商品名Technivie)由美国 AbbVie 公司制造。Ombitasvir(ABT-267)是 HCV NS5A 抑制剂,paritaprevir(ABT-450)为 NS3/4A抑制剂。Ritonavir 是 CYP3A4 酶的强抑制剂,它显著增加paritaprevir 峰谷血浆浓度和曲线下的面积,是被批准的HIV 蛋白酶抑制剂,不具有抗 HCV 活性。2015 年 7 月24 日,FDA 批准该组合与利巴韦林用于治疗慢性 HCV 基因 4 型感染的无肝硬化患者。每片含 ombitasvir 12.5 mg、paritaprevir 75 mg、ritonavir 50 mg。推荐剂量是每日 1 次,早上与食物同服 2 片。治疗 HCV 基因 4 型感染,联合利巴韦林疗程为 12 周。不耐受利巴韦林患者可考虑该组合制剂的 12 周疗程。不推荐中度肝功能损伤患者使用,严重肝功能损伤患者禁用。
常见不良反应是乏力、恶心、疲劳,以及 ALT 升高。禁忌与高度依赖于 CYP3A 清除的药物,中等和强的CYP3A 诱导剂合用,以及对 ritonavir 过敏。临床试验中,3 例该组合(无利巴韦林)病毒学失败,与耐药相关的取代包括 NS3 突变 D168V(有或无 Y56H)和 NS5A 突变L28S 与 L28V(有或无 M31I 或 T58S)。另外体外突变已在细胞培养中观察到[36-37]。
2.5 Ombitasvir-paritaprevir-ritonavir + dasabuvir
Ombitasvir-paritaprevir-ritonavir + dasabuvir(商品名Viekira Pak)由美国 AbbVie 公司制造。Dasabuvir (ABT-333)是一非核苷类 NS5B 抑制剂。2014 年 12 月19 日,FDA 批准该组合药物治疗成人基因 1 型慢性丙型肝炎感染,包括代偿性肝硬化患者。推荐剂量,每日 1 次2 片 Technivie,每日 2 次 dasabuvir,每次 1 片(250 mg),与食物同服。疗程(12 ~ 24 周)和是否联用利巴韦林取决于基因 1 型的亚型和肝硬化与否。除了基因 1b 型的无肝硬化患者,其他均推荐使用利巴韦林。该药物有或无联合利巴韦林,治疗慢性 HCV 感染,包括代偿性肝硬化,HIV 合并感染和接受肝移植后患者,六项研究共涉及 2308 例基因1 型感染患者,SVR12 率 91% ~ 100%。
使用禁忌包括肝功能失代偿;同时使用高度依赖于CYP3A 清除的药物、CYP3A 的强诱导剂、CYP2C8 的强诱导剂与抑制剂;对 ritonavir 过敏和利巴韦林使用禁忌;或同用含乙炔雌二醇的药物。临床 64 例基因 1 型感染患者耐药分析,20 例病毒学失败和 44 例复发。治疗出现的突变,基因 1a 型是 53%,基因 1b 型是 17%;58 例基因 1a 型患者,88% 发展为 NS3 突变,78% NS5A 突变和67% NS5B突变[38-41]。
3 NS5B 聚合酶抑制剂
目前临床常用的 HCV NS5B 聚合酶抑制剂包括sofosbuvir 和 dasabuvir(图 5),它们多与 NS3/4A 蛋白酶抑制剂或 NS5A 复制复合物抑制剂等组成复合药物用于临床。在研的 NS5B 聚合酶抑制剂包括核苷类 NS5B 聚合酶抑制剂 mericitabine(RG7128,RO5024048)、BMS-986094 (INX-189)、GS-0938(PSI-352938)、BCX-5191、IDX-184、ALS-2200(VX-135)、ALS2158、TMC-649128、balapiravir (R-1626,RO-4588161)、GS-6620、NM-283、IDX21459 和AL-335 等。非核苷类 NS5B 聚合酶抑制剂 deleobuvir(BI 207127)、beclabuvir(BMS-791325)、TMC-647055、filibuvir (PF-868554)、lomibuvir(VX-222)、tegobuvir(GS-9190)、setrobuvir(ANA-598,RG-7790)、ABT-072、VCH-916、VCH-759、radalbuvir(GS-9669)、BILB 1941、MK-3281 和nesbuvir(HCV-796)等[5-6]。
图 5 NS5B 聚合酶抑制剂
3.1 Sofosbuvir
Sofosbuvir(GS-7977,商品名 Sovaldi)是核苷类 HCV NS5B 聚合酶抑制剂,由 Pharmasset 和 Gilead 公司研发。2013 年 12 月 6 日在美国获准用于治疗慢性丙型肝炎,2014 年 11 月 5 日与 simeprevir 组合获准治疗基因 1 型感染,而后与 daclatasvir 组合获准治疗基因 3 型感染。剂型有 400 mg 片剂,推荐剂量是口服每日 1 次 1 片。治疗HCV 或与 HIV-1 合并感染,基因 1 或 4 型:联合PegIFN-α 及利巴韦林 12 周;基因 2 或 3 型:联合利巴韦林 12 或 24 周。治疗 HCV 基因 1 型,干扰素不适合,联合利巴韦林 24 周。HCV 单一感染:基因 1 型和干扰素不适合,联合利巴韦林 24 周;肝癌待肝移植:联合利巴韦林 48 周或至肝移植及移植后再感染。与 simeprevir 联合:基因 1 型无肝硬化患者 12 周,肝硬化患者 24 周。严重肾功能损害或末期肾病需要透析的患者尚无推荐剂量[42-44]。
与利巴韦林合用时常见的不良反应是疲劳和头痛。它是肠 P-gp 强诱导剂。不推荐与抗惊厥、抗分枝杆菌和 HIV蛋白酶抑制等药物合用。该药物具有高耐药屏障。已确定三种氨基酸的变化:L159F、S282T 和 V321A。少数 HCV 基因 3a 型患者为 L159F 和 V321A 突变,但没有导致表型耐药。L159F 突变已在等待肝移植肝癌和基因 1a 或 2b型患者中观察到,L159F 和(或)C316N 突变与移植后病毒学突破复发相关[30, 45]。
3.2 Sofosbuvir-velpatasvir
Sofosbuvir-velpatasvir(商品名 Epclusa)是 sofosbuvir 和 NS5A 复制复合物抑制剂 velpatasvir(GS-5816)的口服固定剂量组合,由 Gilead Sciences 公司制造,是第一个有广谱基因型活性的每日 1 次 1 片的片剂(400 mg/100 mg)。2016 年 6 月 28 日,由 FDA 批准用于治疗成人慢性丙型肝炎基因 1 ~ 6 型感染。治疗以下患者:无肝硬化和代偿期肝硬化 12 周;失代偿期肝硬化与利巴韦林联合12 周。轻至中度肾功能损害和轻、中或重度肝功能不全患者,无需调整剂量。严重肾功能损害或末期肾病血液透析患者,尚无推荐剂量。临床初治和经验治疗具有基因 1、2、3、4 和 6 型的慢性 HCV 感染患者,有或无联合利巴韦林,SVR12 率为 95% ~ 100%,疗程 12 周。对 HCV 感染和 HIV-HCV合并感染疗效相当。对失代偿性肝病患者使用利巴韦林是必要的,特别是那些基因 3 型感染者[46-48]。
常见不良反应是头痛和疲劳。不建议与 P-gp 诱导物和(或)中度至强 CYP2B6 诱导物药物以及质子泵抑制剂共用。Velpatasvir 是 OATP1B1(及 1B3、2B1)、P-gp 和乳腺癌耐药蛋白(BCRP)的抑制剂。需要注意的是胃 pH 值的增加,可能会降低 velpatasvir 的浓度。耐药相关的临床数据有限,病毒学失败中 2 例基因 1 型患者分别为 NS5A Y93N 取代,NS5A Y93H 有 K24M/T 和 L31I/V 低级别突变;10 例基因 3 型患者都发展为 Y93H[49-50]。
4 其他药物
4.1 Ribavirin
利巴韦林(商品名 Copegus、Rebetol、Ribasphere)是嘌呤核苷类似物,抗 HCV 机制不完全明确,已经提出的抗HCV 四个主要潜在作用位点:①HCV 的宿主 T 细胞免疫清除的增加;②宿主酶次黄嘌呤核苷酸脱氢酶(IMPDH)的抑制导致病毒 RNA 的合成基质三磷酸鸟苷池枯竭;③HCV 复制的直接抑制;④诱导 RNA 病毒突变发生,驱使 HCV 出现异常高的错误率[51]。
利巴韦林在美国有多家公司制造,FDA 在 1998 –2005 年间,批准了与干扰素 α 的联用,主要与 PegIFN-α-2a 或 PegIFN-α-2b 联用,用于治疗包括有代偿性肝脏疾病的慢性丙型肝炎。与 DAAs 药物,如 HCV NS5B 抑制剂sofosbuvir 的联用,被批准用于治疗慢性 HCV 基因 2 和3 型及干扰素不适合基因 1 型感染。利巴韦林治疗 HCV感染不采用单一用药方式,孕妇和血红蛋白病患者禁用。剂型有 200、400、500 和 600 mg 的片剂、胶囊剂和口服溶液,与食物一起服用,每日 2 次。200 mg 片剂,每日剂量800 mg;基于体重的剂量是小于 75 kg 为 1000 mg/d,大于75 kg 为 1200 mg/d。200 mg 胶囊和口服溶液(40 mg/ml),每日剂量 800 ~ 1400 mg。体重小于 66 kg 为 800 mg/d,66 ~ 80 kg 为1000 mg/d,81 ~ 105 kg 为 1200 mg/d,超过105 kg,为 1400 mg/d。与 PegIFN-α-2a 同用剂量为 800 ~1200 mg/d,与 PegIFN-α-2b 同用为 800 ~ 1400 mg/d。具体剂量和疗程取决于患者丙型肝炎基因型、治疗经历、肝纤维化程度、伴随药物等。肾功能不全患者利巴韦林的浓度显著增加,通过透析除去不显著,肌酐清除小于 50 ml/min,需要进行剂量调整,轻、中或重度肝功能障碍不显著影响血药浓度。
利巴韦林可能会导致潜在严重溶血性贫血,从而可能突发和导致恶化心脏病或心肌梗死,可引起致畸、影响胚胎、出生缺陷和胎儿死亡。常见不良反应包括疲劳、恶心、皮疹、瘙痒等。由于药物相互作用的不利影响,不应与去羟肌苷、azathiaprine 和 HIV 核苷类似物逆转录酶抑制剂同时使用[52-55]。
4.2 Peginterferon α-2a
PegIFN-α-2a 由干扰素 α-2a 共价连接到 40 kD 支链聚乙二醇组成,生物活性来自干扰素 α-2a 部分,其影响抗HCV 的适应性和先天性免疫反应,它结合并激活肝细胞上人 1 型干扰素受体,激活多个细胞内信号传导途径,最终导致产生抗病毒效应的干扰素刺激基因表达,如阻断病毒蛋白合成,引起病毒 RNA 诱变[56]。
PegIFN-α-2a(商品名 Pegasys)在美国由 Roche 集团Genentech 公司生产,2002 年 10 月FDA 批准,与利巴韦林组合治疗慢性丙型肝炎及 5 年以上代偿性肝病,包括HCV 和 HIV 共同感染;与利巴韦林和 NS3/4A 蛋白酶抑制剂组合治疗成年 HCV 基因 1 型感染。推荐剂量为180 μg,腹部或大腿皮下给药,每周 1 次。白细胞减少症、血小板减少症、肾功能不全、ALT 升高、抑郁症等情况,剂量可能需要调整。疗程取决于与其组合的药物、HCV 基因型、有无肝硬化、HIV 状态、既往治疗经验以及响应等。若患者治疗 12 周后没有表现出大于 2 log10的 HCV RNA下降,或 24 周后检测到 HCV RNA,应考虑停药。禁忌是自身免疫性肝炎,有肝硬化肝功能失代偿,以及对 α-干扰素过敏。
临床不良反应包括头痛、疲劳,流感样症状包括肌痛、发热、关节痛、恶心和食欲减退,以及白细胞和血小板减少,可能的眼科疾病以及失眠、抑郁症和烦躁等,可以导致或加重神经精神病学,自身免疫性、缺血性或传染性疾病,肝硬化患者可引起肝功能失代偿。主要药物相互作用包括P450 1A2 酶的抑制作用,茶碱 AUC 和美沙酮 AUC 抑制的增加等[52, 57-59]。
4.3 Peginterferon α-2b
PegIFN-α-2b 由干扰素 α-2b 共价连接到 12 kD 的线性聚乙二醇组成。PegIFN-α-2b(商品名 PegIntron),在美国由 Merck 的 Schering 公司制造,在 2001 年被批准用于有代偿性肝病的慢性丙型肝炎的治疗。此外,与利巴韦林和(或)一个 NS3/4A 蛋白酶抑制剂组合用于 HCV 基因1 型或其他基因型感染的治疗。成人推荐剂量 1.5 μg/kg,每周 1 次皮下给药,依患者状况剂量可能需要调整;与利巴韦林联合有或无 DAAs,治疗慢性肝炎,对各种 HCV 基因型有活性。疗程由多因素决定。
常见不良反应包括注射部位炎症(反应)以及与PegIFN-α-2a 类似的副作用;与通过 CYP2C8/9 代谢药物(如华法林)或 CYP2D6 代谢药物(如氟卡尼)同用应引起注意。同时用药可能会导致美沙酮的浓度增加[53, 58, 60]。
NS3/4A 蛋白酶抑制剂、NS5A 复制复合物抑制剂、NS5B 聚合酶抑制剂及其利巴韦林和 PegIFN 的不同适当组合为抗丙型肝炎的治疗提供了更有效的药物。此外,宿主靶向药物的研究有亲环素 B 抑制剂 alisporivir、SCY-635 和 NIM-811 等;MicroRNA 抑制剂的 miR-122 拮抗剂miravirsen 等[6]。PegIFN-λ 也用于 HCV 感染的临床研究[61]。
5 结语
众所周知,在过去数年间,慢性丙型肝炎的治疗是基于干扰素 α 和利巴韦林的使用,而抗丙型肝炎病毒药物研究主要包括干扰素、抗病毒药物、治疗疫苗和宿主靶向药物等,而 DAAs 药物是当前抗丙型肝炎药物研究的主流。2011年,靶点明确的小分子药物 telaprevir 和 boceprevir 与IFN-α 和利巴韦林联合被批准治疗 HCV 基因 1 型感染的患者。然而,治疗中不良反应和耐药问题频繁发生。到目前为止,有 14 个 DAAs 药物或药物组合用于慢性丙型肝炎的治疗,其中 12 个是在 2013 - 2016 年被批准用于临床的药物。包括 NS3/4A 蛋白酶抑制剂、(非)核苷类 NS5B聚合酶抑制剂和 NS5A 复制复合物抑制剂。药物或适当组合对不同 HCV 基因型感染的患者治疗有效。早期药物治疗 HCV 单一基因型感染,或需要与 PegIFN-α 和利巴韦林联合使用,目前第一个有 HCV 广谱基因型活性的sofosbuvir-velpatasvir,每日 1 次的单一片剂,治疗成人慢性丙型肝炎基因 1 ~ 6 型感染,也可以治疗失代偿期肝硬化患者,临床上有高 SVR 率。
总之,高效的抗 HCV 药物或药物组合,具有高耐药屏障使得治疗 HCV 感染变得容易。一些新的 HCV DAAs 和HTAs 以及其他药物已达到 II 期和 III 期临床阶段。这样的药物或药物组合的临床试验具有高 SVR 率、良好的安全性和有限的药物相互作用等优点。数十种正在进行研究的治疗 HCV 感染不同人群的方案表明,HCV 治疗的干扰素时代可能越来越接近结束,新的全口服无干扰素的抗 HCV 药物将被关注。
[1] Mohd Hanafiah K, Groeger J, Flaxman AD, et al. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence. Hepatology, 2013, 57(4):1333-1342.
[2] Smith DB, Bukh J, Kuiken C, et al. Expanded classification of hepatitis C virus into 7 genotypes and 67 subtypes: updated criteria and genotype assignment web resource. Hepatology, 2014, 59(1): 318-327.
[3] Moradpour D, Penin F, Rice CM. Replication of hepatitis C virus. Nat Rev Microbiol, 2007, 5(6):453-463.
[4] Bartenschlager R, Frese M, Pietschmann T. Novel insights into hepatitis C virus replication and persistence. Adv Virus Res, 2004, 63:71-180.
[5] De Clercq E. Current race in the development of DAAs (direct-acting antivirals) against HCV. Biochem Pharmacol, 2014, 89(4):441-452.
[6] Schaefer EA, Chung RT. Anti-hepatitis C virus drugs in development. Gastroenterology, 2012, 142(6):1340-1350.
[7] Buti M, Agarwal K, Horsmans Y, et al. Telaprevir twice daily is noninferior to telaprevir every 8 hours for patients with chronic hepatitis C. Gastroenterology, 2014, 146(3):744-753.
[8] Marcellin P, Forns X, Goeser T, et al. Telaprevir is effective given every 8 or 12 hours with ribavirin and peginterferon alfa-2a or -2b to patients with chronic hepatitis C. Gastroenterology, 2011, 140(2):459-468.
[9] Sarrazin C, Zeuzem S. Resistance to direct antiviral agents in patients with hepatitis C virus infection. Gastroenterology, 2010, 138(2):447-462.
[10] Kwo PY, Lawitz EJ, McCone J, et al. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, randomised, multicentre phase 2 trial. Lancet, 2010, 376(9742):705-716.
[11] Manns MP, McCone J Jr, Davis MN, et al. Overall safety profile of boceprevir plus peginterferon alfa-2b and ribavirin in patients with chronic hepatitis C genotype 1: a combined analysis of 3 phase 2/3 clinical trials. Liver Int, 2014, 34(5):707-719.
[12] Vermehren J, Susser S, Lange CM, et al. Mutations selected in the hepatitis C virus NS3 protease domain during sequential treatment with boceprevir with and without pegylated interferon alfa-2b. J Viral Hepat, 2012, 19(2):120-127.
[13] Manns M, Marcellin P, Poordad F, et al. Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection (QUEST-2): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet, 2014, 384(9941):414-426.
[14] Forns X, Lawitz E, Zeuzem S, et al. Simeprevir with peginterferon and ribavirin leads to high rates of SVR in patients with HCV genotype 1 who relapsed after previous therapy: a phase 3 trial. Gastroenterology, 2014, 146(7):1669-1679.
[15] Kiser JJ, Burton JR Jr, Everson GT. Drug-drug interactions during antiviral therapy for chronic hepatitis C. Nat Rev Gastroenterol Hepatol, 2013, 10(10):596-606.
[16] Jacobson IM, Dore GJ, Foster GR, et al. Simeprevir with pegylated interferon alfa 2a plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection (QUEST-1): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet, 2014, 384(9941):403-413.
[17] Wyles DL. Beyond telaprevir and boceprevir: resistance and new agents for hepatitis C virus infection. Top Antivir Med, 2012, 20(4):139-145.
[18] Hayashi N, Nakamuta M, Takehara T, et al. Vaniprevir plus peginterferon alfa-2b and ribavirin in treatment-naive Japanese patients with hepatitis C virus genotype 1 infection: a randomized phase III study. J Gastroenterol, 2016, 51(4):390-403.
[19] Liverton NJ, Carroll SS, Dimuzio J, et al. MK-7009, a potent and selective inhibitor of hepatitis C virus NS3/4A protease. Antimicrob Agents Chemother, 2010, 54(1):305-311.
[20] Kumada H, Suzuki Y, Ikeda K, et al. Daclatasvir plus asunaprevir for chronic HCV genotype 1b infection. Hepatology, 2014, 59(6):2083-2091.
[21] Manns M, Pol S, Jacobson IM, et al. All-oral daclatasvir plus asunaprevir for hepatitis C virus genotype 1b: a multinational, phase 3, multicohort study. Lancet, 2014, 384(9954):1597-1605.
[22] Kosaka K, Imamura M, Hayes CN, et al. Emergence of resistant variants detected by ultra-deep sequencing after asunaprevir and daclatasvir combination therapy in patients infected with hepatitis C virus genotype 1. J Viral Hepat, 2015, 22(2):158-165.
[23] McPhee F, Friborg J, Levine S, et al. Resistance analysis of the hepatitis C virus NS3 protease inhibitor asunaprevir. Antimicrob Agents Chemother, 2012, 56(7):3670-3681.
[24] Nelson DR, Cooper JN, Lalezari JP, et al. All-oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 phase III study. Hepatology, 2015, 61(4):1127-1135.
[25] Wang C, Sun JH, O’Boyle DR 2nd, et al. Persistence of resistant variants in hepatitis C virus-infected patients treated with the NS5A replication complex inhibitor daclatasvir. Antimicrob Agents Chemother, 2013, 57(5):2054-2065.
[26] Zeuzem S, Ghalib R, Reddy KR, et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic hepatitis C virus genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med, 2015, 163(1):1-13.
[27] Buti M, Gordon SC, Zuckerman E, et al. Grazoprevir, elbasvir, and ribavirin for chronic hepatitis C virus genotype 1 infection after failure of pegylated interferon and ribavirin with an earlier-generation protease inhibitor: final 24-week results from C-SALVAGE. Clin Infect Dis, 2016, 62(1):32-36.
[28] Rockstroh JK, Nelson M, Katlama C, et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE CO-INFECTION): a non-randomised, open-label trial. Lancet HIV, 2015, 2(8):e319-e327.
[29] Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment-naive and treatment- experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C-SURFER study): a combination phase 3 study. Lancet, 2015, 386(10003):1537-1545.
[30] Tong X, Kwong AD. Barrier to resistance: lessons from 2 direct-acting hepatitis C virus inhibitors, MK-5172 and Sofosbuvir. Clin Infect Dis, 2014, 59(12):1675-1677.
[31] Summa V, Ludmerer SW, McCauley JA, et al. MK-5172, a selective inhibitor of hepatitis C virus NS3/4a protease with broad activity across genotypes and resistant variants. Antimicrob Agents Chemother, 2012, 56(8):4161-4167.
[32] Afdhal N, Reddy KR, Nelson DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med, 2014, 370(16):1483-1493.
[33] Afdhal N, Zeuzem S, Kwo P, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N Engl J Med, 2014, 370(20): 1889-1898.
[34] Wong KA, Worth A, Martin R, et al. Characterization of Hepatitis C virus resistance from a multiple-dose clinical trial of the novel NS5A inhibitor GS-5885. Antimicrob Agents Chemother, 2013, 57(12):6333-6340.
[35] Osinusi A, Townsend K, Kohli A, et al. Virologic response followingcombined ledipasvir and sofosbuvir administration in patients with HCV genotype 1 and HIV co-infection. JAMA, 2015, 313(12):1232-1239.
[36] Hézode C, Asselah T, Reddy KR, et al. Ombitasvir plus paritaprevir plus ritonavir with or without ribavirin in treatment-naive and treatment-experienced patients with genotype 4 chronic hepatitis C virus infection (PEARL-I): a randomised, open-label trial. Lancet, 2015, 385(9986):2502-2509.
[37] Chayama K, Notsumata K, Kurosaki M, et al. Randomized trial of interferon- and ribavirin-free ombitasvir/paritaprevir/ritonavir in treatment-experienced hepatitis C virus-infected patients. Hepatology, 2015, 61(5):1523-1532.
[38] Poordad F, Hezode C, Trinh R, et al. ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med, 2014, 370(21):1973-1982.
[39] Feld JJ, Kowdley KV, Coakley E, et al. Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med, 2014, 370(17):1594-1603.
[40] Ferenci P, Bernstein D, Lalezari J, et al. ABT-450/r-ombitasvir and dasabuvir with or without ribavirin for HCV. N Engl J Med, 2014, 370(21):1983-1992.
[41] Zeuzem S, Jacobson IM, Baykai T, et al. Retreatment of HCV with ABT-450/r–ombitasvir and dasabuvir with ribavirin. N Engl J Med, 2014, 370(17):1604-1614.
[42] Kowdley KV, Lawitz E, Crespo I, et al. Sofosbuvir with pegylated interferon alfa-2a and ribavirin for treatment-naive patients with hepatitis C genotype-1 infection (ATOMIC): an open-label, randomised, multicentre phase 2 trial. Lancet, 2013, 381(9883):2100-2107.
[43] Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med, 2013, 368(20):1878-1887.
[44] Molina JM, Orkin C, Iser DM, et al. Sofosbuvir plus ribavirin for treatment of hepatitis C virus in patients co-infected with HIV (PHOTON-2): a multicentre, open-label, non-randomised, phase 3 study. Lancet, 2015, 385(9973):1098-1106.
[45] Svarovskaia ES, Dvory-Sobol H, Parkin N, et al. Infrequent development of resistance in genotype 1-6 hepatitis C virus-infected subjects treated with sofosbuvir in phase 2 and 3 clinical trials. Clin Infect Dis, 2014, 59(12):1666-1674.
[46] Feld JJ, Jacobson IM, Hézode C, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med, 2015, 373(27):2599-2607.
[47] Everson GT, Towner WJ, Davis MN, et al. Sofosbuvir with velpatasvir in treatment-naive noncirrhotic patients with genotype 1 to 6 hepatitis C virus infection: a randomized trial. Ann Intern Med, 2015, 163(11):818-826.
[48] Curry MP, O'Leary JG, Bzowej N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med, 2015, 373(27):2618-2628.
[49] Lawitz EJ, Dvory-Sobol H, Doehle B, et al. Clinical resistance to velpatasvir (GS-5816), a novel pan-genotypic inhibitor of the hepatitis C virus NS5A protein. Antimicrob Agents Chemother, 2016, 60(9):5368-5378.
[50] Mogalian E, German P, Kearney BP, et al. Use of multiple probes to assess transporter- and cytochrome P450-mediated drug-drug interaction potential of the pangenotypic HCV NS5A inhibitor velpatasvir. Clin Pharmacokinet, 2016, 55(5):605-613.
[51] Lau JY, Tam RC, Liang TJ, et al. Mechanism of action of ribavirin in the combination treatment of chronic HCV infection. Hepatology, 2002, 35(5):1002-1009.
[52] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med, 2002, 347(13):975-982.
[53] Jacobson IM, Brown RS Jr, Freilich B, et al. Peginterferon alfa-2b and weight-based or flat-dose ribavirin in chronic hepatitis C patients: a randomized trial. Hepatology, 2007, 46(4):971-981.
[54] McHutchison JG, Gordon SC, Schiff ER, et al. Interferon alfa-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group. N Engl J Med, 1998, 339(21):1485-1492.
[55] Hadziyannis SJ, Sette H Jr, Morgan TR, et al. Peginterferon-alfa2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med, 2004, 140(5):346-355.
[56] Hoofnagle JH, Seelf LB. Peginterferon and ribavirin for chronic hepatitis C. N Engl J Med, 2006, 355(23):2444-2451.
[57] Zeuzem S, Feinman SV, Rasenack J, et al. Peginterferon alfa-2a in patients with chronic hepatitis C. N Engl J Med, 2000, 343(23):1666-1672.
[58] McHutchison JG, Lawitz EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection. N Engl J Med, 2009, 361(6):580-593.
[59] Ascione A, De Luca M, Tartaglione MT, et al. Peginterferon alfa-2a plus ribavirin is more effective than peginterferon alfa-2b plus ribavirin for treating chronic hepatitis C virus infection. Gastroenterology, 2010, 138(1):116-122.
[60] Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet, 2001, 358(9286):958-965.
[61] Muir AJ, Arora S, Everson G, et al. A randomized phase 2b study of peginterferon lambda-1a for the treatment of chronic HCV infection. J Hepatol, 2014, 61(6):1238-1246.
10.3969/cmba.j.issn.1673-713X.2017.01.011
国家自然科学基金(81273439)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所有机化学室
李卓荣,Email:l-z-r@263.net;仲兆金,Email:zhongzhaojin@sina.com
2016-10-19
