抗VEGF单克隆抗体生物学活性分析方法的建立及其应用
2017-02-16莫琳周冬梅徐军孙文正杨彬
莫琳,周冬梅,徐军,孙文正,杨彬
抗VEGF单克隆抗体生物学活性分析方法的建立及其应用
莫琳,周冬梅,徐军,孙文正,杨彬
目的建立抗 VEGF 单克隆抗体生物学活性分析方法,并对实验条件进行优化及方法学验证。
方法从新生儿脐带分离获取人脐静脉内皮细胞(HUVEC),使用第 4 ~ 6 代细胞进行活性检测。HUVEC接种 96 孔板于 CO2培养箱培养 4 h 后加入不同浓度的抗 VEGF 单克隆抗体——VEGF165混合物孵育 48 h,加入CCK8 显色 4 h,酶标仪读取各孔 OD450吸光值,采用四参数拟合绘制标准曲线,计算参比品和样品的 IC50值,获取样品的相对活性。
结果该方法专属性强,仅在抗 VEGF 单克隆抗体上呈现相应的剂量关系曲线,标准曲线拟合度 r2> 0.99,精密度样品相对活性 RSD < 20%,方法在 50% ~ 200% 活性范围内具有良好的准确性。用该方法对两个候选药分别进行 6 次重复性检测,候选药相对活性值分别为(95.80 ± 3.29)%,(101.10 ± 3.81)%。
结论本研究建立的 HUVEC 增殖抑制法特异性高、重复性好,并具有良好的准确性及精密度,可用于抗 VEGF 单克隆抗体生物学活性的评估。
人脐静脉内皮细胞; 血管内皮生长因子类;抗 VEGF 单克隆抗体
肿瘤新生血管的生成是肿瘤与其周围环境中血管生长因子相互作用的结果[1],如果没有新生血管的生成,原发肿瘤生长不超过 2 mm,肿瘤转移将无法实现[2]。血管生成被认为是癌症的十大特征之一[3]。许多因素参与血管的生成与发展,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成的重要调控因子,其在肿瘤组织中高水平表达。原位杂交研究表明,多种人实体肿瘤中均存在 VEGF mRNA 的表达[4]。VEGF 因子能促进内皮细胞分裂、增殖、迁移和血管构建,增加血管通透性,是目前发现功能最强、特异性最高的血管内皮生长因子[5-6]。因此,阻断 VEGF 的作用已成为肿瘤治疗的研究热点。人源化抗 VEGF单克隆抗体贝伐珠单抗由美国 Genentech 公司研发生产,已经被批准用于结直肠癌、非小细胞肺癌、多形性成胶质细胞瘤的治疗[7-9]。随着贝伐珠单抗专利期的临近,而临床需求仍在不断提高,全球范围内掀起一股贝伐珠单抗生物类似药研发的热潮。在单抗生物类似药的研发生产中,候选药与原研药的相似性评价是评估单抗生物类似药质量、有效性、安全性的重要标准。生物学活性是生物类似药的关键质量属性之一,应建立稳定可靠的生物学活性检测方法对生物类似药进行质量控制。
抗 VEGF 单克隆抗体通过中和 VEGF 因子阻断其与内皮细胞表面 VEGF 受体结合,从而抑制内皮细胞的增殖与迁移。本文利用抗 VEGF 单克隆抗体中和 VEGF 因子从而抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖的原理,建立抗 VEGF 单克隆抗体生物学活性检测方法,并验证了方法的重复性、精密度、准确性、专属性等,用该方法对两个候选药的生物学活性分别进行了 6 次重复性检测,进一步验证了该方法的精密性及准确性,为抗 VEGF单克隆抗体生物学活性评估提供了稳定、可靠的检测方法。
1 材料与方法
1.1 材料
新生胎儿脐带由东莞市长安镇港湾医院提供;M199 培养基、VEGF165因子购自美国 Gibco 公司;ECGS 因子、肝素钠、I 型胶原酶购自美国Sigma公司;CCK8 溶液购自日本同仁公司;青霉素-链霉素溶液、胎牛血清、胰酶、PBS 溶液购自美国 Hyclone 公司;原研药参比品与候选药由广东东阳光药业药物研究院提供;倒置荧光显微镜购自日本 Olympus 公司;MD/M2e 多功能酶标仪为美国分子仪器公司产品。
1.2 方法
1.2.1 HUVEC 细胞培养 新生胎儿脐带用 I 型胶原酶消化,以培养液 A(M199 + 20% FBS + 30 μg/ml ECGS + 100 ng/ml 肝素钠 + 1% 双抗溶液)于二氧化碳培养箱培养获得第 1 代 HUVEC细胞,待细胞汇合度达 100% 后用胰酶消化,以1∶3 比例传代,选用第 4 ~ 6 代细胞进行实验。
1.2.2 HUVEC 增殖抑制法标准曲线绘制 细胞生长至对数生长期,用 0.25% 胰酶,0.02% EDTA消化后加入培养液 B(M199 + 20% FBS)重悬细胞,离心弃上清。使用培养液 C(M199 + 2% FBS + 90 ng/ml 肝素钠)重悬细胞并计数,再将细胞接种96 孔板(1 × 104个细胞/孔),孵育 4 h。抗 VEGF单克隆抗体用培养液 C 稀释至 5 μg/ml 作为最高作用浓度点,于另一 96 孔板将其 2 倍梯度稀释获得 10 个抗体系列作用浓度点,并与等体积的62.5 ng/ml VEGF165溶液混合,200 r/min 振荡混匀10 s,于 37 ℃ 孵育 3 h 后将其以 100 μl/孔加入接种了 HUVEC 细胞的 96 孔板,细胞置于 CO2培养箱中孵育 48 h,加入 CCK8 溶液 20 μl/孔显色 4 h,显色结束后于酶标仪读取各孔 OD450值。
1.2.3 数据分析 利用 Softmax 软件分析实验数据,以抗体浓度为横坐标,对应的吸光值为纵坐标,进行四参数拟合,绘制抗体-剂量反应曲线,样品相对活性按以下公式进行计算:

1.2.4 实验条件的优化 VEGF165作用浓度的确定:VEGF165以 500 ng/ml 作为最高作用浓度点,2 倍梯度稀释至 0.488 ng/ml 进行检测;抗体浓度范围:分别将抗 VEGF 单抗进行 1∶2 倍(最高作用浓度 5000 ng/ml)、1∶3 倍(最高作用浓度 25 000 ng/ml)、1∶4 倍梯度稀释(最高作用浓度50 000 ng/ml),各稀释 10 个作用浓度点进行检测;细胞接种密度:分别以 5000、10 000、12 000 个细胞/孔接种 96 孔板进行检测;孵育时间的选择:分别将抗体-VEGF165混合液孵育时间设定为 48、72 h 后进行检测。
1.2.5 方法学验证
1.2.5.1 专属性 将抗 TNF-a 单抗(5 μg/ml)、培养液 C、空辅(培养液 C 稀释 10倍)、65 ℃ 加热 90 min 的抗 VEGF 单抗(5 μg/ml),于 96 孔板 2 倍梯度稀释获取 10 个系列作用浓度点代替抗-VEGF 单抗系列作用浓度点进行检测。
1.2.5.2 重复性及中间精密度 由 2 名不同实验人员各自平行配制 6 份 5 μg/ml 抗 VEGF 单抗溶液,于不同的时间,使用不同脐带提取的、不同代次的 HUVEC 细胞进行检测。
1.2.5.3 准确度 视 5 μg/ml 抗 VEGF 单抗溶液为 100% 线性浓度点,平行配制 200%、150%、100%、75%、50% 线性溶液各 3 份进行检测,按公式:回收率(%)= 相对活性值/理论活性值 × 100%,计算各线性点回收率。
1.2.6 候选药相对活性检测 以原研药为参比品,运用建立的 HUVEC 增殖抑制法在不同的时间测定两个候选药的相对生物学活性。
2 结果
2.1 HUVEC 增殖抑制法标准曲线绘制
采用 Softmax 软件分析数据,以抗 VEGF 单抗浓度为横坐标、对应的吸光值为纵坐标进行四参数拟合,标准曲线呈现典型的 S 型,信噪比为 2.3,r2> 0.99(图 1)。
2.2 实验条件的优化
2.2.1 VEGF 作用浓度的选择 将 VEGF165稀释至 500 ng/ml 作为最高作用浓度点,2 倍梯度稀释至 0.488 ng/ml(共计 11 个浓度点)进行检测,获取 VEGF165促 HUVEC 增殖剂量关系曲线,结果见图 2。当 VEGF165浓度在500 ~ 31.25 ng/ml时曲线达到高点平台期。因此,将 VEGF165的作用浓度选定为 62.5 ng/ml。
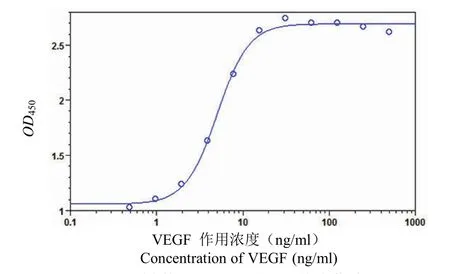
图 2 VEGF 因子刺激 HUVEC 细胞增殖曲线Figure 2 Dose-response curve of VEGF promote HUVEC proliferation assay
2.2.2 抗 VEGF 单抗作用浓度范围的选择 分别将抗 VEGF单抗进行 1∶2 倍、1∶3 倍、1∶4 倍梯度稀释,各设计 10 个作用浓度点进行检测,结果见图 3,其中抗 VEGF 抗体以 5000 ng/ml 为最高作用浓度进行 2 倍梯度稀释,曲线最为理想。
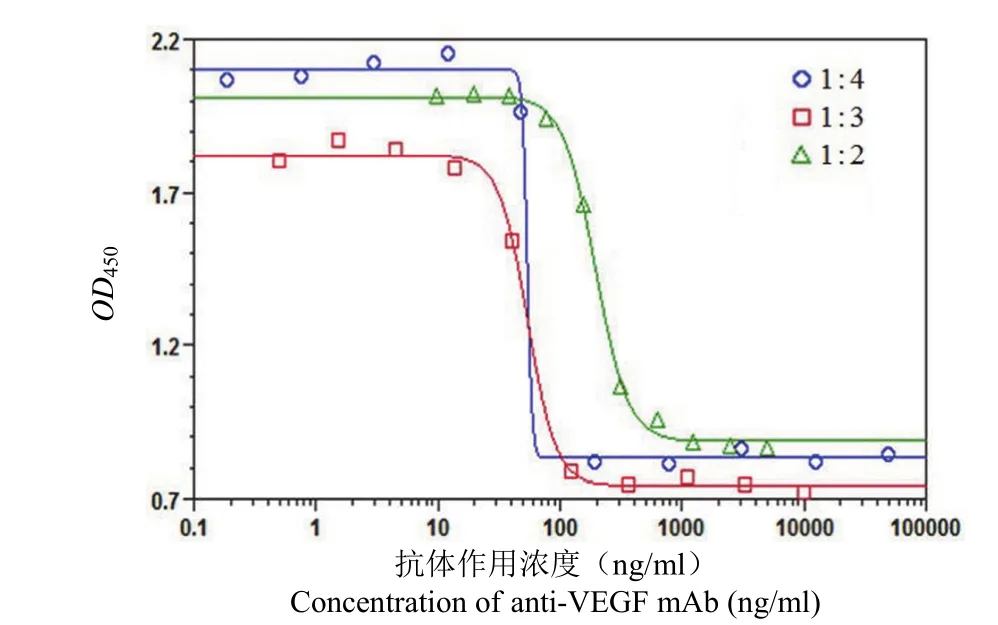
图 3 不同浓度抗 VEGF 单克隆抗体抑制 HUVEC 细胞增殖曲线Figure 3 Assay dose-response curves using three different serial dilutions of anti-VEGF mAb
2.2.3 细胞接种密度的选择 将 HUVEC 细胞分别以 5000、10 000、12 000 个/孔接种 96 孔板进行检测,结果如图 4。其中当细胞接种密度为10 000 个/孔时曲线窗口差值、信噪比、抗体作用浓度点的分布最为理想。
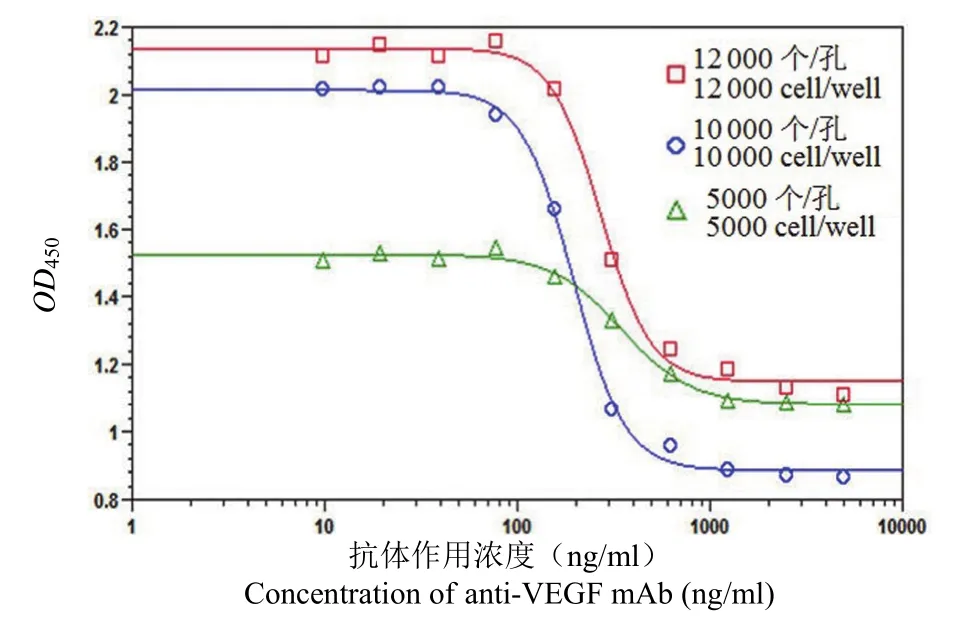
图 4 不同细胞接种密度 HUVEC 细胞增殖抑制法曲线Figure 4 Assay dose-response curves using different cell densities of HUVEC
2.2.4 抗体-VEGF165溶液孵育时间的选择 分别将抗体-VEGF165溶液孵育 HUVEC 细胞 48 及72 h(图 5)。当孵育时间为 72 h 时,仅有两个抗体浓度点落于高点平台期,为确保实验方法的稳定性及工作效率,将抗体-VEGF165溶液孵育时间确定为 48 h。
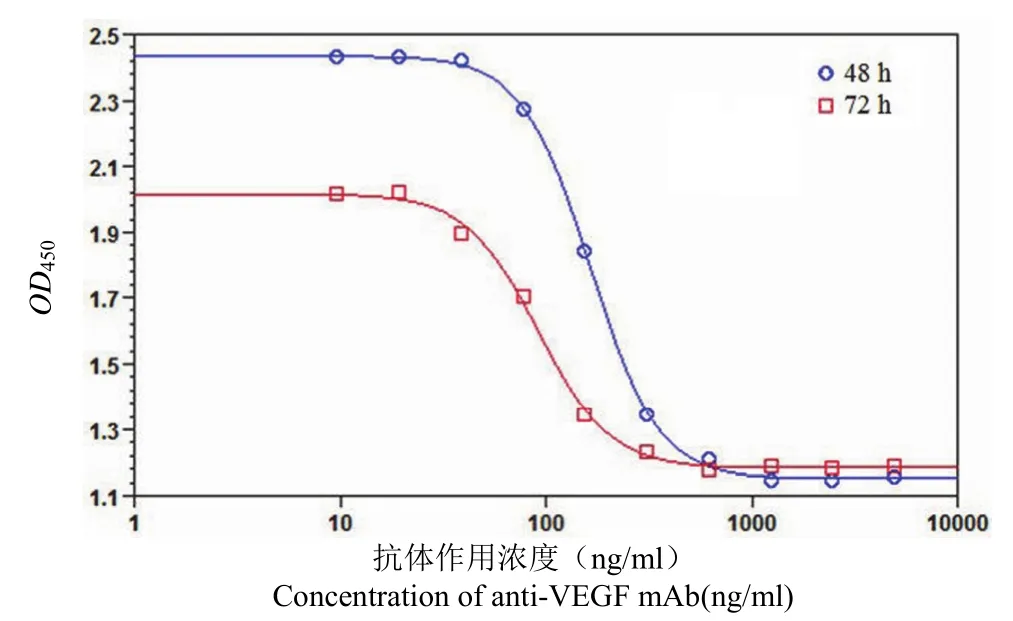
图 5 抗体-VEGF165溶液不同孵育时间 HUVEC 增殖抑制法曲线Figure 5 Dose-response curve of anti-VEGF mAb against HUVEC proliferation assay with different incubation time
2.3 方法学验证
2.3.1 专属性 本研究中共设计 4 组专属性溶液:抗 TNF-a 单抗、培养液 C、空辅及 65 ℃ 加热90 min 的抗 VEGF 单抗溶液。其中仅在抗 VEGF单抗溶液中呈现剂量关系曲线,结果见图 6。
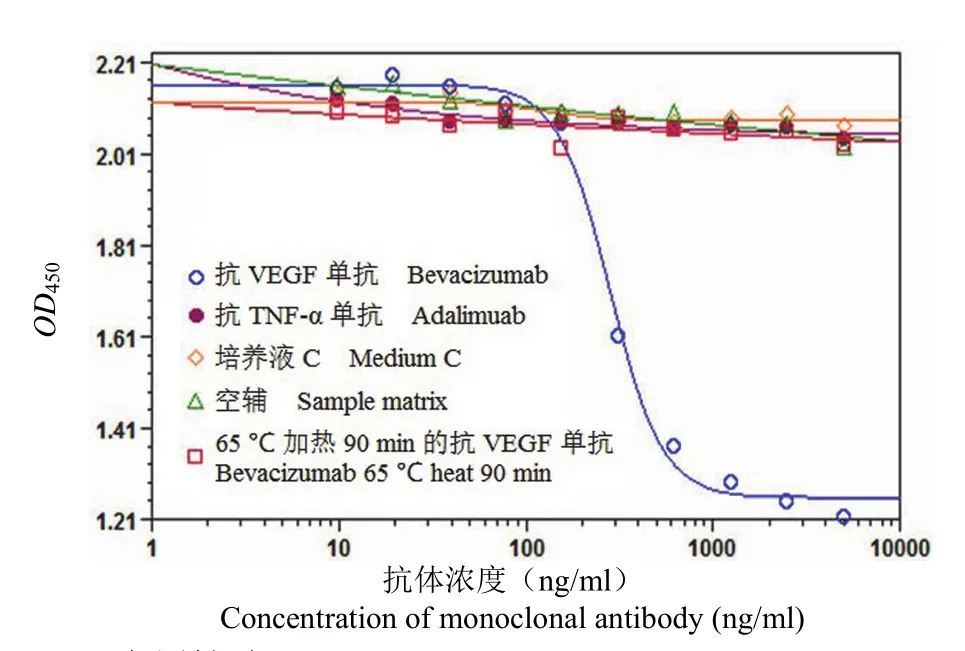
图 6 专属性验证Figure 6 Assay dose response curve using different mAb samples
2.3.2 重复性及精密度 由两位实验人员各自独立配制 6 份 5 μg/ml 抗 VEGF 单抗溶液,于不同日期,选用不同脐带提取的、不同代次的 HUVEC细胞进行检测,结果见表 1。不同试验人员配制的抗 VEGF 单抗溶液相对活性平均值分别为:(102.70 ± 5.30)%、(103.50 ± 3.73)%,两人测得的共 12 份溶液相对活性平均值为(103.10 ± 4.24)%。
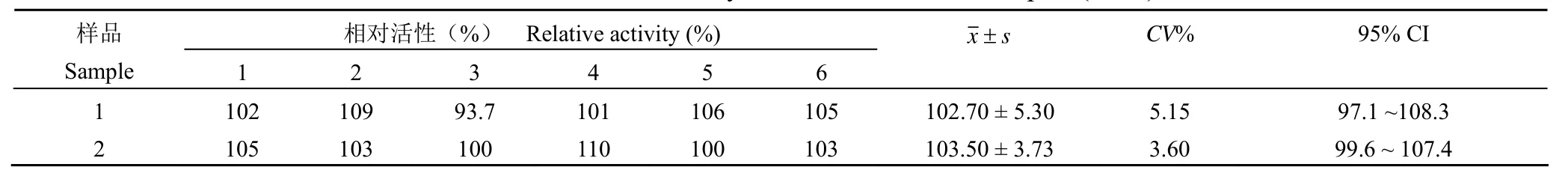
表 1 重复性验证(n = 6)Table 1 Relative bioactivity of two bevacizumab samples (n = 6)
2.3.3 准确度及线性范围 平行配制 50%、75%、100%、150%、200% 的线性点溶液各 3 份进行检测,检测结果见表 2。5 组线性溶液相对活性平均值分别为:(52.53 ± 3.05)%、(80.17 ± 2.25)%、(103.00 ± 2.52)%、(164.00 ± 3.05)%、(225.00 ± 11.8)%。
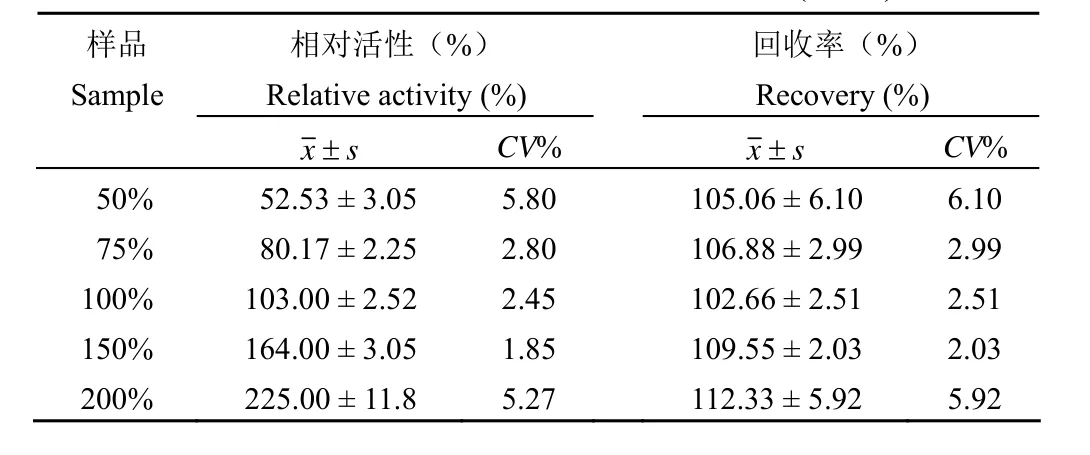
表 2 不同线性点溶液相对活性检测结果及回收率实验(n = 3)Table 2 Relative activity and recovery of anti-VEGF mAb against HUVEC proliferation assay using different concentrations of bevacizumab (n = 3)
2.4 候选药相对生物学活性检测
以原研药为参比品,在不同的时间,复苏不同脐带提取的 HUVEC 细胞分别传代至第 4 ~ 6 代用于测定两个候选药的相对生物学活性,分别进行6 次检测,结果见表 3。1 号候选药测定结果平均值为(95.80 ± 3.29)%,CV% = 3.42;2 号候选药测定结果平均值为(101.10 ± 3.81)%,CV% = 3.80;两个候选药独立进行的 6 次相对活性检测结果高度一致。
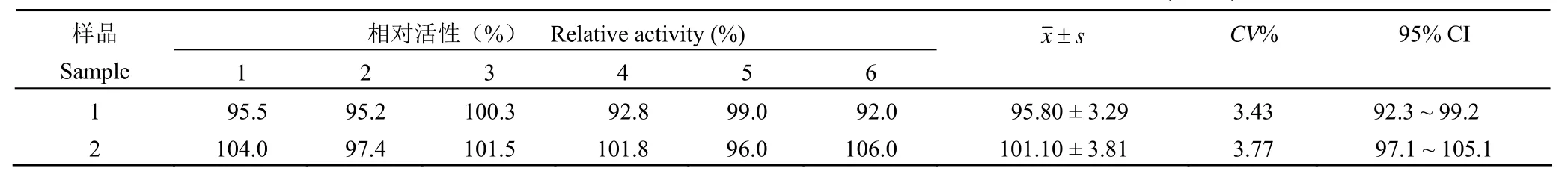
表 3 两株候选药相对活性检测结果(n = 6)Table 3 Relative activities of two biosimilar candidates of bevacizumab (n = 6)
3 讨论
伴随着抗体类生物类似药研发的热潮,如何进行单抗类生物类似药质量的评估、确保药物的安全性及有效性是生物类似药研发的重要任务之一。生物学活性是生物类似药质量研究最为关键的属性之一,其受药物作用机制、检测用细胞、试剂批次差异、实验人员操作误差等方面的影响,使得分析方法的建立存在一定的挑战。
抗 VEGF 单克隆抗体体外生物学活性模型包括:抑制 VEGF 诱导 HUVEC 细胞增殖、迁移、NO 的产生、渗透率及钙离子浓度的变化等[10-11]。其中 HUVEC 增殖抑制法作为检测抗 VEGF 单抗生物学活性的经典检测方法,其能最大程度模拟抗 VEGF 单克隆抗体在体内抑制新生血管生成的过程[12],因此被广泛用于进行抗 VEGF 单克隆抗体生物学活性的检测。
本文中用 I 型胶原酶从新生儿脐带分离获取原代 HUVEC 细胞,使用原代HUVEC 细胞专用培养基 M199 进行细胞培养,获得了性质均一、稳定性好的原代 HUVEC 细胞[13]用于分析方法的建立。通过条件摸索确定 VEGF165作用浓度为62.5 ng/ml,选择 5 μg/ml 抗 VEGF 单抗作为最高作用浓度点,2 倍梯度稀释方式,孵育时间为 48 h,可呈现典型的 S 型抗体-剂量曲线。经验证表明,建立的 HUVEC 增殖抑制法特异性高、重复性好且具有良好的精密度及准确性,不同新生儿脐带提取的 HUVEC 细胞于同一样品的检测上,检测结果稳定。方法运用于 2 个候选药的 6 次重复性检测,相对活性高度一致。
本研究建立的抗 VEGF 抗体生物学活性检测方法,稳定性高、变异系数小,为抗 VEGF 单克隆抗体生物学活性评价建立了稳定可靠的检测方法。
[1] Greillier L, Tomasini P, Barlesi F. Bevacizumab in the treatment of nonsquamous non-small cell lung cancer: clinical trial evidence and experience. Ther Adv Respir Dis, 2016, 10(5):485-491.
[2] Folkman J, Shing Y. Angiogenesis. J Biol Chem, 1992, 267(16): 10931-10934.
[3] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5):646-674.
[4] Ferrara N, Hillan KJ, Gerber HP, et al. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat Rev Drug Discov, 2004, 3(5):391-400.
[5] Cross MJ, Claesson-Welsh L. FGF and VEGF function in angiogenesis: signalling pathways, biological responses and therapeutic inhibition. Trends Pharmacol Sci, 2001, 22(4):201-207.
[6] Terman BI, Stoletov KV. VEGF and tumor angiogenesis. Einstein Quart J Biol Med, 2001, 18:59-66.
[7] Grothey A, Galanis E. Targeting angiogenesis: progress with anti-VEGF treatment with large molecules. Nat Rev Clin Oncol, 2009, 6(9):507-518.
[8] Kerr DJ. Targeting angiogenesis in cancer: clinical development of bevacizumab. Nat Clin Pract Oncol, 2004, 1(1):39-43.
[9] Papadopoulos N, Martin J, Ruan Q, et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis, 2012, 15(2):171-185.
[10] Wang Y, Fei D, Vanderlaan M, et al. Biological activity of bevacizumab, a humanized anti-VEGF antibody in vitro. Angiogenesis, 2004, 7(4):335-345.
[11] Dawson NS, Zawieja DC, Wu MH, et al. Signaling pathways mediating VEGF165-induced calcium transients and membrane depolarization in human endothelial cells. FASEB J, 2006, 20(7):991-993.
[12] Zhang F, Xu GL, Yu CF, et al. Optimization and application of HUVEC proliferation inhibitory assay. Chin J New Drugs, 2015, 24(20):2317-2323. (in Chinese)张峰, 徐刚领, 于传飞, 等. 人脐静脉内皮细胞增殖抑制法检测贝伐珠单抗活性的优化和应用. 中国新药杂志, 2015, 24(20):2317-2323.
[13] Sun HL, Zhan Y, Liu ZZ, et al. A detailed protocol to cultivate and identify human umbilical endothelial cells. Guangdong Med J, 2012, 33(6):744-746. (in Chinese)孙慧琳, 湛奕, 刘珍珍, 等. 人脐静脉内皮细胞的原代培养及鉴定.广东医学, 2012, 33(6):744-746.
Development, optimization, and application of a cell-based assay for bioactivity determination of anti-VEGF monoclonal antibody
MO Lin, ZHOU Dong-mei, XU Jun, SUN Wen-zheng, YANG Bin
ObjectiveTo development, optimize a cell-base assay for bioactivity determination of anti-VEGF monoclonal antibody (mAb) and to utilize the mAbs to inhibit VEGF induced proliferation of human umbilical vein endothelial cells (HUVEC).MethodsFresh HUVEC from human umbilical cords were cultured up to the fourth generation but no more than sixth generation should be used. HUVEC were seeded into each well of a 96-well plate. The plate were incubated for 4 h at 37 ℃ and 5% CO2and then HUVEC were treated with anti-VEGF antibodies containing solution for 48 h. CCK8 were added to each well for another 4 h at 37 ℃ and 5% CO2. The cellular response was recorded at a 450 nm absorbance using the SpectraMax M2e. The EC50values of the control and samples were obtained by using four parameters curve and then the bioactivity of samples were calculated.ResultsThis assay possessed excellent specificity. Only anti-VEGF antibody showed a typical dose-response curve with more than 0.99 of a standard curve fit of r2value and less than 20% of a RSD for the precision validation. This assay also presented a good accuracy within the activity range of 50% - 200%. This assay was used to conduct 6 measure each for two different samples containing active anti-VEGF mAbs using a commercial anti-VEGF mAb as the control. A mean relative activity of (95.80 ± 3.29)% and (101.10 ± 3.81)% was obtained for these two samples respectively.ConclusionWe have successfully developed, optimized, and applied the HUVEC proliferation inhibitory assay for bioactivity determination of anti-VEGF mAbs with excellent specificity, reproducibility and accuracy.
Human umbilical vein endothelial cells; Vascular endothelial growth factors; Anti-VEGF monoclonal antibodies
YANG Bin, Email: YangBin@hecpharm.com
10.3969/cmba.j.issn.1673-713X.2017.01.005
Chin Med Biotechnol, 2017, 12(1):24-28
广东省引进创新科研团队计划(201101Y0104990178)
523867 东莞,广东东阳光药业有限公司
杨彬,Email:YangBin@hecpharm.com
2016-12-08
www.cmbp.net.cn 中国医药生物技术, 2017, 12(1):24-28
Author Affiliation:Sunshine Lake Pharma Co. Ltd., Dongguan 523867, China
www.cmbp.net.cn
