木霉属真菌拮抗金钗石斛病原菌的研究
2017-02-16邢咏梅李向东李莉郭顺星
邢咏梅,李向东,李莉,郭顺星
木霉属真菌拮抗金钗石斛病原菌的研究
邢咏梅,李向东,李莉,郭顺星
目的考察石斛属药用植物内生真菌拮抗软腐病的真菌。
方法将 179 株内生真菌进行金钗石斛软腐病生物防治盆栽试验,以获得拮抗病原菌终极腐霉的内生真菌。将具有拮抗效果的真菌在 PDA 培养基中与终极腐霉进行双重培养平皿对峙试验并对其显微形态进行观察,利用 3,5-二硝基水杨酸法检测真菌的 β-1,3 和 β-1,4 葡聚糖酶活性。
结果T. koningiopsis 与 T. rogersonii 在盆栽试验和双重培养平皿对峙试验中对终极腐霉具有抑制作用。T. koningiopsis 与 T. rogersonii 菌丝将终极腐霉菌丝包围并将其破坏;两者 β-1,3 和 β-1,4 葡聚糖酶活性在所测试的 5 种真菌中最高。
结论T. koningiopsis 与 T. rogersonii 可有效抑制终极腐霉;由两者分泌的 β-1,3 和 β-1,4 葡聚糖酶可能在破坏终极腐霉细胞壁方面发挥作用。T. koningiopsis 和 T. rogersonii可作为潜在的生防菌发挥拮抗终极腐霉作用。
石斛; 腐霉菌属; T. rogersonii; T. koningiopsis
终极腐霉是农作物和经济作物的重要致病卵菌[1],对不同植物造成立枯病、软腐病和茎腐病等疾病。终极腐霉导致的软腐病在石斛发病情况已有报道[2];而终极腐霉感染铁皮石斛可能与病原菌直接穿透宿主植物细胞壁并分泌细胞壁降解酶类密切相关,从而导致宿主细胞壁逐步被降解[3-4]。
金钗石斛,一种附生型兰科药用植物,为著名观赏花卉。它含有石斛碱、石斛酚等生物活性成分[5]。金钗石斛与铁皮石斛共同被列入中华人民共和国药典。目前,由于过度采挖以及缺乏有效的保护,导致金钗石斛处于濒危状态。而大规模的人工栽培又因其潮湿的生长环境,不可避免受到病原性卵菌(终极腐霉)的侵害。受到侵害后的植株叶片出现向叶柄弯曲,发病植株出现倒伏、死亡。
目前,化学杀菌剂对抗植物病原菌的应用,一方面使环境受到污染,另一方面又对人类的健康造成威胁。因此,植物病原菌的生物防治越来越受到人们关注。内生真菌广泛存在于植物中,它们在赋予宿主植物抵御病原菌、昆虫和食草动物方面发挥了重要作用[6]。木霉属真菌已被报道用于 Pythium spp. 以及 Fusarium spp. 的生物防治[7]。然而,木霉属真菌拮抗植物病原菌的机制尚不清楚,可能与其分泌细胞外水解酶或抗生素样物质有关[8]。
在以往的研究中,我们从铁皮石斛、金钗石斛、齿瓣石斛以及球花石斛等石斛属药用植物中分离得到 179 株内生真菌,并对这些内生真菌是否具有拮抗终极腐霉的活性进行筛选。发现在铁皮石斛的盆栽试验中,T. rogersonii 和 T. koningiopsis 具有拮抗终极腐霉的活性[2, 9]。然而,内生真菌对感染终极腐霉的金钗石斛是否具有拮抗作用目前报道较少。因此,本研究从 179 株内生真菌中对感染了终极腐霉的金钗石斛进行了病原菌生物防治的筛选。将在盆栽试验中对终极腐霉具有良好拮抗活性的真菌分别与终极腐霉进行共同培养,并观察两者相互作用的形态学变化;同时利用 3,5-二硝基水杨酸(DNS)方法对 5 种真菌细胞外 β-1,3 葡聚糖酶以及 β-1,4 葡聚糖酶的活性进行检测,旨在为珍稀濒危药用植物金钗石斛资源的保护以及软腐病的生物防治提供重要依据。
1 材料与方法
1.1 材料
1.1.1 植物及真菌材料 本研究所用终极腐霉是分离自云南省西双版纳地区石斛栽培基地中的感染软腐病的金钗石斛栽培苗[2],病原菌 GenBank注册号为:KP676026[3]。金钗石斛组培苗为本实验室保存。179 种内生真菌分别分离自石斛属药用植物根、茎、叶、花、种子等部位,保存于中国医学科学院药用植物研究所真菌室。
1.1.2 主要仪器 Axio Imager A1 型光学显微镜购自德国蔡司公司;SP-752 紫外可见光分光光度计购自上海光谱仪器有限公司。
1.2 方法
1.2.1 终极腐霉与内生真菌的培养 终极腐霉与179 株内生真菌于 PDA 培养基中培养 7 d。内生真菌从 PDA 培养基中转接至麦麸锯末固体培养基(锯末与麦麸各 500 g,加 1 L 水混匀),将每100 g 混匀后的基质装入圆柱形的玻璃瓶中,122 ℃高压灭菌 120 min。每种内生真菌直径为 8 mm 的生长旺盛的三片菌片转接入上述培养基中,黑暗条件下培养 3 周。
1.2.2 179 株内生真菌在金钗石斛栽培试验中与终极腐霉的拮抗活性筛选 首先将栗树皮切成直径约为 1 cm 的小块,浸入水中 6 h,然后装入直径 8 cm,高 14 cm 玻璃瓶中,每瓶装 2/3 体积,约 180 g,并加入 100 ml 自来水,122 ℃ 高压灭菌 180 min。选用口径为 10 cm,高度为 8 cm 的塑料花盆,以栗树皮作为栽培基质,预先准备好无菌培养的金钗石斛组培苗,将株高均匀一致的组培苗自光培养室取出,于自然光照与温度下不解开封口膜炼苗 2 周,以提高小苗适应性。炼苗后在自然条件下揭开封口膜,用镊子自瓶中轻取出组培苗(注意不要损伤根部),流水冲净附着在根部的培养基, 挑选叶片数在 5 ~ 7 片,株高 4 ~ 6 cm 的组培苗。
栽培时先用高压灭菌的栗树皮铺满塑料花盆的二分之一,实验组在基质的中央加入 1 g 内生真菌麦麸锯末固体接种剂,把 4 株组培苗栽到接种剂上,填满树皮完成栽培工作。盆栽苗放入可控日光温室中,温度维持在(20 ± 2)℃,湿度维持在75% ~ 90% 之间。栽种后喷水 1 次,以利于内生真菌的生长,3 d 后在组培苗的周围放入直径 1 cm病原菌 PDA 菌片 2 片,栽种后喷水 1 次,浇水,以后每 3 天喷水 1 次。以组培苗栽种 3 d 后只接直径 1 cm 病原菌 PDA 菌片 2 片作为阳性对照,只接无菌麦麸锯末固体培养基,正常生长的组培苗作为阴性对照。试验重复 3 次,每种处理做 5 个重复,定期观察金钗石斛的生长情况。
1.2.3 β-1,3 葡聚糖酶活性测定 将具有拮抗作用的真菌及同属不同种的其他真菌共 5 种在PDA 培养基中与终极腐霉进行双重培养平皿对峙试验,并检测这 5 种真菌的 β-1,3 和 β-1,4 葡聚糖酶活性。将每种真菌的 3 片菌片(直径为 8 mm)装入 200 ml 马铃薯土豆液体培养基(葡萄糖20 g/L,土豆浸出液 200 g/L)的 500 ml 三角烧瓶中,25 ℃ 黑暗条件下,120 r/min 振荡培养 7 d。培养物以滤纸过滤后,4 ℃、10 000 r/min 离心 10 min,得到的上清液即为无细胞培养滤液。随后将得到的无细胞培养滤液以 0.45 μm 滤器过滤,所得滤液做酶活性测定。
将海带多糖溶解于 50 mmol/L 磷酸缓冲液(pH 7.0)中,将 1 ml 0.2% 海带多糖(w/v)加入至 50 mmol/L 醋酸钠缓冲液(pH 7.0)中与 1 ml酶溶液在 50 ℃ 孵育 15 min[10]。将 250 μl 海带多糖加入至 EP 管中,然后加入 250 μl 5 种真菌的培养滤液,反应 15 min 后,溶液转移到比色杯,加入 2 ml DNS 溶液,加入去离子水,将体积补充至 5 ml,混合溶液煮沸 3 min,在 520 nm 波长测定吸光度。反应初的吸光度值设为对照,试验重复3 次,每个处理设 10 个重复。酶活力单位定义为:在上述反应条件下,每分钟水解 β-1,3 葡聚糖释放出 1 μmol 葡萄糖所需要的酶量,即为一个酶活力单位,以 U/ml 表示。
1.2.4 β-1,4葡聚糖酶活性测定 纤维素溶解于50 mmol/L 磷酸缓冲液(pH 7.0)中,检测方法与β-1,3 葡聚糖酶活性测定方法大致相同。不同之处是反应时间为 60 min。试验重复 3 次,每组设10 个重复。
1.2.5 双重培养平皿对峙试验 根据盆栽试验中所筛选出来的对终极腐霉具有明显拮抗作用的真菌进行双培养平皿对峙试验。按照文献[11]方法进行。具有拮抗活性的真菌与终极腐霉分别培养,3 d后分别将每一种真菌与病原菌接种入同一平皿中培养。将活化后的病原菌和内生真菌 PDA 菌片(直径 4 mm)相对放置于直径为 9 cm 的 PDA平板上,距离 5 cm,边距 2 cm,每个处理组做3 个重复[12]。数据均采集自对峙培养 72 h,具有拮抗活性的内生真菌而不出现明显的抑制带类群,即内生真菌对病原菌有覆盖消化或重寄生类群。采用蔡司光学显微镜观察结合抑制带的方法确定病原菌被抑制程度。
2 结果
2.1 内生真菌在金钗石斛栽培试验中与终极腐霉的拮抗活性筛选
培养 3 w 后,未加任何内生真菌及终极腐霉的阴性对照组,金钗石斛生长旺盛(图 1A);阳性对照组中的金钗石斛生长 7 d 即出现枯萎症状,濒临死亡(图 1D),生长 14 d 金钗石斛苗已完全死亡;试验组中除了 T. koningiopsis 和 T. rogersonii以外,大多数从石斛属药用植物分离得到的内生真菌在盆栽试验中对终极腐霉无明显拮抗活性;加入T. koningiopsis 和 T. rogersonii 两种木霉属真菌的金钗石斛生长旺盛,与阴性对照组生长状况类似,两种木霉属真菌对终极腐霉具有明显的拮抗作用(图 1B,1C)。

图 1 内生真菌对金钗石斛盆栽试验中终极腐霉的拮抗作用(A:不加内生真菌和终极腐霉的阴性对照组;B:实验组加入T. koningiopsis 后对终极腐霉具有明显拮抗作用;C:实验组加入 T. rogersonii 后对终极腐霉具有明显拮抗作用;D:只加入终极腐霉不加入内生真菌的阳性对照组)Figure 1 Antagonistic effects of the endophytic fungi on P. ultimum in pot experiment of D. nobile Lindl. Seedlings (A: D. nobile Lindl. seedlings in the control group grew normally without endophytic fungi or P. ultimum; B: T. koningiopsis showed even greater antagonistic activity than T. erinacecem on P. ultimum and the plant grew even better; C: T. rogersonii could also prevent damage from P. ultimum and D. nobile Lindl. seedlings grew exuberantly; D: The growth condition of D. nobile Lindl. seedlings a week after P. ultimum was inoculated)
2.2 β-1,3 葡聚糖酶和 β-1,4 葡聚糖酶活性
在所测试的 5 种木霉属真菌中,以T. koningiopsis 酶活性最高,其中 β-1,3 葡聚糖酶活性为(7.87 ± 0.06)U/ml,β-1,4 葡聚糖酶活性为(10.35 ± 0.04)U/ml;其次是 T. rogersonii 酶活性较高;而 T. viride、T. gamsii 和 T. intricatum 的两种葡聚糖酶活性较低,以 T. intricatum 为对照,T. koningiopsis 和 T. rogersonii 的酶活性与之相比,具有显著性差异(P < 0.05)(表 1)。
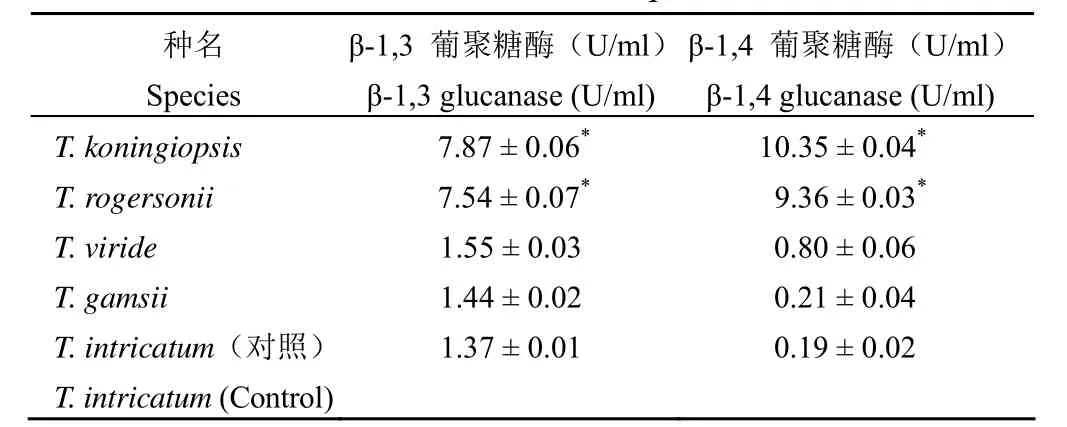
表 1 5 种木霉属真菌细胞外酶活性Table 1 Extracellular enzymatic activities of five Trichoderma species
2.3 双重培养平皿对峙实验
T. koningiopsis 和 T. rogersonii 两种具有拮抗活性的真菌的菌丝及分生孢子形态分别见图 2A和图 2B,终极腐霉的菌丝形态见图 2E。终极腐霉(图 2C 和图 2D 白色箭头,图 2F 箭头)与两种拮抗菌共同培养 48 h 后,T. koningiopsis 和T. rogersonii 菌丝卷曲交错,类似网状(图 2C 星号),然后将终极腐霉环绕包围,终极腐霉菌丝被部分破坏(图 2C 和图 2D 白色箭头)。
3 讨论
目前报道较多的植物病害生防内生真菌是木霉属真菌(Trichoderma spp.),木霉属真菌是一类分布广、繁殖快、具有较高生防价值的真菌,它对多种病原物都有抑制作用,是一类理想的防治土传病害的生防真菌[13]。在本研究中,T. koningiopsis 和T. rogersonii 不仅在金钗石斛盆栽试验中对终极腐霉具有较强的拮抗活性,在双培养平皿对峙试验中,这两种真菌同样对终极腐霉表现出了抑制活性。已报道木霉属真菌对病原菌 Sclerotium rolfsii、Rhizoctonia solani、Fusarium oxysporum、F. culmorum 和 Phythium aphanidermatium 所致疾病具有拮抗作用[14]。
T. koningiopsis 和 T. rogersonii 在双重培养平皿对峙实验时表现出良好的拮抗终极腐霉的活性,其拮抗特点是没有明显的拮抗带,但病原菌终极腐霉的生长受到抑制或消亡,随着双重培养时间的延长,病原菌菌丝体逐渐被消化和吸收,光学显微镜观察可见病原菌被拮抗菌包绕,出现大量空泡,显示出被消化分解的现象(图 2),最终病原菌菌丝体细胞壁被分解而消亡,显微镜下检测不到病原菌菌丝。T. koningiopsis 和 T. rogersonii 在所测试的5 种木霉属真菌中 β-1,3 葡聚糖酶和 β-1,4 葡聚糖酶活性远比其他 3 种木霉属真菌高。木霉属真菌产生的细胞外酶活性可能与其拮抗机制关系密切[10]。研究发现,木霉属真菌对抗植物病原菌是通过分泌分解酶如几丁质酶和 β-1,3 葡聚糖酶而实现的[15]。因此 T. koningiopsis 和 T. rogersonii发挥拮抗活性很可能与其分泌 β-1,3 葡聚糖酶和β-1,4 葡聚糖酶有关。在我们以往的研究中发现,T. koningiopsis 是分离自 D. devonianum 中的内生真菌,同时对金黄色葡萄球菌和枯草芽胞杆菌具有明显的抑制活性[12]。本研究的试验结果将会对金钗石斛生物防治提供新的理论依据。
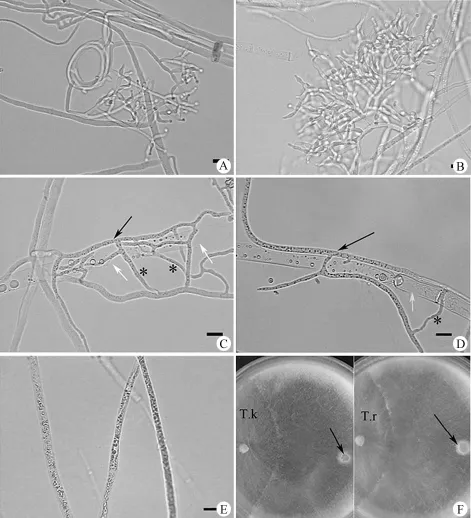
图 2 双重培养平皿对峙实验观察终极腐霉和两种木霉属真菌形态特征[A:T. rogersonii 培养 48 h 菌丝及分生孢子;B:T. koningiopsis 培养 48 h 菌丝及分生孢子;C:T. rogersonii(黑色箭头所示),终极腐霉菌丝(白色箭头所示);D:T. koningiopsis(黑色箭头所示),终极腐霉菌丝(白色箭头所示);E:终极腐霉培养 24 h;F:T. rogersonii (T.k) 或 T. koningiopsis (T.r) 与终极腐霉(箭头所示)共同培养 48 h;比例尺:10 μm]Figure 2 Confrontation between P. ultimum and the two Trichoderma sp. strains [A: The hyphae and spore of T. rogersonii growing for 48 h; B: The hyphae and spore of T. koningiopsis growing for 48 h; C: T. rogersonii (black arrow) and P. ultimum mycelium (white arrow); D: T. koningiopsis (black arrow) and P. ultimum mycelium (white arrow); E: P. ultimum mycelium growing for 24 h; F: Interactions between T. rogersonii (T.k) or T. koningiopsis (T.r) and P.ultimum (arrows) for 48 h; Scale bar: 10 μm]
[1] Lévesque CA, Brouwer H, Cano L, et al. Genome sequence of the necrotrophic plant pathogen Pythium ultimum reveals original pathogenicity mechanisms and effector repertoire. Genome Bio, 2010, 11(7):R73.
[2] Li XD, Wang YQ, Wang H, et al. The isolation and identification of pathogen of Dendrobium nobile and Dendrobium candidum damping-off disease. Chin Pharm J, 2011, 46(4):249-252. (in Chinese)李向东, 王云强, 王卉, 等. 金钗石斛和铁皮石斛软腐病原菌的分离和鉴定. 中国药学杂志, 2011, 46(4):249-252.
[3] Xing YM, Li XD, Liu MM, et al. Morphological and enzymatical characterization of the infection process of Pythium ultimum in Dendrobium officinale (Orchidaceae). Crypto Mycol, 2015, 36(3): 275-286.
[4] Xing YM, Li XD, Guo SX. Morphological studies of Dendrobium nobile infected by the pathogen of the damping-off disease. Chin Med Biotechnol, 2014, 9(3):202-207. (in Chinese)邢咏梅, 李向东, 郭顺星. 软腐病病原菌对金钗石斛致病性的形态学研究. 中国医药生物技术, 2014, 9(3):202-207.
[5] Bhattacharyya P, Kumaria S, Tandon P. Applicability of ISSR and DAMD markers for phyto-molecular characterization and association with some important biochemical traits of Dendrobium nobile, an endangered medicinal orchid. Phytochemistry, 2015, 117:306-316.
[6] Chen J, Zhang LC, Xing YM, et al. Diversity and taxonomy of endophytic Xylariaceous fungi from medicinal plants of Dendrobium (Orchidaceae). PLoS One, 2013, 8(3):e58268.
[7] Howell CR. Mechanisms employed by Trichoderma Species in the biological control of plant diseases. Plant Dis, 2003, 87(1):4-10.
[8] Almassi F, Ghisalberti EL, Narbey M, et al. New Antibiotics from strains of Trichoderma harzianum. J Natrl Prodt, 1991, 54(2):396-402.
[9] Li XD, Wang YQ, Wang H, et al. Biocontrol of Dendrobium candidum damping-off disease with endophytic fungi. Chin Pharm J, 2013, 48(19):1669-1673. (in Chinese)李向东, 王云强, 王卉, 等. 铁皮石斛软腐病的生物防治. 中国药学杂志, 2013, 48(19):1669-1673.
[10] Wang JL, Nie GX, Li SZ, et al. Optimal wavelength for determining the content of reducing sugar by DNS method. J Henan Agric Sci, 2010(4):115-118. (in Chinese)王俊丽, 聂国兴, 李素贞, 等. DNS法测定还原糖含量时最适波长的确定. 河南农业科学, 2010(4):115-118.
[11] Mishra VK. In vitro antagonism of Trichoderma species against Pythium aphanidermatum. J Phytol, 2010, 2(9):28-35.
[12] Xing YM, Chen J, Cui JL, et al. Antimicrobial activity and biodiversity of endophytic fungi in Dendrobium devonianum and Dendrobium thyrsiflorum from Vietman. Curr Microbiol, 2011, 62(4): 1218-1224.
[13] Fravel DR. Commercialization and implementation of biocontrol. Annu Rev Phytopathol, 2005, 43:337-359.
[14] Gajera H, Domadiya R, Patel S, et al. Molecular mechanism of Trichoderma as bio-control agents against phytopathogen system - a review. Curr Res Microbiol Biotechnol, 2013, 1(4):133-142.
[15] Zaldívar M, Velásquez JC, Contreras I, et al. Trichoderma aureoviride 7-121, a mutant with enhanced production of lytic enzymes: its potential use in waste cellulose degradation and/or biocontrol. Electron J Biotechnol, 2001, 4(3):160-168.
Studies on antagonism of Trichoderma sp. against pathogenic fungus of Dendrobium nobile Lindl.
XING Yong-mei, LI Xiang-dong, LI Li, GUO Shun-xing
ObjectiveTo investigate the effects of the growth inhibition between P. ultimum and the potential biocontrol agents which have been isolated from Dendrobium species of medicinal plant.MethodsAntagonistic effects of 179 endophytic fungi on P. ultimum in D. nobile Lindl. Seedlings in pot experiment were performed. In addition, the acitivities of β-1,3 glucanase and β-1,4 glucanase of 5 Trichoderma fungi in cell free filtrate were detected. The dual culture confrontation experiment between the antagonistic fungi and P. ultimum were also studied and the characteristics of the pathogen and the fungi with biocontrol activities were observed under light microscope.ResultsT. koningiopsis and T. rogersonii showed inhibitory effects on P. ultimum after cocultured with D. nobile Lindl. seedlings in pot experiment. The highest activity of β-1,3 glucanase and β-1,4 glucanase was produced by T. koningiopsis, which was followed by T. rogersonii. P. ultimum was damaged due to hyperparasitism by the two Trichoderma fungal strains.ConclusionAfter cocultured with D. nobile Lindl., T. koningiopsis and T. rogersonii could effectively antagonize P. ultimum in pot experiment. The enzymes of β-1,3 glucanase and β-1,4 glucanase produced by Trichoderma species might be involved in destruction of P. ultimum cell wall during antagonism. T. rogersonii and T. koningiopsis could be used as potential biocontrol agents.
DENDROBIUM LOODIGESII; Pythium; T. rogersonii; T. koningiopsis
GUO Shun-xing, Email: sxguo1986@163.com
10.3969/cmba.j.issn.1673-713X.2017.01.007
Chin Med Biotechnol, 2017, 12(1):35-39
山西省煤基重点科技攻关项目(FT2014-03);河北省科技计划项目(16232503D)
100193 北京,中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室(邢咏梅、李向东、郭顺星);042400 山西省临汾市古县农业委员会(李莉)
郭顺星,Email:sxguo1986@163.com
2016-12-01
www.cmbp.net.cn 中国医药生物技术, 2017, 12(1):35-39
Author Affiliations:Key Laboratory of Bioactive Substances and Resource Utilization of Chinese Herbal Medicine, Ministry of Education, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China (XING Yong-mei, LI Xiang-dong, GUO Shun-xing); Agriculture Committee of Guxian Country, Linfen, Shanxi 042400, China (LI Li)
www.cmbp.net.cn
