草酸及草酸盐考题解析
2017-02-06朱怀义
朱怀义
(江苏省睢宁高级中学北校 221200)
在高中教材中,涉及草酸及草酸盐的笔墨不多:《有机化学基础》(苏教2014版P83)在介绍常见羧酸时,出现”乙二酸(草酸)”;《化学反应原理》(苏教2014版P68)在资料卡中,介绍了25℃时草酸的一级、二级电离平衡常数;《化学反应原理》(苏教2014版P37)在介绍“温度对反应速率的影响”的活动与探究中,提供了草酸与酸性高锰酸钾溶液发生反应的化学方程式.由此,知道草酸是二元、还原性、有机弱酸.
相关内容虽只有简单的寥寥数语,但高考对草酸及草酸盐却情有独钟.高考在考查“电解质溶液中微粒浓度关系”时, 选择草酸及草酸盐为载体虽不多见,但也正因为此,更能考查出学生对知识的理解及应用能力.
例1 (2007天津)草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10 mL 0.01 mol·L-1NaHC2O4溶液中滴加0.01 mol·L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( ).
A.V(NaOH)=0时,c(H+)=1×10-2mol·L-1
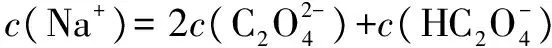
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol·L-1
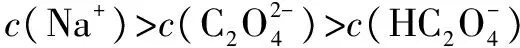
解析草酸氢钠溶液显酸性的原因:

而HC2O4的电离程度大于其水解程度;草酸是二元中强酸,HC2O4并不能够完全电离,所以c(H+)<1×10-2mol·L-1,A错误.当V(NaOH)=10 mL时,恰好完成反应:

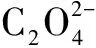
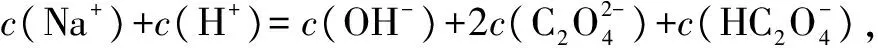
答案:D.
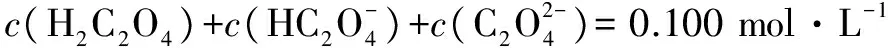
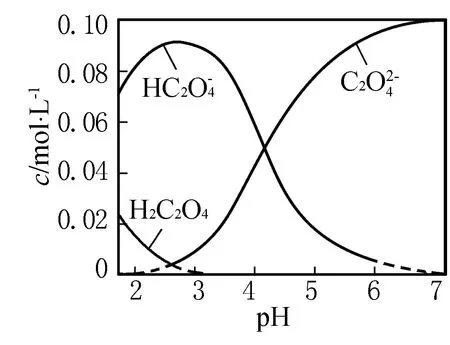
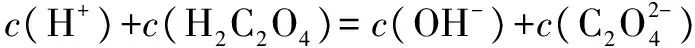
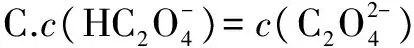
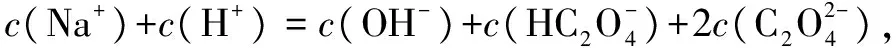
答案:BD.
草酸是还原性酸,可与酸性高锰酸钾溶液反应.此反应有明显的颜色变化,可用于探究外界因素对反应速率影响的实验;若反应以滴定的方式进行,也是测定溶液浓度的重要手段之一.
例3 (1) 草酸与高锰酸钾在酸性条件下能够发生如下反应:
请配平离子方程式,并分析该反应中氧化剂和还原剂的物质的量之比为____.
(2)某探究小组用4 mL 0.001 mol·L-1KMnO4溶液与2mL 0.01 mol·L-1H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
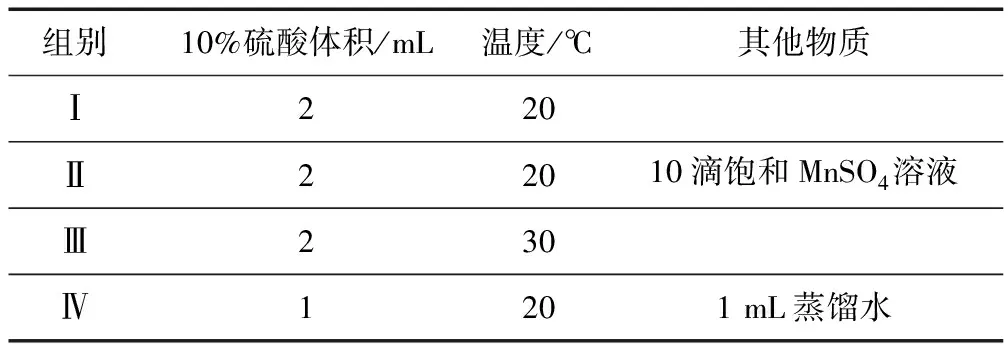
组别10%硫酸体积/mL温度/℃其他物质Ⅰ220Ⅱ22010滴饱和MnSO4溶液Ⅲ230Ⅳ1201mL蒸馏水
①如果研究催化剂对化学反应速率的影响,使用实验____和____(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验____和____.
②对比实验Ⅰ和Ⅳ,可以研究____对化学反应速率的影响;实验Ⅳ中加 入1 mL蒸馏水的目的是____.
(3) 某小组测得实验(恒温)时溶液中n(Mn2+)在反应起始时变化不大、一段时间后快速增大,请分析可能原因:____.
解析(1)根据氧化还原反应化合价升高的总价数等于化合价降低的总价数,Mn由+7价转化为+2价,降低5价,H2C2O4中C为+3价,转化为CO2,共升高了1×2价,配平可得:
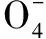
氧化剂和还原剂之比为2∶5.
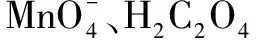
(3)在反应温度保持不变时,反应进行一段时间后,反应物浓度是有所降低的,但反应速率却突然变大,原因只能是生成的Mn2+起到了催化作用.
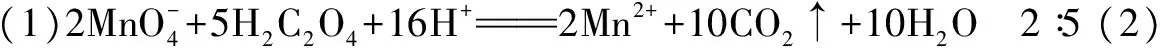
例4 水中因含有机物而具有较高的化学耗氧量.实验室常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下:
(1) 仪器A为____(填“酸式”或“碱式”)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为____.
(2) 若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:配制Na2C2O4标液定容时____.
猜想2:水样中Cl-影响;
写出Cl—离子参与反应的离子方程式:____.
(3)若猜想2成立,请根据资料卡信息,补充完善上述实验以消除Cl-影响.____
资料卡:
①有机物可被HNO3氧化.
②AgCl不与酸性KMnO4溶液反应.
③Ag2C2O4可被酸性KMnO4溶液氧化.
解析(1) KMnO4具有强氧化性,应盛放在酸式滴定管中(碱式滴定管下端橡胶管有还原性);要明确完成测定的滴定原理——步骤I所取水样中有机物和步骤Ⅳ所用Na2C2O4溶液共同恰好将步骤Ⅱ中所滴加溶液的KMnO4消耗完毕,根据氧化还原反应中化合价升降相等,可推算出水样中有机物的含量.所以步骤Ⅱ中所滴加KMnO4溶液相对步骤Ⅰ水样中有机物是过量的、步骤Ⅲ中溶液颜色为紫红色.
(2)定容时俯视刻度线,溶液的体积偏小,所配制溶液的浓度偏大,所以实验测量结果比实际有机物含量偏高;Cl-离子在强氧化剂面前体现还原性,发生反应:

例5 (根据2013上海19 改编)碳酸、草酸在25℃的电离平衡常数如下表:
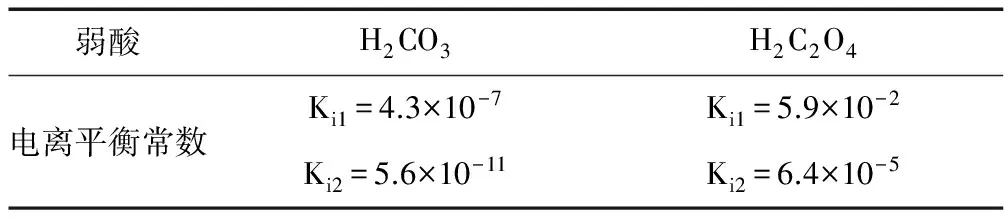
弱酸H2CO3H2C2O4电离平衡常数Ki1=4.3×10-7Ki2=5.6×10-11Ki1=5.9×10-2Ki2=6.4×10-5
下列选项错误的是( ).


C. 现用NaHR表示NaHC2O4、NaHCO3的组成,则在相应的酸式钠盐溶液中,离子浓度间关系均存在:c(HR-)>c(H2R)>c(R2-)
D. 分别向一定体积、一定浓度的NaHC2O4、NaHCO3溶液中滴加NaOH溶液,在滴加过程中, 溶液中离子浓度关系均不可能存在c(Na+)=2c(R2-)+c(HR-).
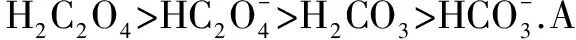
答案:CD
[1]王祖浩等.普通高中课程标准实验教科书·化学反应原理[M].南京:江苏凤凰教育出版社,2016(3).
