Nrf2/ARE信号通路及其在卵巢中的作用研究进展
2017-01-12陈菁卢晓声吕杰强
陈菁,卢晓声,吕杰强
·综述·
Nrf2/ARE信号通路及其在卵巢中的作用研究进展
陈菁,卢晓声△,吕杰强
核因子E2相关因子2(nuclear factor erythroid-derived factor 2-related factor 2,Nrf2)是细胞自身抗氧化的关键因子,当发生氧化应激刺激时,Nrf2转移入核内,与抗氧化反应原件(antioxidant response element,ARE)结合,并调节下游多种抗氧化蛋白和解毒酶的表达,起到细胞内源性保护作用。Nrf2/ARE信号通路参与了多种疾病的病理生理过程,如炎症反应、呼吸系统疾病、心血管系统疾病和肿瘤等,但该通路在女性生殖系统尤其是卵巢组织中的研究较少。综述该通路的基本组成及调节,以及该通路在卵巢疾病,尤其是在卵巢衰老中的研究进展。
NF-E2相关因子2;Nrf2/ARE信号通路;反应元件;氧化性应激;卵巢
核因子E2相关因子2(nuclear factor erythroidderivedfactor2-relatedfactor2,Nrf2),也称为红细胞衍生的CNC同源蛋白(erythriod-derived CNC homology protein,ECH),属于Cap′-n′-Collar家族的转录因子,是细胞自身抗氧化的关键因子。在正常的稳态环境下,Nrf2与细胞质中的Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)结合,通过蛋白酶体途径持续降解。在氧化应激的环境中,Nrf2转移入核内,与抗氧化反应元件(antioxidant responsive element,ARE)结合,调节下游多种抗氧化和解毒基因的表达,形成Nrf2/ARE信号通路。
Nrf2/ARE信号通路广泛表达在多个器官中,如肌肉、心脏、脉管系统、肝脏、肾脏、大脑、肺、皮肤和消化道等,参与多种疾病的病理生理过程,如炎症反应、呼吸系统疾病、心血管系统疾病和肿瘤等[1]。Nrf2/ ARE信号通路在抗炎症、免疫、抗凋亡、抗肿瘤、抗动脉粥样硬化、抗缺血再灌注损伤、肺纤维化和神经保护等方面都发挥着重要作用。卵巢对氧化应激反应高度敏感,在氧化应激反应的作用下,卵巢细胞开始走向凋亡[2-3],但对Nrf2/ARE信号通路在卵巢疾病中的作用的研究目前较少。现对Nrf2/ARE信号通路的结构、信号转导,以及该通路在卵巢疾病中的作用综述如下。
1 Nrf2/ARE信号通路的结构
Nrf2是CNC转录因子家族的碱性亮氨酸拉链转录因子,包含589个氨基酸,分子质量为66.1 ku,其羧基端有一个亮氨酸拉链结构,是DNA结合域,氨基端是富含谷氨酸和天冬氨酸的酸性激活域[4]。Nrf2有6个高度保守的结构域[5-8],分别为Neh1~Neh6,见图1A。Neh2位于Nrf2的氨基端,是Nrf2与Keap1结合的区域,也是Nrf2依赖Keap1通过泛素化而降解所必需的结构域。它包含了ETGE基序、DLG基序和DIDLID元件。ETGE基序和DLG基序均是稳态环境下Nrf2与Keap1结合的重要位点[9]。在氧化应激环境下,DLG基序与Keap1分离。DIDLID元件对Neh2的活性及其招募泛素化连接酶的过程中发挥重要作用。Neh1区域有一个亮氨酸拉链结构bZIP,Nrf2通过该结构与Maf蛋白结合形成二聚体,然后与ARE结合,激活靶基因的转录。Neh4区域和Neh5区域作用于环磷酸腺苷反应元件结合蛋白(CBP),是ARE依赖的基因转录的激活区域,调节Nrf2的靶基因转录。Neh6区域富含丝氨酸,不具有氧化还原敏感性,调节Nrf2的降解。Neh3区域位于Nrf2的羧基端,是高度保守的区域,可促进ARE调控靶基因的转录。
Keap1包含624个氨基酸残基,有5个结构域,从氨基端到羧基端分别称为氨基端结构域(NTR)、BTB/POZ、IVR、双甘氨酸重复区域(DGR)和羧基端机构域(CTR)区域[10],见图1B。BTB/POZ区域包含有高度保守的丝氨酸残基,2个BTB/POZ区域相互结合,使Keap1形成二聚体蛋白,该位点的改变导致Keap1不能形成二聚体,从而使Nrf2从Keap1上分离减弱。IVR区域富含半胱氨酸,对氧化应激的改变非常敏感。在氧化应激环境中,IVR区域发生构象改变,从而引起Nrf2与Keap1分离。DGR区域包含了6个甘氨酸残基,是与Nrf2相互作用的区域。在正常稳态环境下,Keap1二聚体蛋白的2个DGR区域分别与Nrf2的ETGE基序和DLG基序结合,使转录因子Nrf2泛素化。在氧化应激的环境中,Keap1的活性被抑制,Nrf2未被泛素化而是转移至核内积聚,刺激ARE下游的抗氧化基因进行转录,调节细胞的氧化还原平衡[8]。
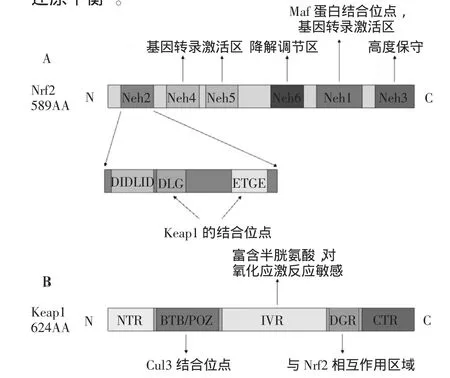
图1 Nrf2和Keap1蛋白的结构示意图
2 Nrf2/ARE信号通路的调节
在正常的稳态环境中,Nrf2通过Cul3-Keap1泛素化E3连接酶复合物被持续地泛素化而降解,半衰期小于20 min,使细胞内的Nrf2维持在较低水平[11]。研究发现,当细胞暴露在氧化应激反应环境中时,可用2种模型解释Nrf2与Keap1之间相互作用的机制。第1种模型中,在活性氧簇(ROS)和亲电子剂的作用下,Keap1的ICR区域中半胱氨酸残基被改变而被直接灭活,导致E3连接酶活性下降,Nrf2与Keap1分离,随后被转运入细胞核内[12]。另1种模型称为“hinge and latch”模型[10],认为在细胞质中,Keap1二聚体蛋白的2个DGR区域分别与Nrf2上高黏附性的ETGE基序和低黏附性的DLG基序结合。在氧化应激条件下,DGR区域与低黏附性的DLG基序分离,但仍与高黏附性的ETGE结合,使新合成的Nrf2蛋白不能结合到Keap1,从而被转运入细胞核内。Nrf2蛋白除了通过依赖Keap1蛋白进行调节外,还可以通过其他途径进行调节,包括各种蛋白激酶[如蛋白激酶C(PKC)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)、糖原合酶激酶3β(GSK-3β)、c-Jun氨基末端激酶(JNK)]的磷酸化作用、与蛋白伴侣(如p21、caveolin-1)的相互作用和微小RNA(microRNA)等[13]。Nrf2在核内积聚,与Maf蛋白形成二聚体,结合ARE,激活下游各种抗氧化基因的转录。Nrf2/ARE途径调节的基因包括多种抗氧化物基因,如血红素氧合酶-1(HO-1)、UDP-葡萄糖醛酸转移酶和γ-谷氨酰半胱氨酸合成酶(γ-GCS)等,还包括一系列药物代谢酶,如谷胱甘肽S转移酶(GST)和NAD(P)H-醌还原酶(NQO1)[14-15]。
3 Nrf2/ARE信号通路与卵巢疾病
Nrf2是细胞自身抗氧化的关键因子,通过作用于ARE,调节下游抗氧化酶等的表达而发挥抗氧化功能。研究发现,Nrf2/ARE信号通路通过调节氧化应激反应在多种疾病中都发挥了重要作用。有研究发现,脱氢青蒿素可以通过激活Nrf2/ARE信号通路,减弱博来霉素引起的氧化应激损伤,从而减少肺损伤[16]。用姜黄素处理糖尿病肾病小鼠模型后,小鼠体内Nrf2蛋白量显著升高,氧化应激反应明显减弱[17]。卵巢是对氧化应激反应高度敏感的器官,卵巢炎症、卵巢肿瘤、卵巢衰老等均存在氧化与抗氧化的过程。由此推测,Nrf2/ARE信号通路在卵巢疾病中也发挥了重要作用。
3.1 卵巢癌实验发现,卵巢癌细胞中由于存在氧化与抗氧化的不平衡,发生ROS的高表达,而高表达的ROS可以刺激细胞内Nrf2蛋白的表达增多[18]。Nrf2蛋白不仅可以保护正常细胞免受氧化应激损伤,同时也可以减少肿瘤细胞内的氧化应激损伤[19]。用双氢青蒿素DHA作用于卵巢癌细胞发现,DHA的作用可以使细胞内ROS水平提高,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)等抗氧化酶显著下降,抑制卵巢癌细胞的增殖,促进其凋亡,同时癌细胞的核内Nrf2蛋白表达明显减少,胞质中Keap1蛋白显著增加[20]。该研究说明,通过抑制Nrf2蛋白的表达及其核转位,可以减少癌细胞内多种抗氧化酶的表达,使癌细胞内氧化与抗氧化反应失衡,诱导癌细胞凋亡。同样,用百里醌处理卵巢癌细胞,也可见癌细胞核内Nrf2蛋白表达显著减少,进而减少抗氧化酶的表达,导致癌细胞凋亡[21]。马洁等[22]通过培养卵巢癌Hey细胞研究发现,卵泡刺激素(FSH)可刺激卵巢癌Hey细胞的产生,促进Nrf2蛋白表达,并呈时间和剂量依赖性,抑制ROS途径可阻断FSH诱导的Nrf2蛋白高表达,而Nrf2蛋白的高表达可以抑制卵巢肿瘤细胞的凋亡。激活Nrf2可促进卵巢癌细胞的生长,并且保护细胞免受人表皮生长因子受体2(HER2)靶向免疫治疗引起的细胞毒性的损害[23]。另外,有学者通过研究高氢生理盐水在化疗引起的卵巢损伤中的作用发现,高氢生理盐水可提高化疗卵巢中Nrf2蛋白的表达,减少有毒化学物质的损害,维持卵巢细胞内的稳态环境[24]。
对卵巢癌中Nrf2/ARE信号通路的研究可见,Nrf2/ARE信号通路参与了卵巢癌细胞内的抗氧化反应。外源性抑制卵巢癌细胞中Nrf2蛋白的表达,可以加剧癌细胞内的氧化和抗氧化反应失衡,从而诱导癌细胞的凋亡,而外源性上调卵巢癌细胞中Nrf2蛋白的表达则会抑制卵巢癌细胞的凋亡。但在正常卵巢细胞中,Nrf2蛋白的表达增多可以增强细胞的抗氧化能力,保护正常卵巢细胞。
3.2 卵巢衰老Suh等[25]发现,大鼠肝脏细胞中总Nrf2蛋白及核内Nrf2蛋白量均随着年龄的增长呈显著下降趋势,但在其他器官(如卵巢)中,Nrf2蛋白的含量与年龄是否存在相关性尚未见报道。随着年龄的增长,卵巢细胞的抗氧化能力下降,氧化与抗氧化的失衡使卵巢细胞逐渐凋亡是造成卵巢衰老的重要原因之一[2]。研究发现,Nrf2基因敲除可增加卵巢对有毒物质的敏感性,加速小鼠卵巢衰老[26]。刘云肖等[27]用900 MHz非电离电磁辐射(EMR)持续辐射大鼠20 d,发现大鼠卵巢功能有明显损伤,使雌二醇水平降低和卵泡颗粒细胞层数减少,并且伴随着卵巢组织中Nrf2蛋白表达增加、卵巢内氧平衡失调和氧化应激出现。用莠去净(atrazine,ATR)诱导卵巢衰老,随着ATR浓度的增加,卵巢中闭锁卵泡数量增加,Nrf2的含量也随着ATR浓度增加而增加,并且其在核内的表达呈显著增加的趋势,其下游的解毒酶和抗氧化酶如HO-1、NQO1、SOD、过氧化物酶(CAT)、GPX的表达也逐渐增多[28]。有研究用4-乙烯基环己烯环氧化物(4-vonyl cyclohexene diepoxide,VCD)诱导卵巢衰老模型发现,Nrf2蛋白可以保护小鼠卵巢细胞免受VCD的卵巢毒性损害,Nrf2基因敲除可减少卵巢内微粒体环氧化酶的表达,增加细胞内的氧化应激反应,从而增加VCD对卵巢的损伤[29]。进一步研究发现,Nrf2基因敲除的雌鼠表现出生殖能力下降,平均产仔数量显著减少,且达到不孕的周龄明显提前,并伴随着高促性腺激素和性腺功能低下。另外,有学者用双酚A(BPA)处理体外培养的大鼠卵巢发现,BPA可以通过激活卵巢毛细血管扩张性共济失调突变基因(ATM)介导的DNA修复应答而破坏卵巢DNA,促进卵泡闭锁,导致卵泡数量减少,引起卵巢的氧化应激反应,但Nrf2蛋白含量却下降[30]。
目前对Nrf2/ARE信号通路在卵巢衰老中的研究尚不多,从目前的研究可见,随着卵巢衰老的出现,Nrf2蛋白及其下游的抗氧化酶等的表达增多,从而增强卵巢的抗氧化能力,减少氧化应激和有毒物质对卵巢的损害,维持卵巢内环境的稳态,保护卵巢功能。由此推测,Nrf2/ARE信号通路在卵巢衰老的过程中具有重要作用。
4 结语
近年来,Nrf2/ARE信号通路成为了氧化应激反应的研究热点,其广泛存在于体内的各个器官,通过调节抗氧化蛋白和解毒酶的表达,保护细胞免受氧化应激损伤。氧化应激反应是卵巢疾病,如卵巢癌、卵巢功能早衰的重要诱因之一。目前的研究显示,Nrf2/ARE信号通路在卵巢疾病中有重要的作用,如抑制卵巢癌细胞中Nrf2蛋白的表达,可以使癌细胞内氧化与抗氧化失衡,诱导卵巢癌细胞凋亡;上调卵巢细胞中Nrf2蛋白的表达,可以提高卵巢细胞的抗氧化能力,减少氧化应激损伤,保护卵巢功能。因此,研究Nrf2/ARE信号通路对卵巢疾病有重要的意义。在现有研究的基础上可以推测,通过对Nrf2/ARE信号通路的调控,有可能延缓卵巢功能的过早衰退,但对该通路在卵巢衰老中的作用机制的报道很少,尚待进一步深入研究。
[1]Chen B,Lu Y,Chen Y,et al.The role of Nrf2 in oxidative stressinduced endothelial injuries[J].J Endocrinol,2015,225(3):R83-R99.
[2]叶娜,董晓英,李东华.卵巢早衰的颗粒细胞凋亡机制研究进展[J].首都医科大学学报,2014,35(3):379-383.
[3]Chandra J,Samali A,Orrenius S.Triggering and modulation of apoptosis by oxidative stress[J].Free Radic Biol Med,2000,29(3/ 4):323-333.
[4]Moi P,Chan K,Asunis I,et al.Isolation of NF-E2-related factor 2 (Nrf2),a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J].Proc Natl Acad Sci U S A,1994,91(21):9926-9930.
[5]McMahon M,Thomas N,Itoh K,et al.Redox-regulated turnover of Nrf2 is determined by at least two separate protein domains,the redox-sensitive Neh2 degron and the redox-insensitive Neh6 degron [J].J Biol Chem,2004,279(30):31556-31567.
[6]McMahon M,Thomas N,Itoh K,et al.Dimerization of substrate adaptors can facilitate cullin-mediated ubiquitylation of proteins by a"tethering"mechanism:a two-site interaction model for the Nrf2-Keap1 complex[J].J Biol Chem,2006,281(34):24756-24768.
[7]Rada P,Rojo AI,Chowdhry S,et al.SCF/{beta}-TrCP promotes glycogen synthase kinase 3-dependent degradation of the Nrf2 transcription factor in a Keap1-independent manner[J].Mol Cell Biol,2011,31(6):1121-1133.
[8]Chowdhry S,Zhang Y,McMahon M,et al.Nrf2 is controlled by two distinct β-TrCP recognition motifs in its Neh6 domain,one of which can be modulated by GSK-3 activity[J].Oncogene,2013,32(32):3765-3781.
[9]Katoh Y,Iida K,Kang MI,et al.Evolutionary conserved N-terminal domain of Nrf2 is essential for the Keap1-mediated degradation of the protein by proteasome[J].Arch Biochem Biophys,2005,433(2):342-350.
[10]Kansanen E,Kuosmanen SM,Leinonen H,et al.The Keap1-Nrf2 pathway:Mechanisms of activation and dysregulation in cancer[J]. Redox Biol,2013,1:45-49.
[11]Kobayashi A,Kang MI,Okawa H,et al.Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2[J].Mol Cell Biol,2004,24(16):7130-7139.
[12]Taguchi K,Motohashi H,Yamamoto M.Molecular mechanisms of the Keap1–Nrf2 pathway in stress response and cancer evolution[J]. Genes Cells,2011,16(2):123-140.
[13]Bryan HK,Olayanju A,Goldring CE,et al.The Nrf2 cell defence pathway:Keap1-dependent and-independent mechanisms of regulation[J].Biochem Pharmacol,2013,85(6):705-717.
[14]Foygel K,Sekar TV,Paulmurugan R.Monitoring the Antioxidant Mediated Chemosensitization and ARE-Signaling in Triple Negative Breast Cancer Therapy[J].PLoS One,2015,10(11):e0141913.
[15]Luo L,Chen Y,Wu D,et al.Butylated hydroxyanisole induces distinct expression patterns of Nrf2 and detoxification enzymes in the liver and small intestine of C57BL/6 mice[J].Toxicol Appl Pharmacol,2015,288(3):339-348.
[16]Chen W,Li S,Li J,et al.Artemisitene activates the Nrf2-dependent antioxidant response and protects against bleomycin-induced lung injury[J].FASEB J,2016,30(7):2500-2510.
[17]Kim BH,Lee ES,Choi R,et al.Protective Effects of Curcumin on Renal Oxidative Stress and Lipid Metabolism in a Rat Model of Type 2 Diabetic Nephropathy[J].Yonsei Med J,2016,57(3):664-673.
[18]Khalil HS,Goltsov A,Langdon SP,et al.Quantitative analysis of NRF2 pathway reveals key elements of the regulatory circuits underlying antioxidant response and proliferation of ovarian cancer cells[J].J Biotechnol,2015,202:12-30.
[19]van der Wijst MG,Huisman C,Mposhi A,et al.Targeting Nrf2 in healthy and malignant ovarian epithelial cells:Protection versus promotion[J].Mol Oncol,2015,9(7):1259-1273.
[20]王汉楚,沙丽晓,陈小燕,等.双氢青蒿素对卵巢癌生长的抑制作用及其机制的研究[J].医学研究杂志,2012,41(5):138-141.
[21]龚建明,王晓,吴洁,等.百里醌抑制卵巢癌生长及其机制研究[J].中草药,2015,46(24):3717-3721.
[22]马洁,王倩倩,廖红,等.促卵泡激素通过活性氧途径调控卵巢癌细胞Nrf2蛋白的表达[J].第二军医大学学报,2012,33(9):935-939.
[23]Khalil HS,Langdon SP,Kankia IH,et al.NRF2 Regulates HER2 and HER3 Signaling Pathway to Modulate Sensitivity to Targeted Immunotherapies[J].Oxid Med Cell Longev,2016,2016:4148791.
[24]Meng X,Chen H,Wang G,et al.Hydrogen-rich saline attenuates chemotherapy-induced ovarian injury via regulation of oxidative stress[J].Exp Ther Med,2015,10(6):2277-2282.
[25]Suh JH,Shenvi SV,Dixon BM,et al.Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid[J].Proc Natl Acad Sci U S A,2004,101(10):3381-3386.
[26]Lim J,Ortiz L,Nakamura BN,et al.Effects of deletion of the transcription factor Nrf2 and benzo[a]pyrene treatment on ovarian follicles and ovarian surface epithelial cells in mice[J].Reprod Toxicol,2015,58:24-32.
[27]刘云肖,马惠荣,陈景伟,等.滋肾育胎丸对电磁辐射大鼠卵巢组织氧化损伤和Nrf2蛋白表达的影响[J].中国药房,2016,27(4):470-473.
[28]Zhao F,Li K,Zhao L,et al.Effect of Nrf2 on rat ovarian tissues against atrazine-induced anti-oxidative response[J].Int J Clin Exp Pathol,2014,7(6):2780-2789.
[29]Hu X,Roberts JR,Apopa PL,et al.Accelerated ovarian failure induced by 4-vinyl cyclohexene diepoxide in Nrf2 null mice[J].Mol Cell Biol,2006,26(3):940-954.
[30]Ganesan S,Keating AF.Bisphenol A-induced ovotoxicity involves DNA damage induction to which the ovary mounts a protective response indicated by increased expression of proteins involved in DNA repair and xenobiotic biotransformation[J].Toxicol Sci,2016,152(1):169-180.
Research Progress of Nrf2/ARE Pathway and It′s Role in Ovary
CHEN Jing,LU Xiao-sheng,LYU Jie-qiang.Wenzhou Medical University,Wenzhou 325000,China(CHEN Jing);Reproductive Center,The Second Affiliated Hospital&Yuying Children′s Hospital of Wenzhou Medical University,Wenzhou 325000,China(LU Xiao-sheng,LYU Jie-qiang)
LYU Jie-qiang,E-mail:jieqianglu@126.com
Nuclear factor erythroid-derived factor 2-related factor 2(Nrf2)is a key factor in anti-oxidation in most species.Once oxidative stress stimulus occurs,Nrf2 transfers into the nucleus,and binds to antioxidant response element(ARE), and then regulates the expression of a variety of antioxdants and detoxifying enzymes to protect cells against oxidants injury.The Nrf2/ARE pathway involvs in the pathological process of many diseases,such as inflammation,respiratory disease, cardiovascular disease and tumor.But there is not enough research about its function in the female reproductive system, especially in ovary.In this article,we reviews the basic components of Nrf2/ARE pathway and its regulation,and the advanced study of this pathway in ovarian diseases,especially in ovarian aging.
NF-E2-related factor 2;Nrf2/ARE pathway;Response elements;Oxidative stress;Ovary(J Int Obstet Gynecol,2016,43:665-668)
2016-05-06)
[本文编辑王昕]
国家自然科学基金(81541019)
325000温州医科大学(陈菁);温州医科大学附属第二医院育英儿童医院生殖中心(卢晓声,吕杰强)
吕杰强,E-mail:jieqianglu@126.com
△审校者
