黏附分子CD146对Vorinostat诱导卵巢癌细胞凋亡作用的影响
2017-01-12马晓黎刘雨声阎锡蕴郭银树段华马丁
马晓黎,刘雨声,阎锡蕴,郭银树,段华,马丁
·论著·
黏附分子CD146对Vorinostat诱导卵巢癌细胞凋亡作用的影响
马晓黎#,刘雨声#,阎锡蕴,郭银树,段华,马丁
目的:探讨黏附分子CD146对组蛋白去乙酰化酶抑制剂Vorinostat诱导卵巢癌细胞凋亡作用的影响。方法:通过实时聚合酶链反应(real-time PCR)和蛋白质印迹(western blotting)法检测卵巢癌细胞A2780和SKOV3中CD146在组蛋白去乙酰化酶抑制剂Vorinostat作用下的变化情况。通过流式细胞仪(FACS)及细胞克隆形成实验检测CD146单克隆抗体AA98对Vorinostat诱导卵巢癌细胞凋亡和抑制克隆形成的影响,金氏公式法分析联合用药效果。通过Western blotting法比较Vorinostat单药及AA98与Vorinostat联用对卵巢癌细胞中蛋白激酶B/哺乳动物雷帕霉素靶蛋白(AKT/mTOR)信号通路及下游分子的影响。结果:在卵巢癌细胞中黏附分子CD146在Vorinostat作用下被显著性诱导表达,高表达的CD146可能与卵巢癌化疗敏感性有关。CD146单克隆抗体AA98与Vorinostat联用显著增加了卵巢癌细胞的凋亡率,降低了细胞克隆形成能力,差异有统计学意义(P<0.05)。金氏公式计算表明两药具有协同效应。AA98可明显降低Vorinostat引起的AKT/mTOR通路活化作用,降低卵巢癌细胞中磷酸化AKT(p-AKT)、磷酸化真核翻译起始因子4E结合蛋白1(p-4E-BP1)及磷酸化核糖体40S小亚基S6蛋白激酶(p-S6K1)的蛋白表达水平(P<0.05)。结论:Vorinostat使CD146显著上调,从而降低了卵巢癌化疗敏感性,CD146单抗可能通过逆转和抑制Vorinostat引起的AKT/mTOR通路活化作用,Vorinostat联合CD146单抗对卵巢癌细胞具有明显的协同杀伤效力。
卵巢肿瘤;抗原,CD146;抗肿瘤药;Vorinostat;细胞凋亡;协同作用
(J Int Obstet Gynecol,2016,43:690-694)
卵巢癌在女性生殖器肿瘤中预后最差,极易转移和复发,这与卵巢癌化疗耐药密切相关[1-3]。随着基础研究的不断深入、新型化疗药物的问世,卵巢癌的化疗效果有了很大改善[4]。Vorinostat是一种新型靶向抗肿瘤药物,属于组蛋白去乙酰化酶抑制剂,能抑制组蛋白去乙酰化酶的活性,能在小剂量、低浓度情况下诱导肿瘤细胞分化,对包括卵巢癌在内的多种肿瘤具有杀伤作用,并于2006年被美国食品和药物管理局(FDA)批准用于临床[5-7]。然而,临床研究显示Vorinostat单药治疗卵巢癌效果欠佳,其原因尚不清楚[8-10]。既往研究曾发现多种肿瘤细胞在Vorinostat作用下出现黏附分子CD146异常升高,尤其在卵巢癌细胞中最为显著[11],本研究旨在进一步探讨黏附分子CD146对Vorinostat诱导卵巢癌细胞凋亡作用的影响及作用机制。
1 材料与方法
1.1 主要仪器及试剂人卵巢癌细胞株A2780和SKOV3[美国典型培养物保藏中心(ATCC)];小牛血清(杭州四季青生物工程材料有限公司);Trizol试剂和培养基RPMI-1640(美国Gibco BRL公司);组蛋白去乙酰化酶抑制剂Vorinostat(美国Sigma公司);CD146单克隆抗体AA98由中国科学院生物物理研究所阎锡蕴教授提供;蛋白激酶B(AKT)、p-AKT、磷酸化真核翻译起始因子4E结合蛋白1(p-4E-BP1)、磷酸化核糖体40S小亚基S6蛋白激酶(p-S6K1)、β-actin抗体(Santa Cruz公司);全自动酶标读数仪(美国Bio-Rad公司Bio-Rad2550型);流式细胞仪(FACScan Becton Dickinson)为美国BD公司产品;蛋白质印迹(western blotting)电泳仪(德国Biometra公司)。
1.2 实验方法
1.2.1 细胞培养人卵巢癌细胞株A2780、SKOV3培养于含10%新鲜小牛血清的RPMI 1640培养液中,置于37℃、5%二氧化碳(CO2)、相对湿度90%的培养箱中培养,细胞呈贴壁生长。
1.2.2 实时聚合酶链反应(Real-time PCR检测)CD146基因通过primer 5软件设计引物。CD146基因正向引物序列为5′-CAGTCCTCATACCAGAGCCAACAG-3′,反向引物序列为5′-GGACCAGGATGCACACAATCA-3′。18s RNA设为内参,正向引物序列为5′-AGTCCCTGCCCTTTGACACA-3′,反向引物序列为5′-GATCCGAGGGCCTCACTAAAC-3′。在美国ABI 7500型PCR仪上进行分析,按SYBR Green PCR Master Mix(美国Sigma公司)说明书进行。通过Real-time PCR溶解曲线确定扩增产物的纯度。在所有检测样本中未发现基因组DNA的污染。每组均设3个复孔,基因相对量采用2-ΔCt方法计算。
1.2.3 FACS检测细胞凋亡将卵巢癌细胞A2780、SKOV3接种于6孔板中,分别用二甲基亚砜(DMSO)、10 μg/mL单克隆抗体(单抗)AA98、2.5 μmol/L Vorinostat和AA98+Vorinostat作用72 h后消化、收集细胞,磷酸盐缓冲液(PBS)冲洗2遍,buffer重悬,调整细胞浓度为1×106个/mL。取100 μL于5 mL管中,加入5 μL Annexin V及5 mL PI,室温避光孵育15 min后加入400 μL PBS,1 h内上流式细胞仪检测。以上实验均重复3次。
1.2.4 克隆形成实验取对数生长期细胞,2.5 g/L胰蛋白酶消化并轻轻吹打,使之成为单细胞,活细胞计数,调整细胞密度至1×103细胞/mL。蒸馏水分别制备出12 g/L和7 g/L两个质量浓度的低溶点琼脂糖液,高压灭菌后,维持40℃不凝。按1∶1比例使12 g/L的琼脂糖和2×改良Eagle培养基(DMEM/F12)培养液[含有2×抗生素和200 mL/L胎牛血清(FBS)]混匀后,取3 mL混合液注入直径6 cm平皿中,冷却凝固置CO2温箱中备用。按1∶1比例将7 g/L的琼脂糖和2× DMEM培养液在无菌试管中相混以后,再向管中加入细胞悬液,充分混匀,注入铺有12 g/L琼脂糖底层平皿中,逐渐形成双琼脂层。待上层琼脂凝固后,置入37℃、CO2温箱中培养10~14 d。把平皿放置在倒置显微镜下,观察细胞克隆数。按公式计算克隆形成率:克隆形成率=克隆数/接种数×100%。
1.2.5 联合作用评价采用金氏公式[12]评价两种药物的联合作用。金氏公式表达式:Q=EA+B/(EA+EB-EA×EB)。EA、EB分别表示A和B两种药物单独用药的效应;EA+B表示药物A和药物B联合用药的效应。通过判读Q值来评价两种药物在联合使用后的治疗效果是否优于单独给药。如果Q在0.85~1.15之间为单纯相加,Q>1.15为协同作用,Q<0.85为拮抗作用。1.2.6Western blotting检测蛋白水平收集经过药物处理过的A2780细胞,裂解并提取蛋白,采用考马斯亮蓝G-250染料法进行蛋白定量。100 μg总蛋白进行10%SDS-PAGE凝胶电泳,以蛋白电泳转移仪将蛋白转至NC膜上,脱脂奶室温封闭2 h,分别用AA98、AKT、磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)、p-AKT、p-4E-BP1、p-S6K1单克隆抗体孵育4℃过夜。PBS洗膜,加入1∶500碱性磷酸酶标记的二抗37℃孵育1 h,NBT/ BCIP系统显色30 min。图像经Uvpgrab-it Image1软件采集,计算各蛋白与β-actin的比值作为其相对表达水平。
1.3 统计学方法采用SPSS 22.0软件包对实验数据进行统计学分析。定量资料用均数±标准差(±s)表示,组间两两比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌细胞在Vorinostat作用下可引起黏附分子CD146显著性诱导表达Real-time PCR结果显示,以DMSO为对照组,卵巢癌细胞A2780和SKOV3在2.5 μmol/L Vorinostat作用12 h后胞内黏附分子CD146的mRNA水平显著升高,在A2780细胞中CD146升高至DMSO的(450.30±26.17)倍,在SKOV3细胞中升高至(165.87±20.32)倍,差异有统计学意义(P=0.000),见图1A。western blotting结果显示,卵巢癌细胞A2780和SKOV3在2.5 μmol/L Vorinostat作用48 h后CD146蛋白水平亦显著升高,差异有统计学意义(A2780:P=0.003;SKOV3:P= 0.002),见图1B。

图1 卵巢癌细胞在Vorinostat作用下CD146表达变化
2.2 CD146单抗AA98可显著增强Vorinostat诱导卵巢癌细胞发生凋亡的作用以DMSO为对照组,卵巢癌细胞A2780和SKOV3分别在2.5 μmol/L Vorinostat单药、10 μg/mL CD146单抗AA98单药及两者联合用药作用72 h后检测各组细胞凋亡率,FACS结果显示,AA98可明显增强Vorinostat诱导卵巢癌细胞凋亡的效力,在A2780细胞中,Vorinostat单药和联合用药的细胞凋亡率分别为(16.28±2.94)%和(38.13±3.56)%,差异有统计学意义(P=0.002);在SKOV3细胞中,Vorinostat单药和联合用药的细胞凋亡率分别为(18.75±3.62)%和(49.06±4.31)%,差异有统计学意义(P=0.001),见图2。根据金氏公式计算,在A2780细胞中联合用药组Q值为1.552;在SKOV3细胞中联合用药组Q值为1.825,结果可见联合用药组的Q值均>1.15,表明Vorinostat联合AA98具有协同杀伤作用。
2.3 CD146单抗AA98可显著增强Vorinostat抑制卵巢癌细胞克隆形成的作用以DMSO为对照组,卵巢癌细胞A2780分别在2.5 μmol/L Vorinostat单药、10 μg/mL CD146单抗AA98单药及两者联合用药作用48 h后检测各组细胞克隆形成率,结果显示,联合用药组卵巢癌A2780细胞克隆形成率最低,与Vorinostat单药组比较,差异有统计学意义[(19.06±4.92)%vs.(46.53±4.20)%,P=0.002],见图3。根据金氏公式计算,在A2780细胞中联合用药组Q值为1.448(Q值>1.15),表明Vorinostat联合AA98具有协同抑制细胞克隆形成作用。

图2 CD146单抗AA98对Vorinostat诱导卵巢癌细胞A2780和DKOV3发生凋亡作用的影响
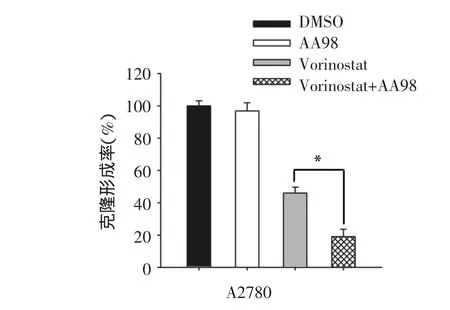
图3 CD146单抗AA98对Vorinostat抑制卵巢癌细胞A2780克隆形成作用的影响
2.4 CD146单抗AA98对卵巢癌细胞中AKT/ mTOR通路的影响以DMSO为对照组,卵巢癌细胞A2780分别在2.5μmol/LVorinostat单药、10μg/mL CD146单抗AA98单药及两者联合用药作用48 h后检测各组细胞内AKT/mTOR通路及其下游分子p-4E-BP1、p-S6K1的蛋白变化情况。Western blotting结果显示,细胞中p-AKT、p-4E-BP1以及p-S6K1在Vorinostat作用后被显著上调,加用CD146单抗AA98可有效逆转AKT/mTOR通路的活化并减弱该活化效应,见图4。由此可见,CD146单抗AA98可逆转并抑制Vorinostat引起的AKT/mTOR通路活化作用,从而增强Vorinostat对卵巢癌细胞的杀伤效力。

图4 CD146单抗AA98对卵巢癌细胞A2780中AKT/mTOR通路的影响
3 讨论
卵巢癌是妇科恶性肿瘤中病死率最高的肿瘤,由于发病隐匿,约70%的患者确诊时已为晚期,5年生存率仅为30%。化疗耐药是卵巢癌治疗达完全缓解后复发和导致难治性的主要原因,目前尚无二线化疗方案的明确规范,是卵巢癌治疗中亟待解决的问题[13]。随着肿瘤分子生物学的深入研究,多种新型化疗药物的出现为攻克卵巢癌带来了曙光。2006年,Vorinostat作为第1个组蛋白去乙酰化酶抑制剂被美国FDA批准上市用于临床。其能抑制组蛋白去乙酰化酶,使乙酰化程度增高,重塑染色质为转录活性结构,影响多种基因的表达水平,从而诱导细胞生长阻滞、分化和凋亡。对血液系统肿瘤和包括卵巢癌在内的实体瘤均有较强的抑制作用,对正常组织、细胞无毒副作用。然而大量临床试验研究发现Vorinostat单药对卵巢癌患者治疗效果并不理想,常需与其他化疗药物联合应用以增强肿瘤杀伤效力[14-15]。既往研究发现多种肿瘤细胞在Vorinostat作用下出现黏附分子CD146异常升高,尤其在卵巢癌细胞中最为显著。本研究进一步证实了该现象,CD146 mRNA可被上调450多倍,蛋白水平亦可被Vorinostat显著性诱导表达。
CD146是近年来发现的一种具有跨膜结构的黏附分子,位于细胞膜表面,属于免疫球蛋白超家族成员。其包括5个Ig样结构域(V-V-C2-C2-C2)、1个跨膜区和1个位于细胞质内、有多个蛋白磷酸化结合位点的短尾。CD146显著表达于黑色素瘤细胞、滋养细胞和血管内皮细胞。其最初被鉴定为黑色素瘤标志分子,通过介导肿瘤细胞间、肿瘤-内皮细胞间的同型或异型黏附,促进黑色素瘤生长和血行转移。更深入研究发现,除黑色素瘤外,CD146还参与了多种疾病的发生和发展,如前列腺癌、乳腺癌等[16-20]。新近研究发现CD146与卵巢癌的发生、发展也密切相关,其同时表达于正常卵巢组织及卵巢癌组织,表达强度与卵巢癌发展阶段、严重程度、未分化型、转移范围及P53累积量高度相关,尤其是CD146的显著性表达预示着卵巢癌对一线化疗药物更易产生耐药性、卵巢癌更早的复发以及预后较差[21]。上述研究提示CD146可能与卵巢癌化疗耐药有关。本研究运用CD146单抗AA98阻断其在卵巢癌细胞株A2780、SKOV3中的表达水平可以明显增强化疗药物Vorinostat的杀伤效应,显著增加细胞凋亡率、降低细胞克隆形成率。析因方差分析结合金氏公式计算,结果表明Vorinostat联合AA98对卵巢癌细胞具有协同杀伤作用,联合用药组Q值均>1.15。深入研究CD146功能时还发现AA98可以逆转Vorinostat引起的CD146高表达,从而逆转并抑制卵巢癌细胞内磷脂酰肌醇3激酶(PI3K)/AKT/mTOR通路及其下游分子4E-BP1、S6K1的活化。
有研究报道,在黑色素瘤细胞中CD146与AKT存在相互作用,一方面补充外源性AKT可以上调胞内CD146的表达,另一方面补充外源性CD146可以激活内源性AKT、抑制促凋亡蛋白BAD表达从而引起肿瘤细胞凋亡抵抗、化疗敏感性降低[22]。大量实验证明,AKT介导的存活通路在抵抗细胞凋亡中起重要作用,其中PI3K/AKT/mTOR通路的激活及其下游靶点4E-BP1、S6K1的活化与肿瘤化疗耐药密切相关。当AKT激活后可以直接或间接地激活mTOR,mTOR是一个重要的丝氨酸/苏氨酸蛋白激酶,可激活下游靶蛋白对细胞生长和代谢进行调控。在调控过程中有2个重要的下游蛋白:4E-BP1和S6K1。S6K1活化后促进核糖体蛋白以及翻译调节蛋白的合成,从而对蛋白合成进行调节。4E-BPl通常与mRNA 5′帽状结合蛋白eIF24E结合并抑制其活性,进而抑制了翻译的开始。该通路中任意一个因子的磷酸化水平升高均与无病生存期降低有关[23-24]。本研究显示AA98逆转了Vorinostat引起的CD146高表达,阻断了其引起的PI3K/AKT/mTOR存活通路的激活,AA98与Vorinostat联用使p-AKT、p-4E-BP1、p-S6K1水平显著降低,减弱了卵巢癌细胞的抗凋亡能力,从而增强了Vorinostat的杀伤效力。
综上所述,本研究探索了黏附分子CD146对组蛋白去乙酰化酶抑制剂Vorinostat诱导卵巢癌细胞凋亡作用的影响,首次发现了CD146可被Vorinostat显著性诱导表达,高表达的CD146可能通过激活PI3K/AKT/mTOR存活通路而减弱了Vorinostat的杀伤效力,CD146单抗AA98可有效逆转并抑制该存活通路及下游分子4E-BP1、S6K1的活化,显著增强了卵巢癌细胞对Vorinostat的敏感度,Vorinostat联合CD146单抗具有协同杀伤作用,为卵巢癌化疗耐药的治疗新途径提供了理论基础。
[1]Suh DH,Lee KH,Kim K,et al.Major clinical research advances in gynecologic cancer in 2014[J].J Gynecol Oncol,2015,26(2):156-167.
[2]Jayson GC,Kohn EC,Kitchener HC,et al.Ovarian cancer[J]. Lancet,2014,384(9951):1376-1388.
[3]Vecchione A,Belletti B,Lovat F,et al.A microRNA signature defines chemoresistance in ovarian cancer through modulation of angiogenesis[J].Proc Natl Acad Sci U S A,2013,110(24):9845-9850.
[4]Zahedi P,Yoganathan R,Piquette-Miller M,et al.Recent advances in drug delivery strategies for treatment of ovarian cancer[J].Expert Opin Drug Deliv,2012,9(5):567-583.
[5]Zwergel C,Valente S,Jacob C,et al.Emerging approaches for histone deacetylase inhibitor drug discovery[J].Expert Opin Drug Discov,2015,10(6):599-613.
[6]West AC,Johnstone RW.New and emerging HDAC inhibitors for cancer treatment[J].J Clin Invest,2014,124(1):30-39.
[7]Slingerland M,Guchelaar HJ,Gelderblom H.Histone deacetylase inhibitors:an overview of the clinical studies in solid tumors[J]. Anticancer Drugs,2014,25(2):140-149.
[8]Huang Z,Peng S,Knoff J,et al.Combination of proteasome and HDAC inhibitor enhances HPV16 E7-specific CD8+T cell immune response and antitumor effects in a preclinical cervical cancer model [J].J Biomed Sci,2015,22:7.
[9]Straus DJ,Hamlin PA,Matasar MJ,et al.Phase I/II trial of vorinostat with rituximab,cyclophosphamide,etoposide and prednisone as palliative treatment for elderly patients with relapsed or refractory diffuse large B-cell lymphoma not eligible for autologous stem cell transplantation[J].Br J Haematol,2015,168(5):663-670.
[10]Rasheed WK,Johnstone RW,PrinceHM.Histonedeacetylase inhibitors in cancer therapy[J].Expert Opin Investig Drugs,2007,16(5):659-678.
[11]Ma X,Liu J,Wu J,et al.Synergistic killing effect between vorinostat and target of CD146 in malignant cells[J].Clin Cancer Res,2010,16(21):5165-5176.
[12]金正均.合并用药中的相加[J].中国药理学报,1980,1(2):70-73.
[13]Modugno F,Edwards RP.Ovarian cancer:prevention,detection,and treatment of the disease and its recurrence.Molecular mechanisms and personalized medicine meeting report[J].Int J Gynecol Cancer,2012,22(8):S45-S57.
[14]BotsM,JohnstoneRW.RationalcombinationsusingHDAC inhibitors[J].Clin Cancer Res,2009,15(12):3970-3977.
[15]Khabele D.The therapeutic potential of class I selective histone deacetylase inhibitors in ovarian cancer[J].Front Oncol,2014,4:111.
[16]Wang Z,Yan X.CD146,a multi-functional molecule beyond adhesion[J].Cancer Lett,2013,330(2):150-162.
[17]Xie S,Luca M,Huang S,et al.Expression of MCAM/MUC18 by human melanoma cells leads to increased tumor growth and metastasis[J].Cancer Res,1997,57(11):2295-2303.
[18]Wu GJ,Wu MW,Wang SW,et al.Isolation and characterization of the major form of human MUC18 cDNA gene and correlation of MUC18 over-expression in prostate cancer cell lines and tissues with malignant progression[J].Gene,2001,279(1):17-31.
[19]Zabouo G,Imbert AM,Jacquemier J,et al.CD146 expression is associated with a poor prognosis in human breast tumors and with enhanced motility in breast cancer cell lines[J].Breast Cancer Res,2009,11(1):R1.
[20]Leslie MC,Zhao YJ,Lachman LB,et al.Immunization against MUC18/MCAM,a novel antigen that drives melanoma invasion and metastasis[J].Gene Ther,2007,14(4):316-323.
[21]Aldovini D,Demichelis F,Doglioni C,et al.M-CAM expression as marker of poor prognosis in epithelial ovarian cancer[J].Int J Cancer,2006,119(8):1920-1926.
[22]Li G,Kalabis J,Xu X,et al.Reciprocal regulation of MelCAM and AKT in human melanoma[J].Oncogene,2003,22(44):6891-6899.
[23]Ciuffreda L,Di Sanza C,Incani UC,et al.The mTOR pathway:a new target in cancer therapy[J].Curr Cancer Drug Targets,2010,10(5):484-495.
[24]Vasudevan KM,Garraway LA.AKT signaling in physiology and disease[J].Curr Top Microbiol Immunol,2010,347:105-133.
Effect of Adhesion Molecular CD146 on Apoptosis of Ovarian Cancer Cell Induced by Vorinostat
MA Xiao-li,LIU Yusheng,YAN Xi-yun,GUO Yin-shu,DUAN Hua,MA Ding.Department of Gynecology Minimally Invasive Center,Beijng Obstetrics and Gynecology Hospital,Capital Medical University,Beijing 100006,China(MA Xiao-li,LIU Yu-sheng,GUO Yin-shu,DUAN Hua);Institute of Biophysics,The Chinese Academy of Sciences,Beijing 100101,China(YAN Xi-yun);Department of Obstetrics and Gynecology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China(MA Ding)
DUAN Hua,E-mail:duanhua888@163.com
Objective:To investigate the effect of adhesion molecular CD146 expression on apoptosis of ovarian cancer cells induced by Vorinostat.Methods:CD146 expression levels in A2780 and SKOV3 cells were detected after Vorinostat treatment by Real-time PCR and Western blot.The effect of CD146 mAb AA98 on cell apoptosis and colony-forming ability under Vorinostat treatment by FACS and Soft agar colony-forming assay.The synergistic effect of Vorinostat and AA98 was analyzed by gold formula method.Comparison of effect on AKT/mTOR signaling pathway and the downstream molecular between ovarian cancer cells treated by Vorinostat alone or plus with AA98.Results:CD146 was significantly induced by Vorinostat in ovarian cancer cells.Upregulation of CD146 is closely related to chemosensitivity.Combined Vorinostat and AA98 significantly improved cell apoptotic rate and ablated cancer colony formation.The difference was statistically significant(P<0.05).The synergistic effect after treatment with a combination of Vorinostat with AA98 was proved by gold formula method.AA98 could reduce the activation of AKT/mTOR signaling pathway caused by Vorinostat and could decrease the p-AKT,p-4E-BP1,p-S6K1 protein levels in ovarian cancer cells(P<0.05).Conclusions:Vorinostat significantly induced the expression of CD146, which might decrease the chemosensitivity of ovarian cancer cells.CD146 mAb may reverse and inhibit the activation of AKT/ mTOR signaling pathway caused by Vorinostat and substantially enhance killing of ovarian cancer cells.The two drugs have obvious synergistic antitumor effects.
Ovarian neoplasms;Antigens,CD146;Antineoplastic agents;Vorinostat;Apoptosis;Synergistic effect
2016-08-08)
[本文编辑王昕]
国家自然科学基金(81101970);北京市科技新星计划(Z141107001814015);北京市医管局重点医学发展项目扬帆计划(ZYLX201406)
100006北京,首都医科大学附属北京妇产医院妇科微创中心(马晓黎,刘雨声,郭银树,段华);中国科学院生物物理研究所(阎锡蕴);华中科技大学同济医学院附属同济医院妇产科(马丁)
段华,E-mail:duanhua888@163.com
#共同第一作者
