低表达miR-338-3p诱导内皮细胞EOMA炎症反应
2017-01-06于淑倩隋小芳王凤玲苑露丹张培培
于淑倩,隋小芳,王凤玲,苑露丹,刘 宇,张培培
(佳木斯大学附属第一医院 老年病科,黑龙江 佳木斯154002)
低表达miR-338-3p诱导内皮细胞EOMA炎症反应
于淑倩,隋小芳*,王凤玲,苑露丹,刘 宇,张培培
(佳木斯大学附属第一医院 老年病科,黑龙江 佳木斯154002)
目的 研究miR-338-3p在内皮细胞EOMA炎症反应中的作用。方法 用TNF-α 20 ng/ml处理内皮细胞系EOMA 24 h,实时荧光定量PCR检测miR-338-3p、黏附因子VCAM-1和ICAM-1 mRNA表达水平,Western blot分析ERK及p38 MAPK信号通路活性;构建miR-338-3p低表达腺病毒载体(miR-338-3p inhibitor),感染EOMA细胞48 h,PCR检测miR-338-3p、VCAM-1及ICAM-1 mRNA表达水平,Western blot分析ERK及p38 MAPK信号通路活性。结果 TNF-α 20 ng/ml处理EOMA细胞 24 h miR-338-3p表达水平下降,ERK及p38蛋白磷酸化水平升高,VCAM-1及ICAM-1 mRNA表达水平升高;miR-338-3p inhibitor 感染EOMA细胞48 h,miR-338-3p表达水平明显降低,ERK及p38蛋白磷酸化水平明显升高,黏附因子VCAM-1及ICAM-1 mRNA基因表达水平升高。结论 在内皮细胞EOMA炎症模型中,TNF-α下调miR-338-3p表达水平;低表达miR-338-3p激活MAPK信号通路活性,增强黏附因子表达水平,诱导EOMA细胞炎症反应。
miR-338-3p;内皮细胞;炎症反应;黏附因子
(ChinJLabDiagn,2016,20:2002)
动脉粥样硬化是一种炎症性疾病[1]。研究表明,miRNA参与调控许多病理生理学机制如炎症炎介质产生、细胞黏附、增殖、凋亡、脂质摄取与流出等,并参与调控炎症信号通路活性,对动脉硬化发生发展有着重要的调节作用[2,3]。近年来有报道指出miR-338-3p与糖尿病心肌病有关[4],并参与肿瘤细胞分化、增殖及迁徙[5]。然而miR-338-3p是否参与调节内皮细胞炎症反应尚未见报道。因此,研究miR-338-3p在血管内皮炎症反应中的作用及其机制,为基因靶向治疗动脉硬化提供理论基础。
1 材料与方法
1.1 材料
EOMA细胞(小鼠血管瘤内皮细胞珠,购于中国医学科学院细胞库);H-DMEM 培养基(Invitrogen公司);FBS胎牛血清(Hyclone公司);TNF-α (Epitomics公司);HRP标记的羊抗兔IgG相关抗原抗体(北京中杉金桥生物技术有限公司);miR-338-3p低表达腺病毒载体(AD-338-3p inhibitor)(构建与纯化由上海吉凯科技有限公司完成);SYBR Premix Ex Taq II(日本TAKARA);Rabbit GAPDH Antibody(美国CST);磷酸化丝裂原活化蛋白激酶(p-ERK)抗体、ERK抗体、磷酸化p38丝裂原活化蛋白激酶抗体及p38抗体均购于美国CST。
1.2 细胞培养
EOMA细胞用含10%胎牛血清FBS的高糖培养基H-DMEM 于37℃、5% CO2培养箱内培养。
1.3 检测miR-338-3p在内皮损伤中的表达
将EOMA细胞接种于六孔板中,分别设为对照组和TNF-α处理组。对照组正常培养,TNF-α处理组用TNF-α 20 ng/ml处理内皮细胞24 h。收集细胞,提取细胞总RNA,逆转录miRNA合成cDNA,用SYBR Green荧光定量试剂盒和实时荧光定量PCR仪检测miR-338-3p表达,以U6作为内参进行比较,结果用2-ΔΔct计算相对表达量。引物设计如下:
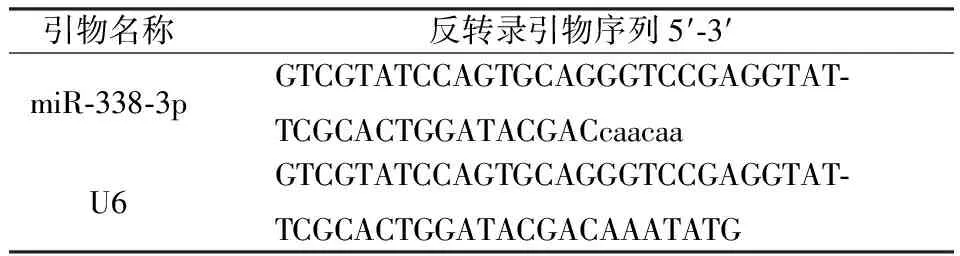
引物名称反转录引物序列5′⁃3′miR⁃338⁃3pGTCGTATCCAGTGCAGGGTCCGAGGTAT⁃TCGCACTGGATACGACcaacaaU6GTCGTATCCAGTGCAGGGTCCGAGGTAT⁃TCGCACTGGATACGACAAATATG
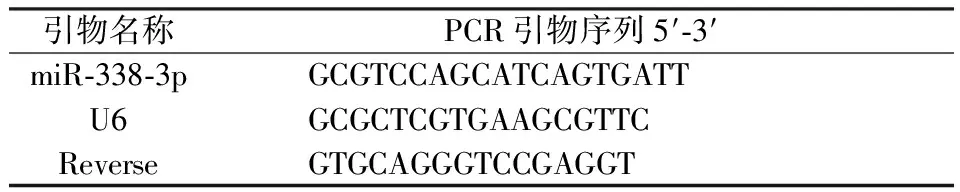
引物名称PCR引物序列5′⁃3′miR⁃338⁃3pGCGTCCAGCATCAGTGATTU6GCGCTCGTGAAGCGTTCReverseGTGCAGGGTCCGAGGT
1.4 观察内皮损伤后黏附因子表达和MAPK信号通路变化
上述细胞逆转录cDNA用PCR检测黏附因子VCAM-1和ICAM-1的表达水平。提取上述两组细胞总蛋白,Western blot 分析ERK及p38 MAPK信号通路变化。VCAM-1和ICAM-1及内参18S的引物设计如下:

引物名称PCR引物序列5′⁃3′VCAM⁃1ForwardCACTTGTGGAAATGTGCCCGVCAM⁃1ReverseTCACACTCGTATATGCCGGCICAM⁃1ForwardTTTTCAGCTCCGGTCCTGACICAM⁃1ReverseCCGCTCAGAAGAACCACCTT18sForwardGGAAGGGCACCACCAGGAGT18sReverseTGCAGCCCCGGACATCTAAG
1.5 低表达miR-338-3p对内皮细胞炎症反应信号通路变化
构建miR-338-3p低表达腺病毒载体(338i)和阴性对照病毒(NCi),分别感染EOMA细胞48小时。收集细胞,PCR 检测miR-338-3p表达及黏附因子VCAM-1和ICAM-1 mRNA的表达变化,Western blot分析ERK及p38 磷酸化水平。
1.6 统计学分析
应用SPSS 17.0统计软件,采用t检验和单因素方差分析进行数据处理,以GraphPad Prism 5.0软件绘制统计图,95%可信区间,P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α 下调EOMA细胞中miR-338-3p的表达水平,激活MAPK信号通路活性,引起炎症反应
与对照组比较,TNF-ɑ处理EOMA细胞24小时miR-338-3p的表达水平明显降低(图1 A),同时黏附因子VCAM-1及ICAM-1 mRNA 表达水平升高(图1 B、C),Western blot 分析p-ERK及p-p38相对表达水平较对照组升高明显(图1 D)。结果表明,TNF-ɑ降低EOMA细胞中miR-338-3p表达水平,升高ERK/p38磷酸化水平,并增加黏附因子表达水平,引起炎症反应,miR-338-3p可能参与其中。
2.2 低表达miR-338-3p 增强MAPK信号通路活性,上调黏附因子表达,诱导EOMA细胞炎症反应
用miR-338-3p 低表达腺病毒及其阴性对照病毒分别转染内皮细胞EOMA 48小时,结果显示,与对照组比较miR-338-3p 表达水平明显下降约40%(图2 A),黏附因子VCAM-1及ICAM-1的表达水平明显升高(图2 B、C);同时Western blot分析p-ERK及p-p38 相对表达量明显升高(图 2 D)。结果表明,低表达miR-338-3p能够加强MAPK信号通路活性,增加内皮细胞黏附因子VCAM-1及ICAM-1 mRNA的表达,从而诱导内皮细胞炎症反应。

A.miR-338-3p表达水平;B.黏附因子VCAM-1表达水平;C.黏附因子ICAM-1表达水平;D.ERK/p38 MAPK 信号通路蛋白表达水平(n=3,*P<0.05,**<0.01))
图1 TNF-ɑ 诱导内皮损伤产生炎症反应

A.miR-338-3p表达水平;B.黏附因子VCAM-1表达水平;C.黏附因子ICAM-1表达水平;D.ERK/p38 MAPK信号通路蛋白表达变化(n=3,*P<0.05,**<0.01,***<0.001)
图2 低表达miR-338-3p(miR-338-3p inhibitor)促进EOMA细胞炎症反应
3 讨论
据报道,心血管疾病在亚洲、非洲、南美等发展中国家的发病率高于5%,然而北美、欧洲、澳大利亚等发达国家的发病率不足3%,预测到2020年,心血管疾病死亡率居全球第一[6]。与心血管疾病最直接相关便是动脉粥样硬化。动脉粥样硬化是首先发生于动脉血管壁内皮细胞的一种并发炎症性疾病[7],各种危险因素如糖尿病、高血压、血脂异常、肥胖、吸烟等都能导致血管内皮损伤[6]。研究证实一些炎症介质如IL-6、黏附因子ICAM-1、单核细胞趋化蛋白MCP-1及氧化应激参与炎症反应发生[8]。因此,探究内皮损伤炎症反应发生的机制,将有助于对动脉硬化及心血管疾病的认识。
炎性因子是导致动脉粥样硬化的重要因素。巨噬细胞、自然杀伤细胞及平滑肌细胞分泌肿瘤坏死因子α(TNF-α)、白介素-1(IL-1)和IL-6[9]。TNF-α能够诱导内皮细胞损伤,降低NO,增加VCAM-1表达水平[10],激活p38MAPK/NF-КB信号通路活性[11],导致细胞黏附性增强、炎性细胞趋化,从而产生炎症反应。
一些miRNA如miR-181b[12]、miR-146a及miR-146b通过抑制抑制内皮细胞炎症反应进而调控动脉硬化[13]。本研究发现,TNF-α处理内皮细胞,miR-338-3p的表达水平明显降低,ERK及p38磷酸化水平明显升高,黏附因子VCAM-1及ICAM-1的表达增多。结果表明TNF-α能够抑制EOMA细胞中miR-338-3p的表达水平,且TNF-α能够诱导内皮细胞损伤产生炎症反应,提示miR-338-3p可能参与TNF-α诱导的内皮细胞损伤的炎症反应。此外,我们还发现EOMA细胞中低表达miR-338-3p能够增强ERK及p38蛋白磷酸化水平,升高细胞黏附因子VCAM-1及ICAM-1表达水平,结果表明低表达miR-338-3p能够诱导EOMA细胞炎症反应。
综上所述,TNF-α能抑制EOMA细胞中miR-338-3p表达,且低表达miR-338-3p能诱导内皮细胞炎症反应。本文揭示了miR-338-3p可能参与调控血管内皮炎症反应,为动脉粥样硬化提供新的治疗靶点和方向,但其具体调控机制尚需进一步深入探讨。
[1]Georgescu A,Alexandru N,Andrei E,et al.Effects of transplanted circulating endothelial progenitor cells and platelet microparticles in atherosclerosis development[J].Biology of the Cell,2016.
[2]Feinberg M W,Moore K J.MicroRNA regulation of atherosclerosis[J].Circulation research,2016,118(4):703.
[3]李雪杰,隋小芳,王凤玲,等.抑制 miRNA-291b-3p 表达对 H9C2 细胞胰岛素信号通路活性的影响[J].中国实验诊断学,2016,20(1):25.
[4]Chavali V,Tyagi S C,Mishra P K.Differential expression of dicer,miRNAs,and inflammatory markers in diabetic Ins2+/? Akita hearts[J].Cell biochemistry and biophysics,2014,68(1):25.
[5]Kos A,Loohuis N F M O,Wieczorek M L,et al.A potential regulatory role for intronic microRNA-338-3p for its host gene encoding apoptosis-associated tyrosine kinase[J].PLoS One,2012,7(2):e31022.
[6]Husain K,Hernandez W,Ansari R A,et al.Inflammation,oxidative stress and renin angiotensin system in atherosclerosis[J].World journal of biological chemistry,2015,6(3):209.
[7]Zhang Y,Qin W,Zhang L,et al.MicroRNA-26a prevents endothelial cell apoptosis by directly targeting TRPC6 in the setting of atherosclerosis[J].Scientific reports,2015,5.
[8]Allahverdian S,Pannu P S,Francis G A.Contribution of monocyte-derived macrophages and smooth muscle cells to arterial foam cell formation[J].Cardiovascular research,2012:cvs094.
[9]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiological reviews,2006,86(2):515.
[10]Zheng X K,Liu C X,Zhai Y Y,et al.Protection effect of amentoflavone in Selaginella tamariscina against TNF-alpha-induced vascular injury of endothelial cells[J].Acta pharmaceutica Sinica,2013,48(9):1503.
[11]Chan F K M,Siegel R M,Lenardo M J.Signaling by the TNF receptor superfamily and T cell homeostasis[J].Immunity,2000,13(4):419.
[12]Sun X,Icli B,Wara A K,et al.MicroRNA-181b regulates NF-κB-mediated vascular inflammation[J].The Journal of clinical investigation,2012,122(6):1973.
[13]Cheng H S,Sivachandran N,Lau A,et al.MicroRNA-146 represses endothelial activation by inhibiting pro-inflammatory pathways[J].EMBO molecular medicine,2013,5(7):1017.
MiR-338-3p low expression promotes inflammatory response signaling pathway in EOMA cells
YUShu-qian,SUIXiao-Fang*,WANGFeng-ling,etal.
(DepartmentofGeriatrics,theFirstAffiliatedHospitalofJiamusiUniversity,Jiamusi154002,China)
Objective To study the role of miR-338-3p in the inflammatory response of endothelial cell line EOMA.Methods EOMA cells were treated with TNF-α 20 ng/ml,using Real-time PCR to detect the expression levels of miR-338-3p,adhesion factor VCAM-1 and ICAM-1,and western blot analysis of ERK and p38 MAPK signaling pathway activity.In order to decrease the expression of miR-338-3p,EOMA cells were transfected with miR-338-3p inhibitor for 48 hours.The expression of miR-338-3p and adhesion factor,such as VCAM-1 and ICAM-1 were detected by Real-time PCR.The protein associated with MAPK signaling pathway in this study were analysis of western blot.Results The expression of miR-338-3p was reduced and adhesion factor VCAM-1 and ICAM-1 expression was enhanced by endothelial cells EOMA treated with TNF-α 20 ng/ml for 24 hours.Western blot analysis of ERK/p38 MAPK signaling pathway activity was enhanced in endothelial cells induced by TNF-α.Down regulation of miR-338-3p expression was accompanied by enhancing expression of VCAM-1 and ICAM-1,and activating MAPK signaling pathway activity in endothelial cells EOMA infected with miR-338-3p inhibitor.Conclusion The expression of miR-338-3p was down regulated in EOMA cells induced treated with TNF-α;miR-338-3p inhibitor induced the inflammatory response of endothelial cells by activating the MAPK signaling pathway and enhancing the expression of adhesion molecules.
miR-338-3p;endothelial cells;inflammatory response;adhesion factor
黑龙江省自然基金面上项目(项目编号:H2015076); 佳木斯大学研究生科技创新重点项目(项目编号:YZ2016_020)
1007-4287(2016)12-2002-04
R392
A
于淑倩(1987-),在读硕士研究生;隋小芳(1976-),女,副主任医师,硕士研究生导师,主要从事老年心血管疾病的临床与基础研究。
2016-04-21)
*通讯作者
