癌基因YAP1促进三阴性乳腺癌细胞生长迁移和肿瘤形成
2017-01-06胡丽梅
胡丽梅
(白城中心医院,吉林 白城137000)
癌基因YAP1促进三阴性乳腺癌细胞生长迁移和肿瘤形成
胡丽梅
(白城中心医院,吉林 白城137000)
目的 研究YAP1在三阴性乳腺癌中的表达及其对乳腺癌细胞的影响。方法 采用免疫组织化学的方法在30例三阴性乳腺癌样本中进行YAP1染色;通过RNA干扰技术研究YAP1对三阴性乳腺癌细胞MDA-MB-231的增殖、迁移及皮下成瘤的影响。结果 与对照的正常乳腺组织相比,三阴性乳腺癌样本中YAP1的表达量显著升高;在MDA-MB-231细胞中敲低YAP1能够显著抑制其细胞增殖、迁移及肿瘤形成能力。结论 YAP1是潜在的三阴性乳腺癌诊断标志物和治疗靶点。YAP1可以通过影响乳腺癌细胞的增殖和迁移来促进三阴性乳腺癌的发生发展。
YAP1;三阴性乳腺癌;细胞增殖;细胞迁移
(ChinJLabDiagn,2016,20:1995)
乳腺癌是女性排名第一的常见恶性肿瘤,约占女性新发恶性肿瘤的30%[1]。大部分的乳腺癌可以通过手术和放化疗进行治疗,然而一些恶性程度比较高的乳腺癌,如三阴性乳腺癌,仍然威胁着患者的生命。三阴性乳腺癌是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(Her-2)均为免疫组织化学检测阴性的一种乳腺癌病理类型,占所有乳腺癌的15%[2]。相对于其它乳腺癌分型,三阴性乳腺癌预后更差且发病年龄更年轻[2]。遗憾的是,目前并没有针对三阴性乳腺癌的标准治疗指南。因此,加快三阴性乳腺癌的早期诊断和治疗靶点的寻找成为乳腺癌研究的重要问题。
Hippo 信号通路是从果蝇到哺乳动物中高度保守的一条信号通路,这条信号通路可以同时调控细胞增殖和凋亡来调节组织器官大小。近年,Hippo信号通路在人类肿瘤中的研究备受关注[3,4]。Hippo 信号通路由一条激酶链和转录共激活子组成。简单来说,上游信号激活MST1/2(serine/threonine kinase 4/3)和它的调节亚基SAV1 (Salvador family WW domain containing protein 1),它们相互结合后促进MST1/2的活化并进一步磷酸化LATS1/2 (large tumor suppressor kinase 1/2)[5];当LATS1/2被激活后,YAP1/TAZ (yes associated protein 1/WW domain containing transcription regulator 1)立刻被其磷酸化而并定位在细胞浆中,从而限制了YAP1/TAZ进入细胞核中执行转录激活的功能。与此同时,细胞核中的转录因子 TEAD(TEA domain transcription factor family)失去了YAP/TAZ 的结合和共激活作用,直接导致下游转录基因表达下调,从而降低细胞增殖速度和迁移能力[6-10]。越来越多的研究表明, Hippo信号通路的成员在多种肿瘤中发生突变或扩增。例如,NF2在脑瘤中多发突变[11];LATS2 表达量降低直接导致白血病对化疗药物敏感性降低[12];TAZ在20%的侵润性乳腺癌肿组织样本高表达,其表达量与乳腺癌恶性程度成正相关[13,14];而YAP1被发现在前列腺癌和肝癌的染色体上发生扩增[15]。这些数据表明Hippo信号通路的活化程度与肿瘤的发生发展密切相关。然而,关于Hippo信号通路与三阴性乳腺癌的研究非常有限。本研究旨在揭示YAP1与三阴性乳腺癌之间的关联。
本研究检测了30例三阴性乳腺癌样本中YAP1的表达,染色结果表明YAP1在三阴性乳腺癌中过量表达,提示YAP1可能成为三阴性乳腺癌早期诊断的分子标志物。另外,YAP1的过量表达也预示着其在三阴性乳腺癌发生发展中扮演重要角色。细胞水平的研究表明YAP1可以促进三阴性乳腺癌细胞的增殖、迁移和皮下成瘤能力。因此,靶向YAP1是一个潜在的三阴性乳腺癌的治疗方向。
1 材料与方法
1.1 材料 人胚胎肾细胞HEK293T和乳腺癌MDA-MB-231细胞由本实验是保存;DMEM培养基和胎牛血清购于Invitrogen公司;脂质体转染试剂盒Lipofectamine2000 购自Invitrogen公司;transwell小室购自于BD公司;YAP1 抗体购买于Cell Signaling Technology公司。pMKO-shYAP1(TRCN0000107266和TRCN0000107267)质粒购买于Sigma公司。
1.2 方法
1.2.1 免疫组织化学 5 μm厚的人乳腺癌样本切片经65℃二甲苯脱蜡以及梯度酒精水化后,在柠檬酸缓冲液中进行抗原修复。具体修复条件为:95℃,30 min;121℃高压,10 s;温度降至85℃后室温放置20 min。自来水冲洗3次后,用3%过氧化氢灭活内源性过氧化物酶。30 min后,TBST(Tris-buffered saline,0.1% Tween 20)洗涤3次,5 min。然后用10%马血清封闭1 h。YAP1抗体按照1∶100稀释于封闭液中并均匀覆盖在组织切片表面,切片置于湿盒中4℃过夜。次日,切片用TBST洗涤3次,每次5 min,然后加入辣根过氧化物酶标记的二抗,室温孵育1 h。经TBST洗涤后进行DAB显色。最后进行苏木素复染、封片和拍照。三位研究者双盲情况下对YAP1的表达水平给予评分(0-3分)。
1.2.2 YAP1敲低细胞株的建立 将状态良好的HEK293T传代。次日,按VSVG:GAG:pMKO-shYAP1(或pMKO空载体)=2∶2∶3的比例进行转染(具体操作参照 Invitrogen 说明书),6 h后换液。转染24 h后开始收集培养基中的病毒,每隔8 h收集1次。通过3 000 rpm/min离心将收集好的病毒中残留的HEK293T细胞去除后,用上清中的反转录病毒感染密度约40%的三阴性乳腺癌MDA-MB-231细胞。感染48 h后开始加入嘌呤霉素筛选5 d至无细胞死亡。进行细胞冻存以及细胞增殖、迁移和体外成瘤实验。
1.2.3 免疫印迹 在1×107状态良好的细胞中加入1 ml 细胞裂解液(50 mM Tris,150 mM NaCl,0.5%NP40,新鲜加入蛋白酶抑制剂)于冰上裂解30 min。将裂解后的蛋白加入上样缓冲液后在99℃煮10 min。10%丙烯酰胺凝胶电泳后,将蛋白转移到硝酸纤维素膜上。5%牛奶室温封闭1 h后,加入YAP1抗体4℃过夜。次日,TBST洗涤3次后,加入二抗室温孵育1 h。最后显色并于暗室显影。
1.2.4 细胞增殖实验 取处于对数生长期的稳定表达pMKO-shYAP1细胞或者对照细胞进行胰酶消化及细胞计数;6孔板中每孔种植3×105个细胞,每个时间点设立三个重复。在生长曲线计数过程中,隔天更换新鲜的细胞培养液。从种植后第二天开始,每天用红血球计数板进行计数。
1.2.5 细胞迁移实验 稳定表达pMKO-shYAP1细胞或者对照细胞经过血清饥饿16 h后,胰酶消化及细胞计数,将细胞用无血清DMEM培养基悬浮;在24孔板下室中加入600 μl含5%胎牛血清的培养基,然后将小室放在24孔板中;取1×105个细胞加入Transwell小室,培养24 h;吸掉小室上层培养基,用PBS洗涤两次,然后用4%多聚甲醛室温固定20 min;用棉签擦去上层小室内的细胞;将整个Transwell小室浸入到0.1%结晶紫中染色10 min,显微镜下拍照(拍摄小室的正中以及上下左右的5个视野),计算穿过Transwell膜的细胞数。
1.2.6 皮下成瘤实验 取处于对数生长期的稳定表达pMKO-shYAP1细胞或者对照细胞进行胰酶消化及细胞计数;将细胞以1×107的密度悬浮于PBS中,然后以皮下注射的方式注入到5-6周大的雌性BALB/c裸鼠中。每只裸鼠注射1×106个细胞,每个实验组设立14只裸鼠。定期观察裸鼠成瘤及健康状况,四周后处死裸鼠,取出皮下肿瘤进行质量称重及拍照。
2 结果
2.1 YAP1在三阴性乳腺癌样本中高表达 免疫组织化学染色结果表明,YAP1 在正常乳腺导管上皮细胞中呈中等表达,而在三阴性乳腺癌样本中则大量表达(图 1)。对YAP1染色强度进行多名研究者双盲打分后,统计学分析显示YAP1在三阴性乳腺癌中表达量显著高于正常乳腺组织(图 1)。提示YAP1可能参与三阴性乳腺癌的发生和发展。另外,YAP1也是潜在的三阴性乳腺癌诊断标志物。

图1 YAP1 在三阴性乳腺癌中的表达
免疫组织化学方法检测YAP1在正常乳腺导管上皮细胞(左)和三阴性乳腺癌肿瘤细胞(中)中的表达,进一步统计学分析比较YAP1在正常和肿瘤组织中的表达差异(右)。免疫组化图片为20倍放大。
2.2 特异性敲低三阴性乳腺癌细胞中YAP1的表达 为了研究YAP1在三阴性乳腺癌细胞中的作用,研究者运用RNA干扰技术特异性靶向三阴性乳腺癌细胞MDA-MB-231内的YAP1。如图2所示,MDA-MB-231细胞中的YAP1表达量降低了90%。为了防止RNA干扰技术的脱靶效应,2条不同的shRNA被选择进行敲低实验。稳定敲低YAP1表达的细胞株的建立为后续研究YAP1对三阴性乳腺癌细胞的增殖、迁移和皮下成瘤能力的影响奠定了基础。
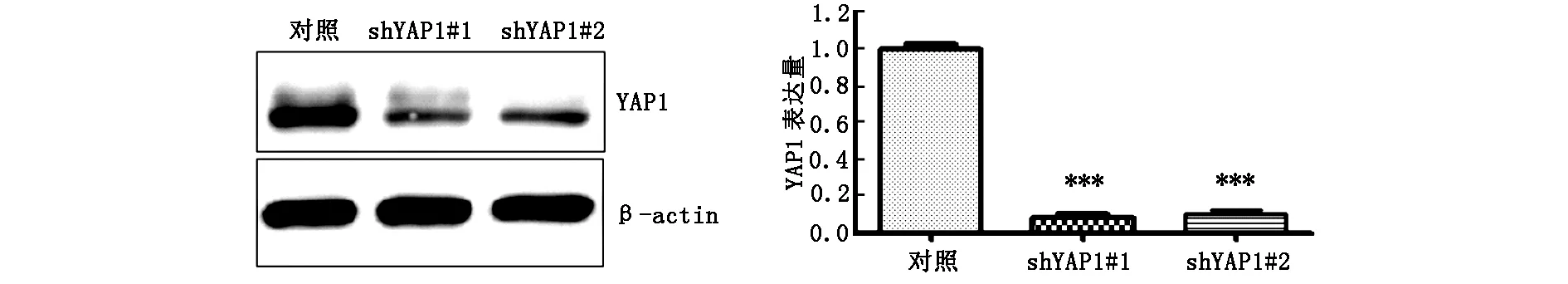
图2 特异性敲低YAP1的表达
免疫印迹检测shRNA干扰技术建立的稳定敲低YAP1的细胞株中YAP1表达量的变化,β-actin在这里视为内参(左)。免疫印迹的灰度值定量分析比较对照和shYAP1敲低细胞中YAP1的表达水平(右)。***表示P<0.001。
2.3 敲低YAP1抑制三阴性乳腺癌细胞增殖和迁移 Hippo信号通路在肿瘤中的作用主要表现在精密调控细胞增殖、迁移、浸入和上皮-间充质转化等生物学过程。正如之前的研究报道,YAP1能够显著促进肿瘤细胞的增殖和迁移[15],因此研究者利用RNA干扰技术来检测YAP1对于三阴性乳腺癌细胞的增殖和迁移能力的影响。如图 3(左)所示,在三阴性乳腺癌细胞中给敲低YAP1后,细胞的增殖活力明显减慢。同时,transwell实验表明,敲低YAP1显著降低了MDA-MB-231细胞的迁移能力(图 3右)。
2.4 敲低YAP1抑制三阴性乳腺癌细胞皮下成瘤能力 裸鼠皮下成瘤模型是检验肿瘤细胞成瘤能力的常规实验。为了测定YAP1敲低是否能够影响三阴性乳腺癌的肿瘤形成能力,我们进行了裸鼠皮下成瘤实验。如图 4所示,YAP1敲低的MDA-MB-231细胞仍然能够在裸鼠体能形成肿瘤,但是肿瘤的体积和质量较对照组显著减小。这一结果提示,如果能够有效干预三阴性乳腺癌中YAP1的表达,则可以显著减小肿瘤的大小。因此YAP1是一个潜在的三阴性乳腺癌的治疗靶标。
3 讨论
相对于其它病理类型的乳腺癌,三阴性乳腺癌患者具有较差的预后。这一现象的主要原因有两个方面:不能有效的早期诊断和没有行之有效的治疗方案。究其根本,在于三阴性乳腺癌缺少早期诊断的标志物和靶向治疗药物的靶点。本研究表明,YAP1在三阴性乳腺癌中高表达,成为潜在的诊断标志物。同时。在三阴性乳腺癌细胞中敲低YAP1能够显著抑制肿瘤细胞增殖、迁移和皮下成瘤能力。这一发现首次将YAP1和三阴性乳腺癌联系起来,而且在细胞水平上提供了YAP1促进三阴性乳腺癌发生发展的证据。进一步的研究可以尝试用Hippo信号通路的靶向药物,如维替泊芬,来干预三阴性乳腺癌细胞的增殖、迁移和成瘤能力,为下一步的临床研究奠定基础。

图3 YAP1影响三阴性乳腺癌细胞的增殖和迁移

图4 YAP1影响三阴性乳腺癌细胞的成瘤能力
在MDA-MB-231细胞中敲低YAP1后,将细胞注射入裸鼠皮下,4周后取出瘤体拍照(左)。同时肿瘤的重量被记录后进行统计分析比较对照组和YAP1敲低组之间肿瘤重量的差别。***表示P<0.001。
[1]Slamon DJ,Clark GM,Wong SG,et al.Human brast cancer:correlation of relapse and survivsl with amplification of the HER-2/neu oncogene[J].J Science,1987,235(4785):177.
[2]Foulkes WD,Smith IE,Reis-Filho JS.Triple-negative breast cancer[J]. N Engl J Med,2010,363(20):1938.
[3]Pan D.The hippo signaling pathway in development and cancer[J].J Dev Cell,2010,19: 491.
[4]Zhao B,Li L,Lei Q,et al.The Hippo-YAP pathway in organ size control and tumorigenesis: an updated version[J].J Genes Dev,2010a,24: 862.
[5]Chan EH,Nousiainen M,Chalamalasetty RB,et al.The Ste20-like kinase Mst2 activates the human large tumor suppressor kinase LATS1[J].J Oncogene,2005,24: 2076.
[6]Zhao B,Wei X,Li W,et al.Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control[J].J Genes Dev,2007,21: 2747.
[7]Zhao B,Ye X,Yu J,et al.TEAD mediates YAP-dependent gene induction and growth control[J].J Genes Dev,2008,22:1962.
[8]Lei QY,Zhang H,Zhao B,et al.TAZ promotes cell proliferation and epithelial-mesenchymal transition and is inhibited by the hippo pathway[J].J.Mol Cell Biol,2008,28:2426.
[9]Zhang H,Liu CY,Zha ZY,et al.TEAD Transcription Factors Mediate the Function of TAZ in Cell Growth and Epithelial-Mesenchymal Transition[J].J Biol Chem,2008,284: 13355.
[10]Zhao B,Li L,Tumaneng K,et al.A coordinated phosphorylation by Lats and CK1 regulates YAP stability through SCF(beta-TRCP)[J].J Genes Dev,2010b,24: 72.
[11]McClatchey AI,Giovannini M.Membrane organization and tumorigenesis-the NF2 tumor suppressor,Merlin[J].J Genes Dev,2005,19: 2265.
[12]Masahiro Kawahara,Toshiyuki Hori,Kazuhisa Chonabayashi,et al.Kpm/LATS2 is linked to chemosensitivity of leukemic cells through the stabilization of p73[J].J Blood,2008,112: 3856.
[13]Chan SW,Lim CJ,Guo K,et al.A role for TAZ in migration,invasion,and tumorigenesis of breast cancer cells[J].J Cancer Res,2008,68: 2592.
[14]Cordenonsi M,Zanconato F,Azzolin L,et al.The Hippo transducer TAZ confers cancer stem cell related traits on breast cancer cells[J].J Cell,2011,147: 759.[15]Overholtzer M,Zhang J,Smolen GA,et al.Transforming properties of YAP,a candidate oncogene on the chromosome 11q22 amplicon[J].J Proc Natl Acad Sci USA,2006,103: 12405.
Oncogenic protein YAP1 promotes triple-negative breast cancer cells proliferation,migration and tumorigenesis
HULi-mei.
(BaichengCentralHospital,Baicheng137000,China)
Objective To study the expression level of YAP1 in triple-negative breast cancer samples,and demonstrate the functional role of YAP1 in breast cancer cell.Methods IHC was performed for YAP1 staining in 30 pairs of triple-negative breast cancer specimens,and the staining intensity of YAP1 was scored;the effect of YAP1 on the proliferation,migration and tumorigenesis of triple-negative breast cancer cell line MDA-MB-231 was determined by shRNA knockdown system.Results compared with the normal breast tissue,triple-negative breast cancer samples have significantly higher level of YAP1 expression.Functionally,YAP1 could promote the proliferation,migration and tumorigenesis of triple-negative breast cancer cell line MDA-MB-231.Conclusion Our results indicate that YAP1 may serve as a biomarker for triple-negative breast cancer,and YAP1 could be a potential therapeutic target of triple-negative breast cancer via manipulating breast cancer cell proliferation,migration and tumor development.
YAP1;triple-negative breast cancer;cell proliferation;cell migration
1007-4287(2016)12-1995-04
Q291
A
2016-03-29)
