还原敏感性中间体R-ss-COOH的合成
2017-01-05陈思何建兴朱全红胡巧红
陈思,何建兴,朱全红,胡巧红,3
(1.广东药科大学 药学院,广东 广州 510006; 2.南方医科大学 中医药学院,广东 广州 510515; 3.广东药科大学 药物新剂型重点实验室,广东 广州 510006)
药物化学
还原敏感性中间体R-ss-COOH的合成
陈思1,何建兴1,朱全红2,胡巧红1,3
(1.广东药科大学 药学院,广东 广州 510006; 2.南方医科大学 中医药学院,广东 广州 510515; 3.广东药科大学 药物新剂型重点实验室,广东 广州 510006)
目的 合成一系列含二硫键的中间体,以用于后期制备具有还原敏感性、两亲性的纳米载体材料。方法 以3,3′-二硫代二丙酸(DTDP)、脂肪醇为原料,碳二亚胺类为失水剂,在4-二甲氨基吡啶(DMAP)催化下,DTDP一端的—COOH与脂肪醇的—OH发生酯化反应合成3,3′-二硫代二丙酸脂肪醇单酯(R-ss-COOH),产物经柱色谱分离纯化,并用FT-IR和1H-NMR、MS进行结构确证。结果 与DCC/DMAP催化体系相比,EDCI/DMAP催化体系所得反应液澄清,副产物易于除尽。经FT-IR、1H-NMR、MS确证,成功合成了不同碳链的还原敏感性中间体C14-ss-COOH、C16-ss-COOH和C18-ss-COOH。结论 应用EDCI/DMAP催化体系合成R-ss-COOH的方法易于操作,相对简单。合成的系列R-ss-COOH可作为中间体,用于制备还原敏感型两亲性聚合物纳米材料。
还原敏感性; 3,3′-二硫代二丙酸脂肪醇单酯; 二硫键; 碳二亚胺类
细胞内存在着一种丰富的生物还原剂谷胱甘肽(GSH)。正常细胞内GSH的浓度大约是2~10 mmol/L,尤其是在细胞质和线粒体、细胞核等细胞器中;血液及细胞外基质中GSH的浓度为2~20 μmol/L,而肿瘤细胞内GSH的浓度至少是正常细胞的4倍[1-2]。含二硫键的物质在细胞外低GSH浓度条件下较稳定,一旦进入肿瘤细胞内,由于较高浓度的GSH,则表现出很强的还原敏感性,二硫键能够迅速裂解。
基于这一原理,以还原敏感聚合物纳米载体(reduction-sensitive polymeric nanocarriers,RSPNs)实现抗肿瘤药物的细胞内靶向递送,是目前智能响应型纳米载体的研究热点之一[3-4]。近几年研究表明,利用还原敏感的智能响应型纳米载体包载抗癌药物,能够实现在体循环中有较好的稳定性,到达靶部位前药物不释放,而进入靶部位后药物可快速、完全释放发挥作用。如,文献[5]合成了以脱氧胆酸(DOCA)为疏水链,基于透明质酸(HA)主动靶向及还原敏感智能响应型的HA-ss-DOCA共聚物,自组装形成胶束后,实现了紫杉醇的乳腺癌MDA-MB-231细胞内递送。文献[6]合成了以胱胺为二硫键响应的HA-ss-PLGA载体,用于CD44受体介导的肿瘤靶向治疗,实现多重靶向。文献[7]合成了基于壳聚糖糖脂的纳米载体CSO-ss-SA,CSO为亲水链段,十八胺(SA)为疏水链段形成两亲性自聚集纳米粒,结果表明能选择性地对肿瘤细胞内还原环境做出响应。文献[8]合成了一种还原敏感型两亲性聚合物HA-ss-PLGA,该聚合物形成的纳米粒能有效地将阿霉素和环巴胺共同递送到乳腺癌细胞和肿瘤干细胞内,载药纳米粒中药物的释放表现出较好的还原敏感性。
3,3′-二硫代二丙酸(DTDP),不仅结构中有二硫键,在还原性条件下能够迅速断裂;同时由于两端各有1个羧基,易与羟基或氨基发生反应形成共价结合,适于作为连接臂用于后期修饰。研究表明,烷基链作为胶束的疏水核心,能够通过融合和疏水作用诱导生物膜的微扰效应,其较好的亲和性能促进载体进入细胞甚至细胞器中[9]。
本文选择不同碳链长度的脂肪醇R-OH与DTDP反应,制备含二硫键的3,3′-二硫代二丙酸脂肪醇单酯(R-ss-COOH),以用作后期合成还原敏感性的两亲性聚合物纳米材料的重要中间体。
1 实验部分
1.1 仪器与试剂
FA2004B电子天平(上海精科天美科学仪器有限公司);78HW-1恒温磁力搅拌器(金坛市富华仪器有限公司);RE-52AA旋转蒸发仪(上海市亚荣生化有限公司);傅立叶变换红外光谱仪(Spectrum100 PerkinElmer);X-6显微熔点测定仪(北京泰克仪器有限公司);AV-400全数字化超导核磁共振谱仪(德国Bruker公司); 液相质谱联用仪ORBITRAP(LTQ Orbitrapxl,Thermo Scientific公司)。
3,3′-二硫代二丙酸(DTDP)、十六醇(C16-OH)、十四醇(C14-OH)、十八醇(C18-OH)、N,N′-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP)均购自上海麦克林生化科技有限公司;1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCI,上海共价化学试剂有限公司);N,N′-二甲基甲酰胺(DMF,天津市大茂化学试剂厂);乙酸乙酯(天津彩云飞化工销售有限公司);石油醚(沸程: 60~90 ℃,天津彩云飞化工销售有限公司);甲醇(色谱级,天津市科密欧化学试剂有限公司);薄层层析硅胶GF254(化学纯,青岛海洋化工有限公司);柱层析硅胶(试剂级,100~200 目,青岛海洋化工有限公司);单质碘(天津市大茂化学试剂厂);去离子水;其他试剂均为市售分析级。
1.2 R-ss-COOH的合成
1.2.1 C16-ss-COOH的合成 参考文献[10]方法并经改进,以EDCI为失水剂、DMAP为催化剂,使DTDP一端的羧基和C16-OH的羟基发生酯化反应合成C16-ss-COOH,具体步步骤如下:将1.1 mmol DTDP溶于适量无水DMF中,加入1.2 mmol EDCI和0.2 mmol DMAP,在N2条件下,磁力搅拌溶解后加入1 mmol C16-OH,室温反应24 h。
另一种方法是以DCC为失水剂、DMAP为催化剂,具体步骤如下:称取1.1 mmol DTDP、1.1 mmol DCC,置于三颈瓶中,加入10 mL无水DMF,在N2条件下,磁力搅拌使完全溶解,再加入1.1 mmol DMAP 和1 mmol C16-OH,冰浴反应1 h后,室温反应24 h。
通过比较以上EDCI、DCC为失水剂的反应情况和粗产物分离纯化情况,筛选出合适的催化体系。合成路线见图1。
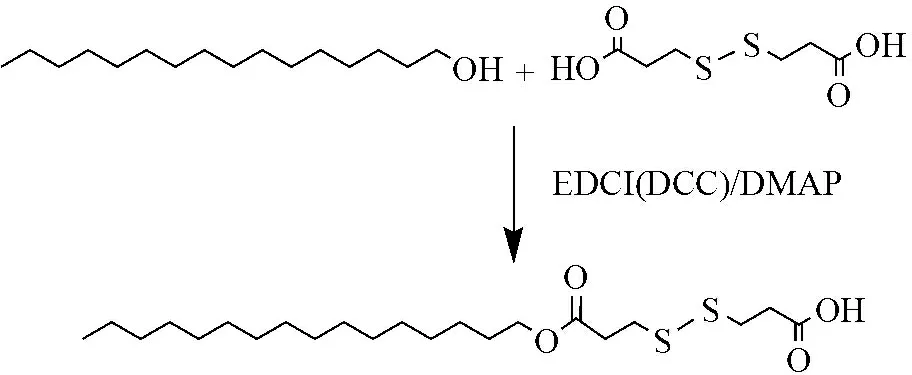
图1 C16-ss-COOH的合成路线
Figure 1 Synthetic route of C16-ss-COOH
1.2.2 其他R-ss-COOH的合成 根据上述筛选确定的反应条件,分别用C14-OH、C18-OH与DTDP反应制备含不同碳链的3,3′-二硫代二丙酸脂肪醇单酯C14-ss-COOH和C18-ss-COOH。
1.3 结构表征
1.3.1 FT-IR测定 取干燥的KBr 100 mg与适量的样品混合压片后,在400~4 000 cm-1范围内扫描。
1.3.2 熔点测定 用显微熔点仪对一系列R-ss-COOH进行熔点测定。
1.3.31H-NMR测定 根据样品的溶解情况,选用CDCl3或DMSO-d6为溶剂,采用AV-400全数字化超导核磁共振谱仪进行测定。
1.3.4 MS测定 分别将一定量的产物溶于甲醇,采用液相质谱联用仪ORBITRAP在负离子模式下进行测定。
2 结果与讨论
2.1 R-ss-COOH的合成
由于 DTDP两端各有1个活性的羧基基团,与脂肪醇R-OH反应时可能发生两端羧基的酯化。为了尽可能使一端羧基发生酯化,需控制DTDP与脂肪醇的投料比,故本文按DTDP与R-OH的摩尔比为1.1∶1投料进行反应。
2.1.1 C16-ss-COOH的合成 DMF沸点为158 ℃,一般较难除去。考虑到产物不溶于水,同时DTDP溶于水,故采用萃取的方法,先向反应液中加入大量的水,再用乙酸乙酯萃取。通过改变溶剂系统极性,使不溶于水的产物游离出来;同时用水能洗去一定量未完全反应的酸,对粗产物后处理有一定的帮助。萃取后,水层经TLC点样监测至无产物斑点,表明萃取较完全。萃取液旋转蒸发得粗产物后,经硅胶柱色谱进行分离纯化。
先以石油醚-乙酸乙酯(6∶1,体积比)为洗脱剂除去二酯、脂肪醇,然后以石油醚-乙酸乙酯(5∶1,体积比)洗脱目标产物,38 ℃旋转蒸发除去溶剂,得白色固体粉末。以DCC为失水剂反应、分离纯化后的收率为21.07%,EDCI为失水剂反应、分离纯化后的收率为26.00%。
在比较筛选不同失水剂的试验中,以DCC为失水剂反应后得黄色浑浊溶液,有白色沉淀N,N′-二环己基脲(DCU)生成,粗产物经柱色谱分离纯化后,产物经FT-IR(图略)表征,图谱指纹区出现许多杂峰;而以EDCI为失水剂反应得黄色澄清溶液,粗产物纯化后FT IR显示,特征峰明显。
DCC/DMAP体系是经典的方法,以DCC作失水剂,反应产率高,在碳二亚胺类反应中应用较多。由于DCC参与的反应,生成的副产物DCU不溶于水,虽然过滤能除去一定的副产物,但仍有少量残留,纯化过程较为繁琐;而EDCI参与反应生成的副产物呈水溶性,后处理操作相对简单。因此,确定以EDCI/DMAP为反应催化体系。
2.1.2 C14-ss-COOH、C18-ss-COOH的合成 采用EDCI/DMAP催化体系,在“2.1.1”项确定的反应条件下,将DTDP分别与十四醇、十八醇反应,合成含二硫键的不同碳链长度的中间体C14-ss-COOH和C18-ss-COOH。反应液均为浅黄色透明溶液,其中C14-ss-COOH 的收率为21.39%,C18-ss-COOH的收率为17.09%。
2.2 R-ss-COOH的表征

4000300020001000ABCDEν/cm-1
图2 DTDP(A)、C16-OH(B)、C14-ss-COOH(C)、C16-ss-COOH(D)、C18-ss-COOH (E)的FT-IR图谱
Figure 2 FT-IR spectrum of DTDP(A),C16-OH (B),C14-ss-COOH(C),C16-ss-COOH (D) and C18-ss-COOH(E)
2.2.2 熔点 3种目标产物熔点测定结果分别是:C14-ss-COOH为70.5~71.6 ℃;C16-ss-COOH为72.3~73.8 ℃;C18-ss-COOH为76.5~77.4 ℃。
2.2.31H-NMR图谱 C14-ss-COOH、C16-ss-COOH、C18-ss-COOH的1H-NMR见图3。
C14-ss-COOH(400 MHz,CDCl3)δ:4.10(t,2H,J=6.8 Hz,5-H),2.97~2.88(m,4H,2-H,3-H),2.84~2.78(m,2H,4-H),2.74(t,2H,J=7.2 Hz,1-H),1.70~1.55(m,2H,6-H),1.39~1.29(m,2H,17-H),1.32~1.20(m,20H,7-H,8-H,9-H,10-H,11-H,12-H,13-H,14-H,15-H,16-H),0.88 (t,3H,J=7.0 Hz,18-H)。
C16-ss-COOH(400 MHz,CDCl3)δ:4.12(t,2H,J=6.8 Hz,5-H),3.04~2.90(m,4H,2-H,3-H),2.85~2.79(m,2H,4-H),2.75(t,2H,J=7.1 Hz,1-H),1.75~1.57(m,2H,6-H),1.33~1.20(m,2H,19-H),1.49~1.24(m,24H,7-H,8-H,9-H,10-H,11-H,12-H,13-H,14-H,15-H,16-H,17-H,18-H),0.90 (t,3H,J=6.8 Hz,20-H)。
C18-ss-COOH(400 MHz,CDCl3)δ:4.12(t,2H,J=6.8 Hz,5-H),3.05~2.86(m,4H,2-H,3-H),2.86~2.78(m,2H,4-H),2.76(t,2H,J=7.2 Hz,1-H),1.61(dt,2H,J=55.6,27.9 Hz,6-H),1.30(d,30H,J=17.9 Hz,7-H,8-H,9-H,10-H,11-H,12-H,13-H,14-H,15-H,16-H,17-H,18-H,19-H,20-H,21-H),0.90(t,3H,J=6.8 Hz,22-H)。
以上C16-ss-COOH的1H-NMR图谱与文献[10]报道的一致,可见合成的产物为单酯C16-ss-COOH。C14-ss-COOH、C18-ss-COOH的1H-NMR图谱如图3所示,各位置H的化学位移均能够对应。

dfgecbabbabcndOOHOOSSfgfe5.04.54.03.53.02.52.01.51.00.5δABC
图3 C14-ss-COOH(A)、C16-ss-COOH(B)、C18-ss-COOH(C)的1H NMR图谱
Figure 31H NMR spectrum of C14-ss-COOH,C16-ss-COOH and C18-ss-COOH
2.2.4 MS图谱 3种目标产物的质谱图见图4。可见,质荷比为811、867、923的峰属于[2M+1]+,相对分子质量分别为405、433、462,分别对应C14-ss-COOH、C16-ss-COOH和 C18-ss-COOH,表明已成功合成目标产物R-ss-COOH。
3 结论
利用二硫键的还原敏感性,将对GSH敏感的DTDP一端羧基与疏水性的脂肪醇反应生成R-ss-COOH。通过对2种失水剂DCC、EDCI与DMAP的体系反应后的现象、后处理步骤、收率的比较,筛选出EDCI/DMAP为适合的反应体系。用水将产物游离后,再用乙酸乙酯萃取反应液,粗产物过柱分离纯化后得到目标产物C16-ss-COOH。用筛选的催化体系合成了不同碳链的中间体R-ss-COOH,该结构含有二硫键及疏水链,可作为中间体与亲水性的聚合物反应,合成具有自组装能力的还原敏感性两亲性聚合物,有望作为具有还原敏感性的纳米载体。

100806040200相对丰度100806040200100806040200ABC200018001600140012001000200400600800m/z相对丰度相对丰度
图4 C14-ss-COOH(A)、C16-ss-COOH(B)、C18-ss-COOH(C)的 ESI质谱图(负离子模式)
Figure 4 ESI of C14-ss-COOH(A),C16-ss-COOH(B) and C18-ss-COOH(C)
[1] BALENDIRAN G K,DABUR R,FRASER D. The role of glutathione in cancer[J]. Cell Biochem Funt,2004,22(6): 343-352.[2] WU Guoyao,FANG Yunzhong,YANG Sheng,et al. Glutathione metabolism and its implications for health[J]. J Nutr,2004,134(3): 489-492.
[3] SCHAFER F Q,BUETTNER G R. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J]. Free Radic Biol Med,2001,30(11): 1191-1212.
[4] TORCHILIN V P. Multifunctional and stimuli-sensitive pharmaceutical nanocarriers[J]. Eur J Pharm Biopharm,2009,71: 431-444.
[5] LI Jing,HUO Meirong,WANG Jing,et al. Redox-sensitive micelles self-assembled from amphiphilic hyaluronic acid-deoxycholic acid conjugates for targeted intracellular delivery of paclitaxel [J]. Biomaterials,2012,33(7): 2310-2320.
[6] PARK H K,LEE S J,Oh J S,et al. Smart nanoparticles based on hyaluronic acid for redox-responsive and CD44 receptor-mediated targeting of tumor[J]. Nanoscale Res Lett,2015,10(1): 981.
[7] HU Yingwen,DU Yongzhong,LIU Na,et al. Selective redox-responsive drug release in tumor cells mediated by chitosan based glycolipid-like nanocarrier[J]. J Control Release,2015,206: 91-100.
[8] HU Kelei,ZHOU Huige,LIU Ying,et al. Hyaluronic acid functional ampipathic and redox-responsive polymer particles for the co-delivery of doxorubicin and cyclopamine to eradicate breast cancer cells and cancer stem cells[J]. Nanoscale,2015,7(18):8607-8618.
[9] NONAKA K,KAZAMA S,GOTO A,et al. Spin probe study on the interaction of chitosan-derived polymer surfactants with lipid membrane[J]. Colloid Interface Sci,2002,246:288-295.
[10] CUI Can,XUE Yanan,WU Ming,et al. Cellular uptake,intracellular trafficking,and antitumor efficacy of doxorubicin-loaded reduction sensitive micelles[J]. Biomaterials,2013,34: 3858-3869.
[11] 李剑华,石海峰,张兴祥,等. 1-十六醇接枝聚乙烯醇共聚物的合成及性能研究[J].化工新型材料,2011,39(7):100-103.
[12] 刘超宇.氧化还原敏感和肿瘤靶向聚合物胶束的研究[D].成都:西南交通大学,2013.
(责任编辑:陈翔)
Synthesis of reduction-sensitive intermediates R-ss-COOH
CHEN Si1,HE Jianxing1,ZHU Quanhong2,HU Qiaohong1,3
(1.DepartmentofPharmaceutics,SchoolofPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.SchoolofTraditionalChineseMedicine,SouthernMedicalUniversity,Guangzhou510515,China; 3.GuangdongProvincialKeyLaboratoryofNewDosageForm,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Objective To synthesize a series of reduction-sensitive intermediates,which were further used to prepare reduction-sensitive amphiphilic polymers. Methods Using carbodiimide as coupling reagent and DMAP as catalyst,3,3′-dithiodipropionic acid (DTDP) was conjugated with fatty alcohols via ester bonding between one carboxyl group of DTDP and the hydroxy group of fatty alcohols to prepare 3,3′-thiodipropionate fatty alcohol monoester (R-ss-COOH). The crude products were purified by column chromatography. The structures were confirmed by the Fourier transform infrared spectroscopy (FT-IR),proton nuclear magnetic resonance (1H-NMR) and mass spectrometer (MS). Results Compared with DCC/DMAP,EDCI/DMAP produced transparent reaction solution and its by-products were easier to be removed. FT-IR,1H-NMR and MS confirmed that a series of reduction-responsive intermediates with different carbon length,C14-ss-COOH,C16-ss-COOH and C18-ss-COOH,were synthesized successfully. Conclusion The esterification process with EDCI/DMAP is simple and feasible. R-ss-COOH may be excellent intermediates to synthesize reduction-responsive amphiphilic polymers as nanocarrier materials.
reduction-sensitive; 3,3′-thiodipropionate fatty alcohol monoester; disulfide bond; carbodiimide
2016-08-06
国家自然科学基金资助项目(81673594)
陈思(1992—),女,2014级硕士研究生,Email:chensi622@hotmail.com;通信作者:胡巧红(1969—),女,博士,教授,硕士研究生导师,主要从事药物新剂型与新技术研究,Email:hu_qiaohong@163.com。
时间:2016-11-24 16:13
http://www.cnki.net/kcms/detail/44.1413.R.20161124.1613.004.html
R914.5
A
1006-8783(2016)06-0700-05
10.16809/j.cnki.1006-8783.2016080601
