柴苓护肝颗粒提取工艺的优化
2017-01-05李丽杨瑾龙晓英李梓嘉王双燕孙锦珍
李丽,杨瑾,龙晓英,李梓嘉,王双燕,孙锦珍
(1.广东药科大学 中药学院,广东 广州 510006; 2.中山市第二人民医院 药剂科,广东 中山 528400)
柴苓护肝颗粒提取工艺的优化
李丽1,杨瑾2,龙晓英1,李梓嘉1,王双燕1,孙锦珍1
(1.广东药科大学 中药学院,广东 广州 510006; 2.中山市第二人民医院 药剂科,广东 中山 528400)
目的 优化柴苓护肝颗粒的提取工艺。方法 通过正交试验分别对柴苓护肝颗粒的水提及醇沉工艺进行考察。水提工艺中,以干膏得率和总黄酮含量为指标,对加水量、浸泡时间、煎煮时间、煎煮次数进行考察。醇沉工艺中,则以干膏得率、干膏中总黄酮和总多糖质量分数为指标,对乙醇体积分数、醇沉时间、初膏浓度(每毫升清膏相当于生药质量)进行优化。结果 柴苓护肝颗粒的最佳提取工艺为加水倍量为10倍,浸泡20 min,煎煮2次,每次1.5 h,煎液浓缩至初膏浓度为1∶1(相对密度为1.08 g/mL),加入乙醇使最终乙醇体积分数为50%,醇沉24 h。结论 该工艺稳定可行,为柴苓护肝颗粒的制备奠定了基础。
柴苓护肝颗粒; 提取工艺; 醇沉工艺; 正交试验; 总黄酮; 总多糖; 干膏得率
酒精性肝病是由于长期大量饮酒导致的肝脏疾病,是我国常见病。柴苓护肝方由柴胡、猪苓、党参、炙甘草等8味药材组成,具有疏肝利胆、解酒泄毒的功效,是临床应用于酒精性肝病的验方。原方以汤剂给药,存在存储不易、服用及携带不便等问题,故拟将该方制成颗粒剂,以提高给药的顺应性和便利性。现代药理研究表明,柴胡和甘草中的黄酮类物质,猪苓中的多糖类物质,党参水提及醇提物均具有一定的护肝作用,可作为评价柴苓护肝颗粒工艺及质量的有效部位[1-2]。
目前,已有文献[3-4]对柴苓护肝颗粒的提取工艺进行过探讨,但存在考察指标较单一及正交设计不合理等问题,为了更好地优化该制剂水提醇沉的提取工艺,本文在黄酮和多糖类有效部位的基础上,增加干膏得率为评价最优工艺的指标,并分别对水提(干膏得率和总黄酮质量分数为指标)和醇沉(干膏得率、总黄酮和总多糖质量分数为指标)工艺指标进行综合评价,为柴苓护肝颗粒的生产提供依据。
1 仪器与试药
1.1 仪器
UV-6100S紫外-可见分光光度计(上海美谱达仪器有限公司);SK2200H超声波清洗器(上海沪粤明科学仪器有限公司);Satorius BP211D十万分之一天平(德国赛多利斯北京有限公司);TDL80-2B台式离心机(上海安亭科学仪器厂);HH4数显恒温水浴锅(金坛市富华仪器有限公司);RE-2000旋转蒸发器(上海亚荣生化仪器厂)。
1.2 试药
芦丁对照品(中国食品药品检定研究院,批号:100080-201409,质量分数为92.6%);D-无水葡萄糖对照品(中国食品药品检定研究院,批号:110833-201205,质量分数为99.9%);其他试剂均为分析纯,水为去离子水。柴胡、猪苓、炙甘草等药材购自中山市金瑞中药饮片有限公司,并经广东药科大学中药资源系刘基柱副教授鉴定合格。
2 方法与结果
2.1 总黄酮质量分数的测定方法
2.1.1 芦丁对照品储备液的制备 精密称取芦丁对照品0.10 g,置100 mL容量瓶中,加70%(体积分数,下同)乙醇溶解并稀释至刻度,摇匀,即得。
2.1.2 供试品溶液的制备 精密称取水提浓缩液0.10 g,加70%乙醇至6 mL,超声5 min混匀后,以3 000 r/min室温离心4 min,上清液即为供试品溶液。
2.1.3 测定波长的选择 精密吸取对照品溶液及供试品溶液各2 mL,另量取70%乙醇溶液2 mL作为空白,分别置于不同的具塞玻璃刻度试管中,加质量分数5%NaNO2溶液0.3 mL,摇匀,置室温下反应6 min,再精密加质量分数10%AlNO3溶液0.3 mL,摇匀,置室温下反应6 min,再精密加NaOH溶液(4.3 g NaOH用蒸馏水定容至100 mL)4 mL,摇匀,置室温下反应15 min,于300~600 nm处进行紫外扫描,确定最大吸收波长。结果显示,对照品及供试品均在500 nm处有最大吸收峰,故最终确定测定波长为500 nm。
2.1.4 标准曲线的绘制 精密量取上述芦丁对照品储备液0.30、0.45、0.60、0.75、0.90、1.05 mL,分别置5 mL容量瓶中,用70%乙醇稀释至刻度,摇匀,各取2 mL于具塞试管中,按“2.1.3”项方法处理,于500 nm波长测定吸光度。以吸光度值为纵坐标,以芦丁的质量浓度为横坐标进行线性回归,得回归方程Y=4.040 3X-0.021 99(R2=0.999 6),表明芦丁质量浓度在0.06~0.21 mg/mL范畴内与吸光度线性关系良好。
2.1.5 精密度试验 精密吸取对照品溶液2 mL,按“2.1.3”项下方法操作,于500 nm连续测定吸光度6次,其RSD值为1.1%,表明仪器的精密度良好。
2.1.6 重复性试验 取同一水煎液,按“2.1.2”项下方法制备6份供试品溶液,并按“2.1.3”项下方法操作,测定总黄酮质量分数,结果总黄酮质量分数的RSD值为1.6%,表明方法的重复性较好。
2.1.7 稳定性试验 取同一供试品溶液,按“2.1.3”项下方法操作,室温放置,分别于0、30、60、90、120、150 min测定吸光度,得其RSD值为0.3%,表明样品溶液在室温下放置150 min内稳定。
2.1.8 加样回收率试验 精密称取已知黄酮质量分数的样品溶液0.10 g,共9份,每份分别准确加入已知浓度的芦丁对照品溶液1.3、2.6、3.8 mL(每个浓度3份),并分别用70%乙醇将总体积补至12 mL,按“2.1.3”项下方法操作,测定吸光度,得芦丁的平均加样回收率为93.41%,RSD为2.0%。
2.2 总多糖质量分数的测定方法2.2.1 葡萄糖对照品储备液的制备 精密称取105 ℃干燥至恒重的葡萄糖对照品0.01 g,置100 mL容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,即得。
2.2.2 供试品溶液的制备 精密称取醇沉浓缩液2.00 g,置100 mL容量瓶中,用蒸馏水定容至刻度,摇匀,精密量取10 mL于100 mL容量瓶中,补加水至刻度,摇匀,再精密量取该溶液1 mL,置10 mL容量瓶中,加水稀释至刻度,摇匀,即得供试品溶液。
2.2.3 测定波长的选择 精密量取葡萄糖对照品溶液和供试品溶液各2 mL,另量取蒸馏水2 mL作为空白,分别置于不同的具塞试管中,各试管精密加入1.0 mL的质量分数5%苯酚试液(苯酚易氧化,必须现用现配),摇匀,再精密加浓硫酸5.0 mL,摇匀,置沸水浴中加热15 min,取出,置冷水浴中冷却10 min后,在波长300~600 nm扫描。结果显示,对照品及供试品溶液均在490 nm处有最大吸收峰,故最终确定测定波长为490 nm。
2.2.4 线性关系考察 精密量取上述葡萄糖对照品储备液3、4、5、6、7、8 mL分别置10 mL容量瓶中,用蒸馏水稀释至刻度,摇匀,各取2 mL于具塞试管中,按“2.2.3”项下处理,于490 nm波长测定吸光度。以吸光度值为纵坐标,以葡萄糖质量浓度为横纵坐标进行线性回归,得回归方程Y=14.336X-0.192 48(R2=0.999 7),表明葡萄糖质量浓度在0.03~0.08 mg/mL范围内与吸光度线性关系良好。
2.2.5 精密度试验 取葡萄糖对照品溶液2 mL,按“2.2.3”项下方法操作,于490 nm连续测定吸光度6次,得其RSD值为0.03%,表明仪器的精密度良好。
2.2.6 重复性试验 取同一供试品溶液,按“2.2.2”项下方法制备6份供试品溶液,并按“2.2.3”项下方法操作,测定总多糖质量分数,得其RSD值为3.2%,表明方法的重现性较好。
2.2.7 稳定性试验 取同一供试品溶液,按“2.2.3”项下方法操作,室温放置,分别于0、30、60、90、120、150 min测定吸光度,得其RSD值为0.6%,表明样品溶液在室温下放置150 min内稳定。
2.2.8 加样回收率试验 精密量取已知多糖质量分数的样品溶液1.35 mL,共9份,每份分别准确加入已知浓度葡萄糖对照品溶液0.65、1.30、1.95 mL(每个浓度3份),并分别用蒸馏水将总体积补至4 mL,按“2.2.3”项下方法操作,测定吸光度,得葡萄糖的平均加样回收率为95.20%,RSD为3.3%。
2.3 干膏得率的测定
参照2015年版《中国药典》四部(通则2201)浸出物测定法,各精密称取水提正交试验所得的浓缩药液5.0 g,分别置于已干燥至恒重的蒸发皿(设质量为m1)中,水浴挥干,残渣于105 ℃干燥3 h,取出,置干燥器中冷却30 min,迅速精密称定总质量(m2),通过公式(1)计算其干膏得率。醇沉工艺中的干膏得率,则是各精密称取水提正交试验所得的浓缩药液1 g,自“分别置于已干燥至恒重的蒸发皿”起同法操作,通过公式(2)计算干膏得率。
(1)
(2)
2.4 水提正交试验
2.4.1 水提正交试验设计 为考察水提工艺条件对提取效率的影响,采用L9(34)正交试验表进行设计,对加水量(A)、浸泡时间(B)、煎煮时间(C)、煎煮次数(D)进行工艺研究,以干膏得率、总黄酮质量分数进行综合加权评分,权重系数分别为0.2和0.8,因素水平见表1。
2.4.2 水提正交试验工艺 称取柴胡、猪苓、党参、炙甘草等8味药材共96.0 g,按照正交试验表进行操作,依次经过浸泡、煎煮、浓缩步骤,最终得到的相对密度约为1.08 g/mL[5],即初膏浓度为1∶1的水提浓缩液,分别测定总黄酮质量分数和干膏得率。
表1 水提正交试验因素水平表
Table 1 Factors and levels of orthogonal test of water extraction

水平因素A加水量/倍B浸泡时间/minC煎煮时间/hD煎煮次数182011210401.523126023
2.4.3 水提正交试验结果 按照正交试验表进行操作,将各样品水提液浓缩成一定量,测定计算各正交样品的干膏得率及总黄酮质量分数,并计算综合评分(综合评分=干膏得率/干膏得率最大值×20%+总黄酮质量分数/总黄酮质量分数最大值×80%),极差及方差分析结果分别见表2、表3。极差分析结果表明,影响水提效率的因素依次为D>C>A>B,浸泡时间对提取效率影响最小(在方差分析中作空白列),直观分析最佳组合为A2B1C3D3。方差分析结果表明,加水量、煎煮时间对提取效率的影响无统计学意义,煎煮次数对提取效率的影响有统计学意义(P<0.05),且煎煮次数的第2水平和第3水平没有显著性差别。考虑成本因素,结合大生产实际,将最终工艺确定为A2B1C2D2,即加10倍量水,浸泡20 min,提取2次,每次提取1.5 h。
表2 水提正交试验极差分析表
Table 2 Analysis of range for orthogonal test of water extraction
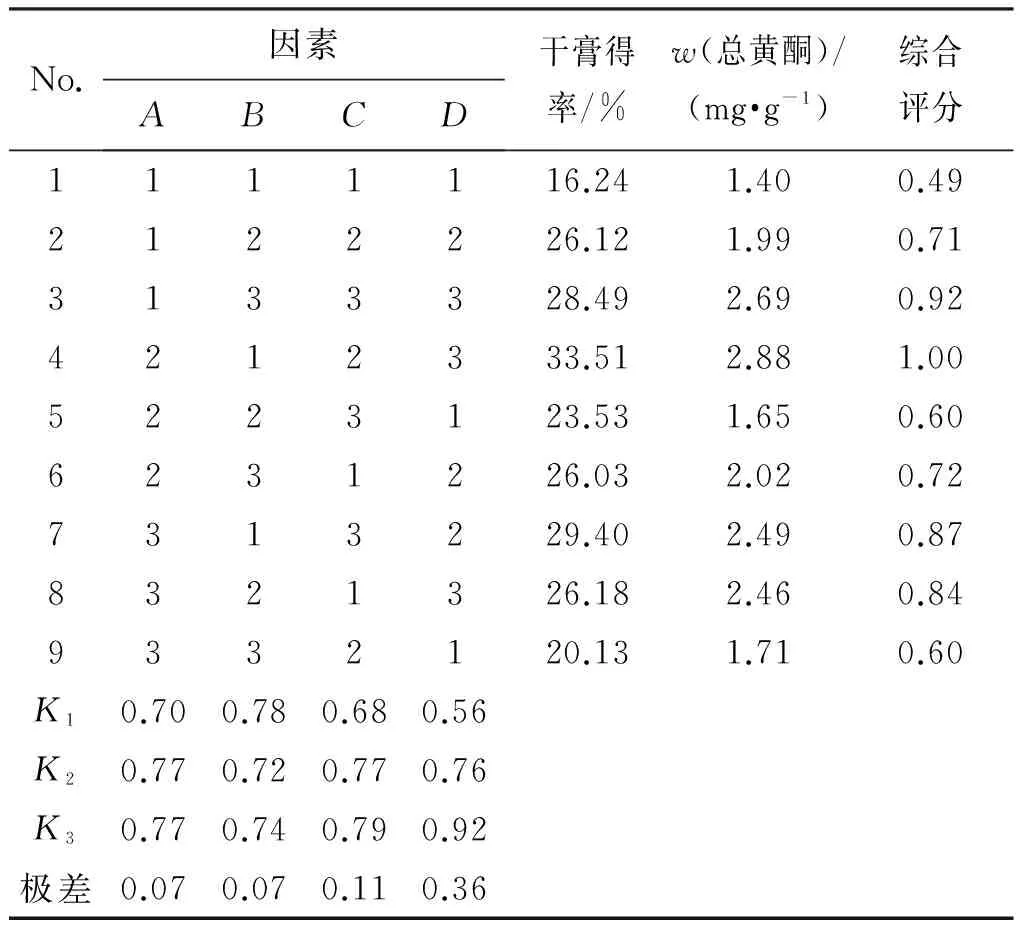
No.因素ABCD干膏得率/%w(总黄酮)/(mg·g-1)综合评分1111116.241.400.492122226.121.990.713133328.492.690.924212333.512.881.005223123.531.650.606231226.032.020.727313229.402.490.878321326.182.460.849332120.131.710.60K10.700.780.680.56K20.770.720.770.76K30.770.740.790.92极差0.070.070.110.36
表3 水提正交试验方差分析表
Table 3 Analysis of variance for orthogonal test of water extraction
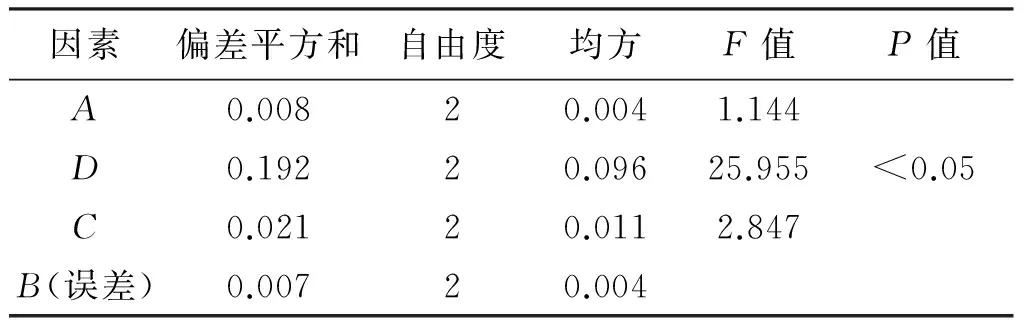
因素偏差平方和自由度均方F值P值A0.00820.0041.144D0.19220.09625.955<0.05C0.02120.0112.847B(误差)0.00720.004
注:F0.05(2,2)=19.00。
2.4.4 最佳水提工艺验证 按“2.4.2”项下最佳水提工艺制备3批样品,测定样品中干膏得率和总黄酮质量分数,结果3批样品中干膏得率为(29.3±1.1)%,总黄酮质量分数为(2.45±0.05) mg/g,表明该工艺稳定可行。
2.5 醇沉正交试验
2.5.1 醇沉正交试验设计 醇沉工艺既要除去淀粉、植物蛋白,又要保留猪苓多糖、党参多糖等有效多糖,采用L9(34)正交试验表进行设计,对乙醇体积分数(A)、醇沉时间(B)、初膏浓度(C)进行工艺研究,以干膏得率、总黄酮质量分数和总多糖质量分数进行综合加权评分,权重系数分别为0.2、0.4和0.4,因素水平见表4。
2.5.2 醇沉正交试验工艺 称取柴胡、猪苓、党参、炙甘草等8味药材共96.0 g,按最优水提工艺,即加10倍量的水浸泡20 min后,煎煮2次,每次1.5 h,照正交试验表进行操作,依次经过醇沉、浓缩步骤,最终得到的相对密度约为1.28 g/mL醇沉浓缩液[5],分别测定总黄酮、总多糖的质量分数和干膏得率。
表4 醇沉正交试验因素水平表
Table 4 Factors and levels of orthogonal test of ethanol percipitation

水平因素A乙醇体积分数/%B醇沉时间/hC初膏浓度/(mL·g-1)150121∶1260241∶1.5370361∶2
2.5.3 醇沉正交试验结果 按照正交试验表进行操作,将各样品醇沉液滤过,浓缩成一定量,测定计算各正交样品的干膏得率、总多糖及总黄酮质量分数,并计算综合评分(综合评分=干膏得率/干膏得率最大值×20%+总多糖质量分数/总多糖质量分数最大值×40%+总黄酮质量分数/总黄酮质量分数最大值×40%),极差及方差分析结果分别见表5、表6。可见,影响醇沉效率的因素依次为C>B>A,乙醇体积分数对提取效率影响最小,直观分析最佳组合为A2B2C1。方差分析结果表明,乙醇体积分数对提取效率的影响没有统计学意义,醇沉时间和初膏浓度对提取效率的影响有统计学意义(P<0.05),但经过水平间两两比较结果显示,醇沉24 h和36 h对提取效率的影响没有明显差异。结合成本因素,将最终工艺确定为A1B2C1,即向初膏浓度为1∶1的水提浓缩液中,加入乙醇使最终乙醇体积分数为50%,静置24 h。
表5 醇沉正交试验极差分析表
Table 5 Analysis of range for orthogonal test of ethanol percipitation
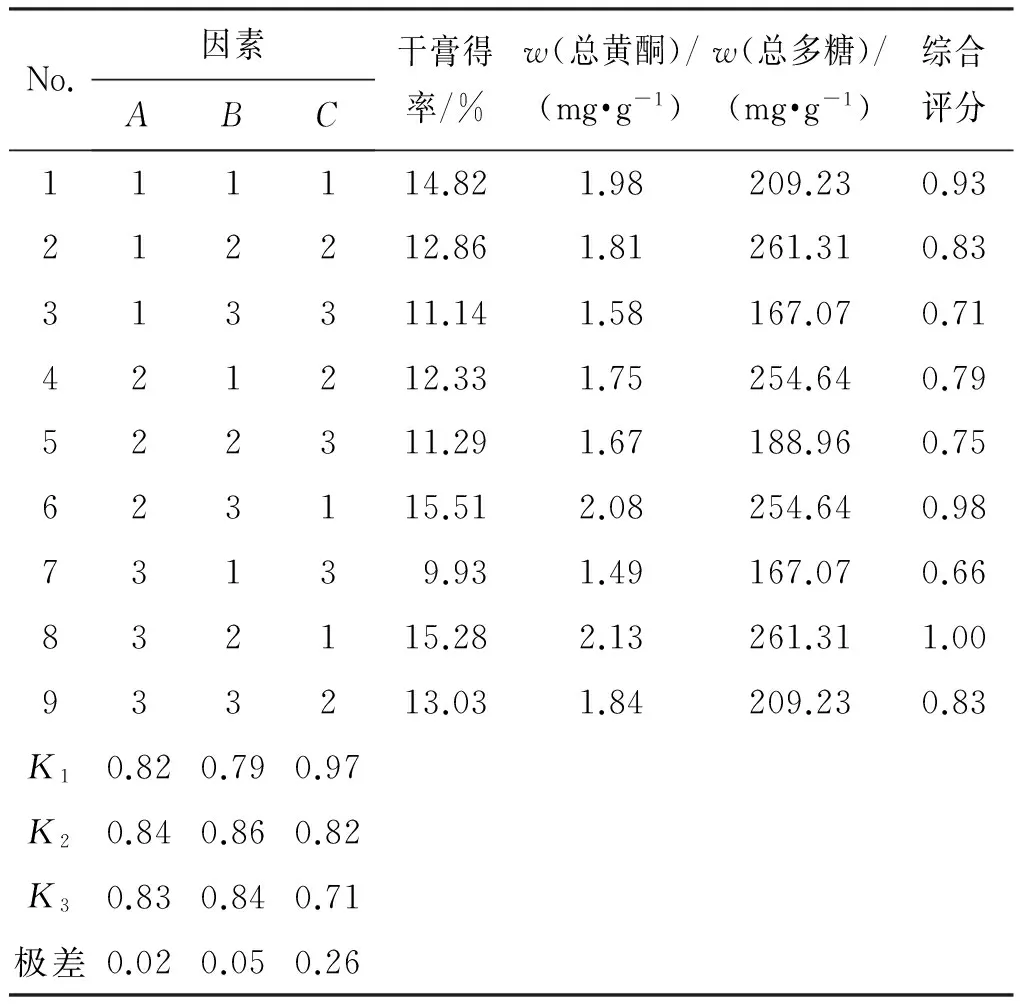
No.因素ABC干膏得率/%w(总黄酮)/(mg·g-1)w(总多糖)/(mg·g-1)综合评分111114.821.98209.230.93212212.861.81261.310.83313311.141.58167.070.71421212.331.75254.640.79522311.291.67188.960.75623115.512.08254.640.9873139.931.49167.070.66832115.282.13261.311.00933213.031.84209.230.83K10.820.790.97K20.840.860.82K30.830.840.71极差0.020.050.26
表6 醇沉正交试验方差分析表
Table 6 Analysis of variance for orthogonal test of ethanol percipitation
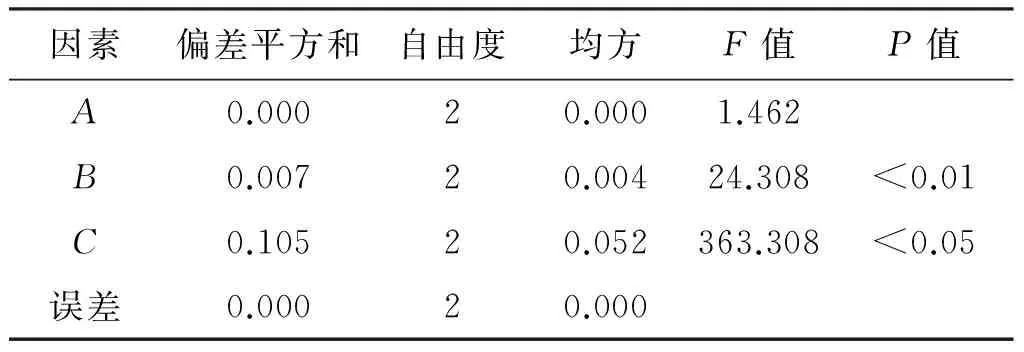
因素偏差平方和自由度均方F值P值A0.00020.0001.462B0.00720.00424.308<0.01C0.10520.052363.308<0.05误差0.00020.000
注:F0.05(2,2)=19.00;F0.01(2,2)=99.00。
2.5.4 最佳醇沉工艺验证 按优选出的最佳醇沉工艺制备3批样品,分别测定样品中干膏得率和总多糖、总黄酮质量分数,结果3批样品中干膏得率为(13.65±0.14)%,总多糖质量分数为(2.54±0.06)×102mg/g,总黄酮质量分数为(1.60±0.03) mg/g,表明该工艺稳定可行。
3 讨论
柴苓护肝方由8味药材组成,根据该方药味组成,本文采用水提醇沉法对该方进行提取,选择总多糖、总黄酮质量分数和干膏得率多个指标并作加权评分来对柴苓护肝颗粒剂的提取及醇沉工艺进行优化,研究结果表明,最优提取及醇沉工艺稳定,为后续柴苓护肝颗粒的制备奠定了基础。
从处方中各位药材分析,水提物可能含有较多淀粉,但通常当含醇量达到50%~60%时,可除去淀粉杂质[6],这时有效的猪苓多糖及党参多糖不会被沉淀[7-8]。因此,在醇沉时乙醇浓度控制在50%~70%范围进行考察,结合初步临床疗效表明,此工艺合理。
柴胡皂苷作为君药柴胡主要的活性成分之一,可通过降低血清中的天冬氨酸氨基转移酶、碱性磷酸酶和肿瘤坏死因子-α等的含量[9-10]、抑制脂质过氧化反应、提高超氧化物歧化酶活性[11]等途径对肝脏起一定保护作用,其质量分数理应作为工艺的考察指标。但采用对二甲胺基苯甲醛-磷酸比色法进行质量分数测定时,经反复的预试验均发现回收率达不到要求,在此基础上查阅《中国药典》如柴胡口服液、柴黄片、逍遥丸、柴银口服液等以柴胡为君药的制剂(2015年版《中国药典》一部收载),当中并未建立其中柴胡总皂苷质量分数的测定方法。同时,文献报道中测定柴胡总皂苷的方法差异较大,多用到溶剂提取法[12]和大孔树脂法[13],且步骤复杂,使得方法重复性较差及提取效率较低。因此本文并未选择总皂苷为控制柴苓护肝颗粒质量的指标。
本文采用多指标正交试验法最终优化得到的提取工艺稳定合理、操作简单,适用于大生产,可作为柴苓护肝颗粒的提取工艺。
[1] 郭菁菁,杨秀芬. 黄酮类化合物对动物实验性肝损伤保护作用的研究进展[J].中国药理学通报,2008,24(1):5-10.
[2] 韦英杰,王茉,宁青,等. HPLC法同时测定柴胡与春柴胡中皂苷类及黄酮类成分的含量[J].药物分析杂志,2011,31(5):879-883.
[3] 莫国栋,杨瑾,周再生,等.柴苓护肝颗粒的提取工艺研究[J].中国医药导报,2015,12(16):52-55;61.
[4] 杨瑾,莫国栋,宋凤兰,等.柴苓护肝颗粒的优化工艺[J].环球中医药,2015,8(12):1455-1459.
[5] 国家药典委员会.中华人民共和国药典:2015年版四部[M].北京:中国医药科技出版社,2015:73-74.
[6] 张津津.咽喉颗粒提取工艺及质量标准研究[D].广州:南方医科大学,2008.
[7] 温红平.藿朴口服液的制备工艺及质量标准的研究[D].太原:山西医科大学,2006.
[8] 刘文生.党参多糖、皂甙提取及对小鼠抗氧化和免疫功能影响的研究[D].太谷:山西农业大学,2004.
[9] 王占一,南极星.北柴胡对对乙酰氨基酚所致小鼠急性肝损伤的保护作用[J].中国药师,2008,11(7):747-749.
[10] 王占一,南极星.北柴胡对他克林致小鼠急性肝损伤的保护作用[J].滨州医学院学报,2008,31(2):91-92.
[11] 戈宏焱,陈博,刘会龙,等.柴胡皂苷对酒精性肝病大鼠的治疗作用[J].中国老年学杂志,2011,31(4):662-663.
[12] 章佳赟.含柴胡的常用中成药中柴胡皂苷含量的测定及研究[D].上海:复旦大学,2010.
[13] 李军,石任兵,刘斌,等.四逆散不同配伍对柴胡皂苷a、b2及柴胡总皂苷煎出量的影响[J].北京中医药大学学报,2007,30(2):115-120.
(责任编辑:陈翔)
Optimization of the extraction process of Chailing Hugan granules
LI Li1,YANG Jin2,LONG Xiaoying1,LI Zijia1,WANG Shuangyan1,SUN Jinzhen1
(1.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.DepartmentofPharmacy,ZhongshanSecondPeople′sHospital,Zhongshan528400,China)
Objective To optimize the water extraction and alcohol precipitation technology of Chailing Hugan granules. Methods The orthogonal test was used to optimize the water extraction and alcohol precipitation process. In water extraction process,dry extract yield and the content of total flavonoids were used as comprehensive evaluation indexes to observe soaking time,the amount of water,decocting time and decocting frequencies. In alcohol precipitation process,the alcohol precipitation concentration,alcohol sedimentation time and relative density of extra were investigated with the dry extract yield,the content of total flavonoids and polysaccharides as comprehensive evaluation indexes. Results The best water extraction process was as follows: ten times the amount of water soaking for 20 min,decocted twice (90 min each time); the optimized alcohol precipitation process was: relative density of water extra 1.08 g/mL,alcohol precipitation concentration 50%,alcohol sedimentation time for 24 h. Conclusion The optimized water extraction and alcohol precipitation process were practical and stable which could lay a foundation for the preparation for Chailing Hugan granules.
Chailing Hugan granules; extraction process; alcohol precipitation process; orthogonal test; total polysaccharides; total flavonoids; dry extract yield
2016-09-05
李丽(1991—),女,2014级硕士研究生,Email:lily_gdpu@yahoo.com;通信作者:龙晓英(1960—),女,博士,教授,硕士研究生导师,主要从事药物新剂型与新技术研究,Email:longxy3156@163.com。
时间:2016-11-29 10:55
http://www.cnki.net/kcms/detail/44.1413.R.20161129.1055.005.html
R284.2
A
1006-8783(2016)06-0695-05
10.16809/j.cnki.1006-8783.2016090501
