非布司他与别嘌呤醇治疗痛风随机对照试验系统评价
2016-12-29方芳,王鹏
方 芳,王 鹏
(核工业四一六医院,四川 成都 610051)
非布司他与别嘌呤醇治疗痛风随机对照试验系统评价
方 芳,王 鹏
(核工业四一六医院,四川 成都 610051)
目的 评价非布司他治疗痛风的安全性与有效性。方法 检索 Pubmed,The Cochrane Library,EMbase,中文科技期刊全文数据库(CNKI),中国生物医学文献服务系统(SinoMed),维普中文科技期刊数据库(VIP)和万方数据库,纳入非布司他治疗痛风的随机对照试验(RCT)。由2位研究人员依据纳入与排除标准独立筛选文献,提取数据,评估偏倚风险,并交叉核对结果,最后采用Revman 5.3软件进行 Meta分析。结果共纳入7篇文献。分析结果显示,非布司他40 mg,80 mg,120 mg组血尿酸(sUA)达标率分别为45.8%[RR=1.28,95%CI为 1.13~1.46,P=0.000 1],65.8%[RR=1.73,95%CI为 1.61~1.86,P=0.000 1],79.3%[RR=2.11,95%CI为1.87~2.38,P<0.000 01],与剂量呈正相关趋势,与别嘌呤醇组的差异具有显著性;非布司他(40~120 mg)降低sUA的效果均优于别嘌呤醇[非布司他40 mg组,MD=1.82,95%CI为0.39~3.25,P=0.01;80 mg组,MD=10.21,95%CI为8.93~11.49,P<0.000 01;120 mg组,MD=18.33,95%CI为16.23~20.43,P<0.000 01];预防期非布司他120 mg组与别嘌呤醇组的痛风发生率有显著性差异[RR=1.65,95%CI为1.36~2.02,P<0.000 01],非布司他组的痛风发生率显著高于别嘌呤醇组,80 mg组、非预防期120 mg组与别嘌呤醇组差异无显著性;非布司他组的不良反应发生率明显低于别嘌呤醇组[RR=0.95,95%CI为0.91~0.99,P=0.03]。而在肝功能损害及严重不良反应发生率方面各组均无显著性差异。结论 非布司他疗效与安全性均优于别嘌呤醇。
非布司他;别嘌呤醇;痛风;高尿酸血症;系统评价
痛风是由于尿酸盐结晶在关节及周围组织沉积,引起急性炎症反应和长期组织损伤的一种关节疾病。控制血清尿酸水平在饱和点(6.8 mg/dL或410 μmol/L)以下,使尿酸盐处于溶解状态,是治疗痛风的一种思路[1]。欧洲风湿病防治联合会和中华医学会内分泌学分会推荐高尿酸血症患者血尿酸控制目标为 6 mg/dL (360 μmol/L)[2-3]。对于有痛风发作的患者,英国风湿病学会和中华医学会内分泌学分会推荐血尿酸控制目标为5 mg/dL(300 μmol/L)[4]。
别嘌呤醇又名别嘌醇,是一种广泛应用于痛风治疗的嘌呤类似物,但选择性较差。通常别嘌呤醇的起始剂量为100 mg/d,常用剂量为300 mg/d。300 mg/d的给药量在部分情况下,无法将血尿酸水平控制在目标范围内,增大剂量可能会增加不良反应的发生[5]。非布司他是一种非嘌呤类黄嘌呤氧化酶选择性抑制剂,2009年2月美国食品药物管理局(FDA)批准其上市。较之别嘌醇,非嘌呤类抗痛风药非布司他具有较高的特异性,可避免出现别嘌呤醇类似的不良反应[5]。有学者对国外非布司他用于痛风的疗效与安全性进行了Meta分析[6],但未纳入国内研究。本研究旨在对包括国内研究在内的随机对照试验(RCT)进行系统评价,以期为临床用药提供参考。
1 资料与方法
1.1 纳入与排除标准
研究类型:包含1个以上结局指标的随机对照试验(RCT),文献语种限定为中文、英文。
研究对象:包括痛风和无症状高尿酸血症患者。其中痛风患者符合美国风湿病学会诊断标准[7],即受影响的关节有尿酸一钠结晶形成,或满足美国风湿病学会关于痛风诊断标准12条中6条以上;高尿酸血症患者血尿酸(sUA)≥8.0 mg/dL。
排除标准:继发性高尿酸血症;重度肾功能不全;丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)超过正常值上限1.5倍;酗酒。
干预措施:干预组给予非布司他,对照组给予别嘌呤醇。
结局指标:末次随访时sUA≤6.0 mg/dL的患者比例,末次随访时sUA下降百分比,痛风发生率,不良反应发生率,严重不良反应发生率。
1.2 文献检索与筛选及资料提取
计算机检索Pubmed,The Cochrane Library,EMbase,中文科技期刊全文数据库(CNKI),中国生物医学文献服务系统(SinoMed),维普中文科技期刊数据库(VIP)和万方数据库。英文检索以Pubmed为例,检索策略见表1。以“非布司他”“非布索坦”“随机对照”等为中文检索关键词,检索中文文献数据库。文献检索、筛选及数据提取分别由2位研究人员独立进行,然后相互交换结果进行核对。资料提取的主要内容包括:试验的基本信息(研究题目、刊出时间、国别、样本量等),试验对象的一般资料(年龄、性别、合并症、既往治疗史),干预措施(参比对象、剂量、给药频次、治疗时间、随访时间),研究方法学信息(研究设计、纳入排除标准等),结局指标等。
1.3 方法学质量评价
依据Cochrane系统评价手册V5.1.0对纳入RCT的方法学质量进行评价。

表1 检索策略
1.4 统计学处理
采用Cochrane中心提供的RevMan 5.3软件对数据进行Meta分析。用 χ2检验对纳入研究进行统计学异质性检验,检验水准α=0.10。若无统计学异质性,则采用固定效应模型进行分析。若存在异质性,则采用随机效应模型分析或亚组分析。连续变量用均数差(MD)表示效应量,分类变量采用相对危险度(RR)表示效应量,采用95%可信区间(95%CI)。
2 结果
2.1 检索结果
检索结果与纳入文献特征:检索共获得英文文献85篇,中文文献0篇。删去重复文献、非RCT试验、综述、生物等效性研究等文献78篇,最后纳入符合标准文献7篇。最终纳入7项RCT[8-14],其中包含3项美国研究、2项日本研究、2项中国研究。均以别嘌呤醇作为参照对象,部分设置有安慰剂组,对非布司他治疗痛风或高尿酸血症的有效性与安全性进行了评价,但在研究持续时间、给药剂量等方面存在不同,详见表2。
纳入研究偏倚风险评估:见图1。

表2 纳入RCT的基本参数
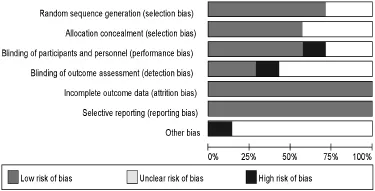
图1 纳入研究偏倚风险评估
2.2 Meta分析
2.2.1 末次随访sUA小于6.0 mg/dL患者比例
纳入7项RCT均报道了不同剂量组末次随访时sUA<6.0 mg/dL的患者人数与比例。虽然各RCT设置分组不尽相同,存在一定异质性,但总体来看,相较于别嘌呤醇组,所有非布司他组的sUA达标率更高,即sUA<6.0mg/dL[RR=1.56,95%CI:1.46~1.66,P<0.00001],如图2中2.4所示。
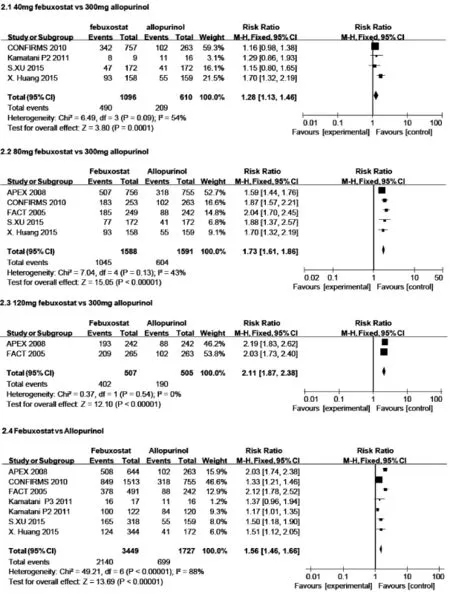
图2 末次随访sUA小于6.0 mg/dL患者比例
分别将合并的非布司他40,80,120 mg组与别嘌呤醇组进行分析,sUA达标率分别为45.8%[RR=1.28,95%CI:1.13~1.46,P=0.000 1],65.8%[RR=1.73,95%CI:1.61~1.86,P=0.0001],79.3%[RR=2.11,95%CI:1.87~2.38,P<0.00001],与剂量呈正相关趋势,与别嘌呤醇组的差异有显著性。见图2中2.1,2.2,2.3。
2.2.2 末次随访sUA降低比率
7项RCT均报道了试验对象末次随访时的sUA水平,非布司他组sUA降低比率介于32.4%~51.9%,而别嘌呤醇组sUA水平降低比率介于29.7%~36.6%。分别对非布司他40,80,120 mg组与别嘌呤醇组进行对比分析,结果显示,非布司他组的sUA下降幅度均大于别嘌呤醇组,差异有显著性[非布司他40 mg组,MD=1.82,95%CI:0.39~3.25,P=0.01;80 mg组,MD=10.21,95%CI:8.93~11.49,P<0.000 01;120 mg组,MD=18.33,95%CI:16.23~20.43,P<0.000 01]。由此可知,不同剂量的非布司他(40~120 mg)降低sUA的效果均优于别嘌呤醇。见图3。

图3 末次随访sUA降低比率
2.2.3 痛风发生率
在治疗痛风时,由于血尿酸水平突然降低,可能会诱发痛风。故在设计试验时,通常会在治疗初始8周给予秋水仙碱、非甾体抗炎药(NSAIDs)等预防痛风急性发作。纳入研究中,APEX,FACT,Huang X在前8周给予秋水仙碱、萘普生、美洛昔康等预防痛风发作。笔者分别对80 mg组、120 mg组进行了Meta分析,发现80 mg组在整个研究过程中,与别嘌呤醇组的痛风发生率无显著性差异。预防期120 mg组与别嘌呤醇组的痛风发生率有显著性差异[RR=1.65,95%CI:1.36~2.02,P<0.000 01],非布司他组的痛风发生率显著高于别嘌呤醇组;而非预防期两组之间的通风发生率则无显著性差异。见图4。
2.2.4 不良反应发生率
分别对非布司他组和别嘌呤醇组总不良反应的发生率进行分析,结果显示非布司他组的不良反应发生率明显低于别嘌呤醇组[RR=0.95,95%CI:0.91~0.99,P=0.03]。而在肝功能损害及严重不良反应发生率方面,均无显著性差异。见图5所示。
3 讨论
本研究中纳入的研究分别来自美国、日本、中国,其中来自美国的研究FACT,APEX,CONFIRMS主要受试对象是白种人,极少数其他人种,而来自日本和中国的研究主要以黄种人为主,这可能是纳入研究存在异质性的原因之一。进行分组研究时发现,异质性有所降低,由此推测剂量也是异质性增加的又一原因。另外,低剂量组与别嘌呤醇组的痛风发生率并无显著性差异,但随给药剂量的增大,非布司他组痛风的发生率明显增加,推测其原因是大剂量非布司他在迅速降低sUA的同时,也导致了痛风的发作,提示临床使用大剂量使用非布司他时,需密切关注痛风的发生,采取措施,提高患者生活质量。

图4 痛风发生率
本研究结果显示,非布司他的不良反应发生率显著低于别嘌呤醇,但严重不良反应发生率及肝功能损害发生率却无显著性差异。但有研究发现[14],使用非布司他患者的心血管不良反应发生率明显高于别嘌呤醇,但两者之间的因果关系尚无定论。纳入研究可能因为限于样本量有限、随访时间较短等因素,并未提示两者在心血管不良反应发生率方面的区别。
APEX与FACT的非盲延长期研究EXCEL显示,保持sUA达标后16~24个月,97%的痛风患者不再需要治疗痛风,且痛风结节的缩小54%,大约24个月后,痛风石完全溶解[1]。
[1]Edwards NL.Febuxostat:a new treatment for hyperuricaemia in gout[J].Rheumatology,2009,48(suppl 2):ii15-ii19.
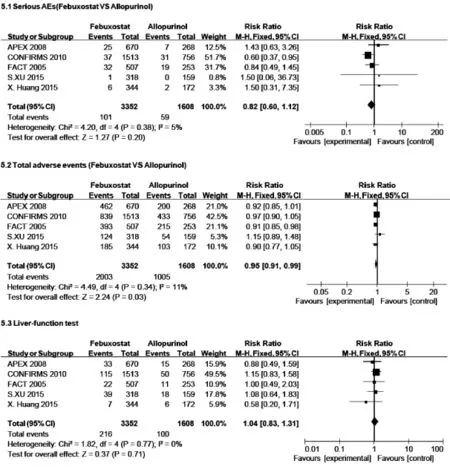
图5 严重不良反应发生率、总不良反应发生率及肝功能损害发生率
[2]Zhang W,Doherty M,Bardin T,et al.EULAR evidence based recommendations for gout.Part II:Management.Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics(ESCISIT)[J].Ann Rheum Dis,2006,65(10):1 312-1 336.
[3]中华医学会内分泌学会分会 .高尿酸血症和痛风治疗中国专家共识[J].中华内分泌代谢杂志,2013,29(11):913-920.
[4]Jordan KM,Cameron JS,Snaith M,et al.British Society for Rheumatology and British Health Professionals in Rheumatology guideline for the management of gout[J].Rheumatology,2007(46): 1 372-1 376.
[5]Perez-Ruiz F,Alonso-Ruiz A,Calabozo M,et al.Efficacy of allopurinol and benzbromarone for the control of hyperuricaemia.A pathogenic approach to the treatment of primary chronic gout[J].Ann Rheum Dis,1998,57(9):545-554.
[6]杨 婷,路 敏,周 颖,等.非布司他和别嘌醇治疗痛风有效性和安全性的Meta分析[J].中国临床药理学杂志,2015,31(2):122-126.
[7]Higgins JPT,Green S.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0[EB/OL].The Cochrane Collaboration,2011.www.cochranehandbook.org.
[8]Becker MA,Schumacher HR Jr,Wortmann RL,et al.Febuxostat compared with allopurinol in patients with hyperuricemia and gout[J].N Engl J Med,2005,353(23):2 450-2 461.
[9]Becker MA,Schumacher HR,Espinoza LR,et al.The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout:The CONFIRMS trial[J].Arthritis Res and Ther,2010,12(2):63.
[10]Schumacher JR HR,Becker MA,Wortmann RL,et al.Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout:A 28-week,phase III,randomized,double-blind,parallel-group trial[J].Arthritis Care Res,2008,59(11):1 540-1 548.
[11]Kamatani N,Fujimori S,Hada T,et al.An allopurinol-controlled,randomized,double-dummy,double-blind,parallel between-group,comparative study of febuxostat(TMX-67),a non-purine-selective inhibitor of xanthine oxidase,in patients with hyperuricemia including those with gout in Japan:phase 3 clinical study[J].J Clin Rheumatol,2011,17(4 Suppl2):13-18.
[12]KamataniN,FujimoriS,Hada T,etal.An allopurinolcontrolled, multicenter, randomized, open-label, parallel between-group,comparative study of febuxostat(TMX-67),a non-purine-selectiveinhibitor of xanthine oxidase,in patients with hyperuricemia including those with gout in Japan: phase 2 exploratory clinical study[J].J Clin Rheumatol,2011,17(4 Suppl 2):44-49.
[13]Xu SY,Liu XY,Ming J,et al.A phase 3,multicenter,randomized,allopurinol-controlled study assessing the safety and efficacy of oral febuxostat in Chinese gout patients with hyperuricemia[J].Int J Rheum Dis,2015,18(6):669-678.
[14]Huang XF,Du H,Gu JR,et al.An allopurinol-controlled,multicenter,randomized,doubleblind,parallel between-group,comparative study of febuxostat in Chinese patients with gout and hyperuricemia[J].Int J Rheum Dis,17(6):679-686.
RCT Review of Febuxostat vs Allopuinol in Treating Gout and Hyperuricemia
Fang Fang,Wang Peng
(No.416 Hospital of Nuclear Industry,Chengdu,Sichuan,China 610051)
Objective To evaluate the safety and effectiveness of febuxostat versus allopuinol for the treatment of gout and hyperuricemia.M ethods The randomized controlled trials(RCT)were got by searching the database including PubMed,the cochrane library,EMbase, CNKI,SinoMed,VIP,and Wanfang.Two investigator independently screened literature,extrcated data and assessed methodological quality of the studies.Then,the data extracting from RCTs were analyzed by the RevMan 5.3.Results 7 RCTs were included in total.The result of meta analysis demonstated that,a significantly greater proportion of subjects receiving febuxostat at any dose achieved the primary end point of sUA levels<6.0 mg/dl than subjects receiving allopurinol(45.8%[RR=1.28,95%CI:1.13-1.46,P=0.000 1],65.8% [RR=1.73,95%CI:1.61-1.86,P=0.000 1],79.3%[RR=2.11,95%CI:1.87-2.38,P<0.000 01]);at the final visit,all febuxostat doses produced significantly greater percent decreases in serum urate levels from baseline compared with allopurinol[febuxostat 40 mg, MD=1.82,95%CI:0.39-3.25,P=0.01;febuxostat 80 mg,MD=10.21,95%CI:8.93-11.49,P<0.000 01;febuxostat 120 mg,MD=18.33,95%CI:16.23-20.43,P<0.000 01].The incidence rate of gout in the prophylaxic period of febuxostat 120 mg had statistical ditherence with alloparinol group[RR=1.65,95%CI:1.36-2.02,P<0.000 01].There were no statistically significant differences in the proportion of subjects requiring treatment for gout flares in febuxostat 80 mg and no prophylaxis peroid of febuxostat 120 mg.Moreover,the adverse events incidence of febuxostat was lower than those of allopurinol[RR=0.95,95%CI:0.91-0.99,P=0.03].The incidence of liver function lesion,serious adverse events were similar in all treatment groups.Conclusion Based on current clinical evidence,the safety and effictiveness of febuxostat were better than allopurinol.
febuxostat;allopurinol;gout;hyperuricemia;systematic review
R969.4;R971+.1
A
1006-4931(2016)11-0013-07
2016-02-10)
