骨髓间充质干细胞移植对大鼠脑缺血再灌注损伤的神经保护作用
2016-12-22汪皖君管雅琳王雅静于长申刘首峰吕凤琼王世民王新平
汪皖君, 管雅琳, 王雅静, 于长申, 刘首峰, 吕凤琼, 王世民, 王新平
骨髓间充质干细胞移植对大鼠脑缺血再灌注损伤的神经保护作用
汪皖君, 管雅琳, 王雅静, 于长申, 刘首峰, 吕凤琼, 王世民, 王新平
目的 探讨骨髓间充质干细胞(BMSCs)移植对大鼠脑缺血再灌注损伤的神经保护作用,并探讨其可能的机制。方法 经体外培养并纯化BMSCs,移植前以10 mg/L的BrdU进行标记。线栓法制作大鼠MCAO模型,随机分为移植A组、B组及对照C组。在模型建立后7 d,通过尾静脉分别将3×106个BMSCs、1×106个BMSCs移植入A、B组大鼠体内,C组不作处理。于移植前、后分别进行改良神经损伤严重程度评分(mNSS)及Morris水迷宫测试,并取大鼠脑组织行免疫组织化学染色。结果 移植A组与移植B组、C组比较,行为学恢复更为明显,(P<0.01);B、C两组相比无显著性差异(P>0.05);移植A组大鼠学习和记忆能力较C组明显改善(P<0.05)。A、B组大鼠在脑损伤中心及周围区,可见Brdu单染阳性细胞及Brdu + MAP-2、Brdu+ GFAP、Brdu+vWF、Brdu+VEGF双染阳性细胞。结论 BMSCs经尾静脉移植至MCAO大鼠体内后,可在大鼠体内存活、分化,并促进大鼠伸进功能恢复。疗效与移植细胞数量相关。
骨髓间充质干细胞; 大脑中动脉栓; 尾静脉; 大鼠; 细胞移植
脑梗死可导致多种神经系统后遗症,是临床上发病率及致残率极高的血管性疾病[1],目前药物治疗未达到突破性的效果[2]。BMSCs具有向星形胶质细胞、神经元、少突胶质细胞等多种组织系统分化的潜能[3],并具备易于获得、体外培养能快速扩增、可自体移植、能免疫耐受并能够转染和长期表达外源性基因等优势。本试验通过建立大鼠MCAO模型,进一步探讨静脉途径移植BMSCs改善神经功能的机制,移植的有效剂量等问题。
1 材料和方法
本研究为随机对照动物试验,于2012年2月~2013年2月在天津市环湖医院细胞室和天津市环湖医院神经外科研究所完成。
1.1 材料
1.1.1 试剂及仪器 5,-溴脱氧尿嘧啶核苷(BrdU)、鼠抗人5’-溴脱氧尿嘧啶(BrdU)(MP MedBiochemicals公司);兔抗人胶原纤维酸性蛋白(GFAP)多克隆抗体(北京中杉金桥);兔抗人碱性成纤维细胞生长因子(bFGF)多克隆抗体(生物技术公司);兔抗人脑源性神经生长因子(BDNF)多克隆抗体、Polymer双染检测试剂盒、兔抗人神经元特异性烯醇化酶(NSE)多克隆抗体(武汉博士德公司);Morris水迷宫(中国医学科学院药物所制造)
1.1.2 实验动物 健康成年雄性SD大鼠4只,体重120~150 g,用于制备骨髓间充质干细胞。健康成年雄性SD大鼠120只,体重240~260 g,用于制备大鼠大脑中动脉栓塞模型。大鼠均购于中国军事医学科学院实验动物中心,动物质量合格证号:SCXK-(军)-2012-004。实验过程中对动物的处置符合2009年《 Ethical issues in animal experimentation》相关动物伦理学标准的条例。
1.2 实验方法
1.2.1 BMSCs的分离、培养和标记 密度梯度离心法结合贴壁筛选法分离获取BMSCs并在移植前1 d以BrdU标记,具体步骤见参考文献[4]。
1.2.2 MCAO模型制作及分组 120只雄性SD大鼠均以体积分数10%水合氯醛按0.33~0.36 ml/100 g进行腹腔注射麻醉,使用改良Zea Longa’s线栓法阻断左侧大脑中动脉制作大脑中动脉闭塞(MCAO)局灶性脑缺血模型[5],1 h后拔线栓再灌注。造模成功后7 d,纳入实验分组SD大鼠62只,随机分为3组:移植A组(25只)、B组(25只)、对照C组(12只)。
BMSCs移植:在造模后7 d通过尾静脉注射方法将含有约3×106个BMSCs的细胞悬液和1×106个BMSCs的细胞悬液各1 ml,分别经尾静脉注射移植入A组、B组大鼠体内,注射后使用1 ml生理盐水冲管[6]。C组自然恢复不做处理。移植后大鼠置于普通鼠笼中喂养,行清洁抗感染护理。
1.2.3 行为学评价 于大鼠移植前、移植后分别进行mNSS评分评估神经功能恢复情况;移植后用Morris水迷宫测试大鼠学习和记忆能力。由两名熟悉mNSS评分、Morris水迷宫的非试验人员独立观察记录,最后取平均值。
1.2.4 组织学检查 移植后7 d、14 d、30 d,在各组大鼠中均随机选取4只模型鼠,以40 g/L多聚甲醛磷酸盐缓冲液心脏灌注固定,断头取脑后置于多聚甲醛磷酸盐固定液中24 h以上。将脑组织制作常规石蜡切片,行苏木精-伊红染色及免疫组化染色。
1.2.5 主要观察指标 于大鼠移植前、移植后3 d、7 d、14 d、21 d、28 d进行mNSS评分;于移植后14 d、28 d进行Morris水迷宫训练及测试;移植后7 d、14 d、30 d脑组织行免疫组化染色,观察有无BrdU阳性细胞,Brdu+MAP-2、Brdu+GFAP、Brdu+vWF、Brdu+VEGF免疫组化双染阳性细胞及单染阳性细胞。
2 结 果
2.1 实验动物数量分析 实验选用大鼠62只,分为3组,无脱失,全部进入结果分析。
2.2 各组大鼠mNSS评分 该评分越高,神经功能缺损越严重,术前所有大鼠评分均为0分,移植前及移植后3 d时3组大鼠的mNSS均增高,但没有统计学差异(P>0.05),随后各组分值逐渐降低,A组分值明显低于其它各组,差异有显著性意义(7 d、14 d、21 d、28 dP<0.01)。B组、C组分值亦渐趋下降,取各组均数B组下降更明显,但两组差异无统计学意义(P>0.05)(见表1、图1)。
2.3 Morris水迷宫评价结果
2.3.1 定位航行试验 在大鼠移植后14 d,28 d定位航行试验结果:A、B、C三组比较,A组逃避潜伏期显著低于B、C两组(P<0.05),同时B、C两组之间,逃避潜伏期无显著差异(P>0.05)(见表2)。
2.3.2 空间探索试验 在大鼠移植后14 d,28 d空间探索试验结果:A、B、C三组比较,A组逃跨越平台次数多于B、C两组(P<0.05),同时B、C两组之间,跨越平台次数无显著差异(P>0.05)(见表3)。
2.4 组织学检查结果
2.4.1 HE染色 本实验为BMSCs异体移植,未使用免疫抑制剂,移植后1 m各组均未发现肿瘤细胞及异常分化细胞存在。三组大鼠脑组织HE染色均可见梗死区域:细胞坏死、神经纤维疏松、间质水肿,淋巴细胞、小胶质细胞吞噬坏死组织碎片形成的泡沫细胞及吞噬细胞,损伤区周边可见胶质细胞增生及炎细胞浸润,但脑室、海马结构相对较完整。
2.4.2 免疫组化单染结果 C组未见到BrdU阳性的细胞。A、B组可见到BrdU阳性细胞散在分布于损伤侧大脑半球的损伤中心区、脉络丛、脑室管膜周围及血管周围处。BrdU是标记在培养的BMSCs胞核上,BrdU阳性证实移植的BMSCs可在宿主脑内存活(如图2)。
2.4.3 免疫组织化学双染结果 A、B组在损伤中心区、脉络丛、脑室管膜周围、血管周围处可见Brdu+MAP-2、Brdu+GFAP、Brdu+ vWF,Brdu+VEGF双染阳性细胞,核呈红色,胞浆呈棕色(见图3)。
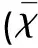
表1 各组大鼠神经功能损伤程度评分±s)
与模型组C相比*P<0.01;与模型组C相比☆P>0.05;与移植B组比较△P<0.01
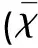
表2 各组大鼠定位航行试验比较±s)
与模型组C相比*P<0.05;与模型组C相比☆P>0.05;与移植B组比较△P<0.05
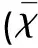
表3 各组大鼠空间探索试验比较±s)
与模型组C相比*P<0.05;与模型组C相比☆P>0.05;与移植B组比较△P<0.05
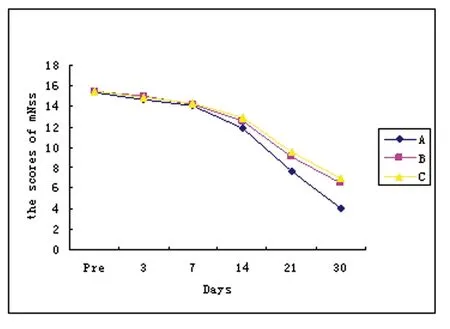
图1 脑损伤后不同时间点各实验组mNSS变化曲线
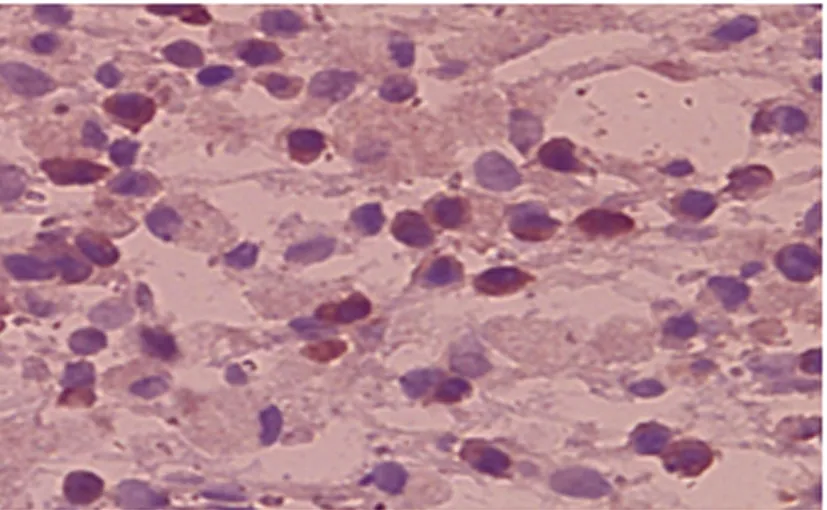
图2 BrdU×400
3 讨 论
3.1 BMSCs经尾静脉移植后可在MCAO大鼠体内存活、迁移并促进其神经功能恢复 本研究在移植组大鼠脑内可见Brdu阳性细胞。大鼠自体不含BrdU,本研究以Brdu标记BMSCs,在移植组大鼠脑内发现BrdU阳性细胞表明移植的BMSCs可在大鼠体内存活并向脑内迁移。
本研究以mNSS评分评估各组大鼠神经功能,评分越高,神经功能缺损越重。移植后3 d,三组大鼠mNSS评分均显著下降,且各组间比较无显著性差异,表明移植细胞在移植后3 d内尚不能充分发挥促进神经功能修复的作用。考虑可能与损伤早期脑内无菌性炎症反应及脑水肿影响移植细胞的迁移、定植,以及移植细胞需逐渐通过自分泌及促分泌等发挥促进神经修复作用有关。移植第7 d,A组行为学评分显著优于对照组,说明移植的BMSCs已经发挥神经修复作用。移植后30 d,A组行为学评分明显优于C组,说明移植的BMSCs仍可在大鼠体内存活并持续发挥促进其神经功能缺损修复的作用。
本研究通过Morris水迷宫评估大鼠学习记忆能力。结果表明,与C组相比,A组大鼠训练5 d后逃避潜伏期显著缩短,几乎可以快速找到平台,目的较为明确,空间学习能力显著优于C组,提示移植一定数量的BMSCs能改善MCAO大鼠的学习记忆功能。
本研究中,免疫组化结果显示经尾静脉途径移植的BrdU+-BMSCs,分布于损伤侧的缺血中心区、海马、脉络丛、室管膜周围及血管周围,表面移植的BMSCs可以在大鼠体内存活并向缺血周围组织迁移。有研究[7]发现BMSCs在脑内存活和迁移的方式类似于大鼠星形胶质细胞,可以沿着室管膜下和胼胝体进行迁移。
本研究中,移植组大鼠脑内可见的Brdu+BDNF、Brdu+VEGF、BrdU+vWF双染阳性细胞,表明移植的BMSCs不仅可在宿主脑内存活、迁移,并可分泌神经生长因子及促进内源性血管生长因子分泌[8,9]。亦有相关研究表明,移植的BMSCs可促进宿主内源性神经生长因子表达[10],从而发挥脑缺血后的神经保护作用。
本研究表明移植BMSCs对于脑梗死的治疗存在很大价值,尤其是可以改善神经功能缺损,与既往多个研究结果相同[11~13]。
3.2 BMSCs经尾静脉移植后促进MCAO大鼠神经功能恢复的疗效可能与移植数量相关 本研究中A组大鼠mNSS评分及学习记忆能力恢复显著优于B组,表明细胞移植疗效可能与移植的BMSCs的数量相关,移植细胞数量需达到一定阈值方可发挥促进神经修复作用。考虑与尾静脉移植较立体定向移植等其他移植方式,距损伤中心相对较远且需通过血脑屏障等,消耗相对较多,故移植数量在一定范围内可显著影响疗效。
3.3 MCAO大鼠经尾静脉移植BMSCs安全性评估 本研究未应用免疫抑制剂,在BMSCs同种异体移植后30 d,仍可见BMSCs存活于宿主体内,说明BMSCs免疫原性较低,可以与移植宿主较好的相容。与本研究类似,Scheibe等[14]在MCAO造模后6 h经静脉途径移植BMSCs至同种小鼠体内,之后用流式细胞技术观察移植后的免疫反应,结果显示炎性反应水平与对照组几乎等同。
4 结 论
本研究证明,经尾静脉途径移植BMSCs至MCAO大鼠体内后,其可在大鼠体内存活、分化,并促进大鼠神经功能恢复,考虑机制可能与移植的BMSCs促进神经营养因子分泌有关。BMSCs的疗效与数量有关,与1×106相比,3×106有较好的疗效。同种异体移植BMSCs是安全的,整个实验过程中未发现明显免疫排斥反应及肿瘤形成。但本实验观察时间相对较短,其远期效果及安全性等尚需进一步研究。
[1]Wessel MJ,Zimerman M,Hummel FC. Non-invasive brain stimulation:an interventional tool for enhancing behavioral training after stroke[J]. Front Hum Neurosci,2015,5(9):265.
[2]Gomis M,Dávalos A. Recanalization and reperfusion therapies of acute ischemic stroke:what have we learned,what are the major research questions,and where are we headed[J]? Front Neurol,2014,11(5):226.
[3]Peng T,Zhu G,Dong Y,et al. BMP4:a possible key factor in differentiation of auditory neuron-like cells from bone-derived mesenchymal stromal cells[J]. Clin Lab,2015,61(9):1171-1178.
[4]Zhang J,Li Y,Zhang ZG,et al. Bone marrow stromal cells increase oligodendrogenesis after stroke[J]. Cereb Blood Flow Metab,2009,29(6):1166-1174.
[5]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84-91.
[6]Yarygin KN,Kholodenko IV,Konieva AA,et al. Mechanisms of positive effects of transplantation of human placental mesenchymal stem cells on recovery of rats after experimental ischemic stroke[J]. Bull Exp Biol Med,2009,148(6):862-868.
[7]Li Y,Hua XM,Hua F,et al. Are bone marrow regenerative cells ideal seed cells for the treatment of cerebral ischemia[J]? Neural Regen Res,2013,8(13):1201-1209.
[8]Li N,Wang P,Ma XL,et al. Effect of bone marrow stromal cell transplantation on neurologic function and expression of VEGF in rats with focal cerebral ischemia[J]. Mol Med Rep,2014,10(5):2299-2305.
[9]Bao X,Wei J,Feng M,et al. Transplantation of human bone marrow-derived mesenchymal stem cells promotes behavioral recovery and endogenous neurogenesis after cerebral ischemia in rats[J]. Brain Res,2011,1367:103-113.
[10]Shichinohe H,Ishihara T,Takahashi K,et al. Bone marrow stromal cells rescue ischemic brain by trophic effects and phenotypic change toward neural cells[J]. Neurorehabil Neural Repair,2015,29(1):80-89.
[11]路 蔚. 骨髓间充质干细胞移植治疗大鼠MCAO的实验研究[D]. 天津医科大学,2008:64.
[12]管雅琳,孔繁明,王世民,等. 骨髓间充质干细胞立体定向移植治疗大鼠脊髓损伤[J]. 中国组织工程研究与临床康复,2010,14(14):2549-2555.
[13]刘慧纯,张培培,王世民,等. 脐带间充质干细胞移植治疗大鼠脑缺血损伤[J]. 中国组织工程研究,2012,16(19):3471-3475.
[14]Scheibe F,Ladhoff J,Huck J,et al. Immune effects of mesenchymal stromal cells in experimental stroke[J]. Cereb Blood Flow Metab,2012,32(8):1578-1588.

a:Brdu+MAP-2×200 b:Brdu+GFAP×400 c:Brdu+vWF×200 d:Brdu+VEGF×400
图3 脑损伤后14 d,2个移植组大鼠损伤处可见Brdu+MAP-2、Brdu+GFAP、Brdu+vWF、Brdu+VEGF双染阳性细胞
Intravenous bone marrow-derived mesenchymal stem cells for the treatment of ischemia-reperfusion injury in rats
WANG Wanjun,GUAN Yalin,WANG Yajing,et al.
(Department of Neurological Rehabilitation of Tianjin Huanhu Hospital,Tianjin 300010,China)
Objective BMSCs were isolated in vitro and purified. Methods 10 mg/L BrdU was used for labeling before BMSCs transplantation. SD rats were used to establish the middle cerebral artery ischemia-reperfusion model with modified suture method. The models were randomly divided into transplantation group A、transplantation groupB and control groupC. 7 days after injury,rats in group A were given 3×106BMSCs,and in group B were given 1×106BMSCs. Rats in the model group were left intact. Results Aafter transplantation of the BMSCs,group A’s recovery of the neurological deficit is was more apparently than group C and group B (P<0.01). There was no significant difference between group B and group C (P>0.05). Double-staining cells of immunohistochemistry could be found at the center of damage and surrounding of it. BrdU+cells and Immunohistochemical double staining positive cells were seen in group A and group B. BMSCs transplanted through vena caudalis can could survive and differentiate in the host brain. Conclusion BMSCs transplanted through vena caudalis can survive and differentiate in the host brain damage region. BMSCs transplantation is able to improve the neural function of cerebral ischemia injured rats. The efficacy is related to the number of BMSCs.
Bone marrow-derived mesenchymal stem cells; MCAO; Vena caudalis transplantation; SD rats; Cell transplantation
1003-2754(2016)11-1017-04
2016-07-10;
2016-10-21
天津市科学技术委员会资助项目(No. 11JCZDJC19400);天津市卫生局立项课题(No. 09KZ41)
[天津市脑系科中心医院(环湖医院)神经康复科,天津 300010]
王新平,E-mail:wangxinpingtj@sina.com
R743
A
