STAT3在Aβ寡聚体诱导的小胶质细胞炎症反应中的作用
2016-12-22郭秀美张启芳官志忠
郭秀美, 张启芳, 官志忠,
STAT3在Aβ寡聚体诱导的小胶质细胞炎症反应中的作用
郭秀美1, 张启芳2, 官志忠1,2
目的 研究β-淀粉样蛋白(Aβ)诱导小胶质细胞产生炎症反应中信号转导和转录激活子3(STAT3)的表达水平及作用。方法 用蛋白印迹法检测STAT3在Aβ寡聚体诱导的BV2小胶质细胞炎症反应中的表达水平;用siRNA沉默STAT3的表达后,实验分为正常对照组、siRNA STAT3组、Aβ处理组、Control siRNA+ Aβ 组以及siRNA STAT3+ Aβ组,用实时荧光定量PCR和酶联免疫吸附法(ELISA)检测IL1-β、TNF-α mRNA和蛋白的表达水平。结果 Aβ寡聚体处理小胶质细胞后p-STAT3的表达水平增高,与Aβ寡聚体的浓度和处理时间有关。siRNA沉默STAT3使其mRNA和蛋白表达分别下降约67%和65%;与正常对照组相比,Aβ处理组的IL1-β及TNF-α mRNA和蛋白的表达水平增高;与Aβ处理组相比,siRNA STAT3+ Aβ组的IL1-β 及TNF-α mRNA和蛋白的表达水平降低。结论 STAT3参与调控Aβ寡聚体诱导的小胶质细胞炎症反应中炎症因子的释放,在阿尔茨海默氏病(AD)的Aβ 作用机制中可能有一定的作用。
STAT3; 阿尔茨海默氏病; β淀粉样蛋白; 小胶质细胞; 炎症反应
小胶质细胞是大脑中具有高活性吞噬作用的巨噬细胞,在阿尔茨海默病(Alzheimer’s disease,AD)的炎症反应中起着重要作用[1]。在AD脑组织老年斑周围存在小胶质细胞的活化和聚集,其释放的炎症因子会对神经细胞和突触产生毒性作用。持续活化的小胶质细胞引起的慢性炎症反应是AD发病的主要病理机制之一[2]。
Janus酪氨酸蛋白激酶/信号转导和转录激活子蛋白(Janus kinase- signal transducer and activator of transcription,JAK- STAT)是近年来细胞信号转导通路的研究热点。其中,信号转导子与转录激活子3(signal transducer and activator of transcription3,STAT3)是该通路中重要的核转录因子,被证明参与了AD发病过程中小胶质细胞活化引起的慢性炎症反应,介导多种炎症因子的信号转导[3]。
本实验在体外用Aβ寡聚体诱导小胶质细胞产生炎症反应,应用RNA干扰技术,探讨STAT3在Aβ诱导的AD炎症反应中的作用。
1 材料和方法
1.1 主要材料 BV-2小鼠小胶质细胞购自中国科学院昆明细胞库。实验中的主要材料和试剂有DMEM高糖培养基、胎牛血清(Gibco公司,美国);0.25%胰蛋白酶、青-链霉素(Hyclone公司,美国);细胞计数试剂盒CCK-8(Dojindo公司,日本);Aβ1-42肽、六氟异丙醇、二甲基亚砜DMSO(Sigma公司,美国);小鼠抗 Aβ 单克隆抗体6E10(Biolegend公司,美国);辣根过氧化物酶标记的羊抗兔IgG、兔抗STAT3单抗隆抗体、STAT3 siRNA及沉默相关试剂(Santa Cruz公司,美国);兔抗β-actin单克隆抗体(Abmart公司,美国);兔抗p-STAT3多克隆抗体(Cell Signaling Technology公司,美国);Trizol总RNA提取试剂、cDNA合成试剂盒(Takara,日本);BCA蛋白定量试剂盒(Thermo公司,美国);TNF-α、IL1-β ELISA 检测试剂盒(eBioscience公司,美国);聚乙烯二氟PVDF膜、ECL试剂盒(Millipore公司,德国)。
1.2 方法
1.2.1 CCK-8方法测定Aβ1-42寡聚体的细胞毒性 在96孔板内以每孔105个小胶质细胞的密度接种,用DMEM高糖培养基培养长好后加入不同浓度的Aβ1-42寡聚体,置于 37℃、5% CO2培养箱内培养24 h后弃液,每孔加入100 μl培养基+10 μl CCK-8试剂避光共同孵育,2 h后通过酶标仪测定450 nm处OD值。重复3次。
1.2.2 蛋白印迹法检测p-STAT3、STAT3蛋白的表达 将裂解好的细胞悬液置于4 ℃冰冻离心机中12000 r/min离心15 min后取上清即为细胞总蛋白。用二喹啉甲酸(Bicinchoninic acid,BCA)法进行蛋白定量。用适量的细胞蛋白和上样缓冲液混合后煮沸5 min再进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳。电泳后采用半干法转膜至PVDF膜,然后用封闭液将膜封闭2 h。之后加入p-STAT3(1∶1000)、STAT3(1∶500)、β-actin(1∶5000)一抗4 ℃ 孵育过夜,然后加入对应的二抗在摇床上摇1 h。每进行下一步时都要用TBST 清洗,最后用 ECL发光试剂观察表达情况。
1.2.3 siRNA技术沉默小胶质细胞中STAT3的表达及实验分组 细胞按2×105密度接种6孔板,用无抗生素培养基培养,细胞贴壁达60%~80%。取1 μg siRNA 双链用 100 μl siRNA 转染培养基稀释制成溶液A,取6 μl siRNA 转染试剂用 100 μl siRNA 转染培养基稀释制成溶液B,溶液B加入溶液A轻轻混匀,置室温孵育30 min。用转染培养基漂洗细胞,AB混合液中加入0.8 ml转染培养基,混匀后加到细胞中孵育,6 h后换用含胎牛血清和抗生素的正常培养基继续孵育72 h。之后进行后续实验,实验分组如下:正常对照组、Aβ处理组、siRNA STAT3组、Control siRNA+Aβ组、siRNA STAT3+Aβ组。
1.2.4 实时荧光定量PCR检测STAT3、IL1-β、TNF-αmRNA的表达水平 各实验组的细胞用Trizol按试剂说明书完成RNA的提取,紫外分光光度计法定量后取总RNA 500 ng逆转录为cDNA,PCR条件:37 ℃,15 min;85 ℃,5 s;4 ℃,终止;10 μl体系。将cDNA产物作为模板加入Real-time PCR反应体系按以下条件进行:预变性95 ℃,30 s;PCR反应95 ℃,5 s;60 ℃,30 s;40循环,最后95 ℃,15 s;60 ℃,1 min;95 ℃,15 s终止,20 μl体系。引物序列:STAT3:Sense5’-TCGTGGAGCTGTTCAGTTCAGAAAC-3’,Antisence5’-GGAAATTTGACCAGCAACCT-3’;IL1-β:Sense5’-GGGCCTCAAAGGAAAGAATC-3’,Antisence5’- TACCAGTTGGGGAACTCTGC-3’;TNF-α:Sense5’- TATGGCTCAGGGTCCAACTC-3’,Antisence5’-TCC CTTTGCAGAACTCA GG-3’;β-actin:Sense5’- GTGCTATGTTGCTCTAGACTTCG-3’,Antisence5’- ATGCCACAGGATTCCATACC-3’。引物均由上海生工公司合成。应用2-ΔΔCT(RQ值)评价目的基因的转录水平。
1.2.5 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA) 各组小胶质细胞经处理后,取细胞上清液,用ELISA 检测试剂盒测定IL1-β和TNF-α 的蛋白水平,按说明书步骤进行操作。
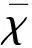
2 结 果
2.1 Aβ寡聚体对细胞的毒性试验 CCK-8试验结果显示,不同浓度的Aβ寡聚体对小胶质细胞的毒性作用呈现剂量-效应关系。自0.5 μmol/L浓度起,寡聚体的毒性作用明显;浓度为1 μmol/L时,BV2细胞的存活率下降约50%,与对照组相比,有显著差异(P<0.01),所以选择1 μmol/L浓度的Aβ寡聚体处理BV2细胞(见图1)。
*表示与对照组比较P<0.05;**表示与对照组比较P<0.01

图2 BV2细胞免疫荧光染色(×100)

*表示与对照组比较P<0.05;**表示与对照组比较P<0.01

*表示与对照组比较P<0.05;**表示与对照组比较P<0.01
*表示与对照组比较P<0.05

*表示与对照组比较P<0.05

**表示与对照组比较P<0.01;##表示与Aβ处理组比较P<0.01

**表示与对照组比较P<0.01;##表示与Aβ处理组比较P<0.01

**表示与对照组比较P<0.01;##表示与Aβ处理组比较P<0.01
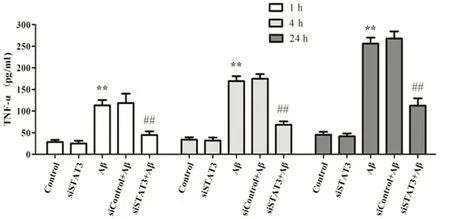
**表示与对照组比较P<0.01;##表示与Aβ处理组比较P<0.01
图10 ELISA法测各处理组上清液中TNF-α蛋白的表达
2.2 Aβ寡聚体处理BV2细胞的免疫荧光染色 结果显示与对照组相比,以6E10标记的Aβ寡聚体呈红色,并且培养基中的Aβ寡聚体进入BV2细胞内,以构建AD细胞模型,见图2。
2.3 蛋白印迹法检测不同浓度Aβ寡聚体刺激BV2细胞STAT3蛋白表达 图3显示,与对照组相比,0.5 μmol/L Aβ寡聚体刺激BV2细胞可使p-STAT3蛋白表达水平增高(P<0.05),1.0 μmol/L Aβ寡聚体处理使p-STAT3蛋白表达水平明显增高(P<0.01);总STAT3蛋白表达水平没有明显改变。
2.4 蛋白印迹法检测1.0 μmol/L Aβ寡聚体刺激BV2细胞不同时间的STAT3蛋白表达 图4结果显示,BV2细胞在Aβ寡聚体刺激下,STAT3在不同时间磷酸化程度有明显改变,其中1 h的处理使 STAT3的磷酸化水平较其他时间明显增高。
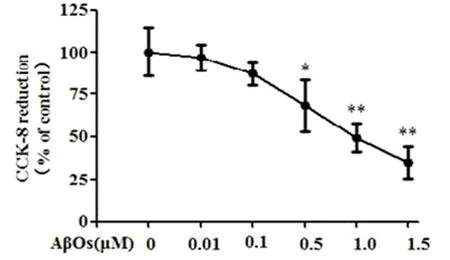
2.5 siRNA沉默STAT3在BV2细胞中的表达 图5所示,siRNA沉默STAT3后,与对照组比较,STAT3 mRNA和蛋白的表达水平分别下降约67%和65%;图6所示,siRNA沉默STAT3后,与对照组比较,p-STAT3与总STAT3蛋白表达水平均明显降低(P<0.05)。
2.6 siRNA沉默STAT3后,各处理组IL-1β和TNF-α表达情况 图7~图10结果显示,Aβ处理组与对照组相比,IL-1β和TNF-α的mRNA及蛋白的表达水平均显著增高;而siRNA沉默STAT3后再用Aβ寡聚体处理(即siSTAT3+Aβ组)与单纯Aβ处理组相比,IL-1β和TNF-α的mRNA及蛋白的表达水平均明显降低(P<0.01)。结果表明小胶质细胞在Aβ寡聚体的刺激下会产生明显的炎症反应,释放炎症因子;而siRNA沉默STAT3后再用Aβ寡聚体刺激小胶质细胞时炎症反应明显减弱。单纯用siRNA沉默STAT3(未用Aβ寡聚体处理组)及转染试剂对细胞炎症反应未产生明显影响。
3 讨 论
AD是一种常见于老年人群的神经退行性疾病,可导致认知功能障碍,记忆能力进行性减退。随着人口老龄化的进程不断加速,AD成为全世界日益严重的社会问题[4]。但其病因及发病机制仍不清楚。目前认为,Aβ沉积激活小胶质细胞产生炎症反应是 AD 的发病机制之一[5]。有研究发现,小胶质细胞在Aβ沉积形成的脑组织老年斑周围聚集并活化[6,7]。一方面,小胶质细胞通过吞噬作用帮助清除Aβ,另一方面,小胶质细胞也会释放神经毒性因子,主要包括IL-1、TNF-α和IL-6等加重炎症反应[8~10]。已有研究证明用Aβ42 和Aβ40处理原代小胶质细胞能引起其 IL-1β表达增高[11];在 AD患者血清、 脑脊液及 Aβ 激活的小胶质细胞中,IL-1β和TNF-α浓度均显著升高[12]。本实验用Aβ寡聚体刺激小胶质细胞产生炎症反应,也得到同样结果。小胶质细胞释放的这些炎症因子反过来又会作用于神经细胞和小胶质细胞,并促进其他炎症因子的产生[13]。因此,在Aβ沉积,激活的小胶质细胞和小胶质细胞释放的炎症介质之间形成了一个恶性循环,最终导致神经细胞变性坏死。
有研究发现,Aβ寡聚体可通过JNK、MAPK及NF-κB通路等途径激活小胶质细胞从而产生炎症反应[14~17]。但是,Aβ 寡聚体诱导小胶质细胞产生炎症反应的机制及与细胞信号传导通路的关系尚不清楚。许多研究表明,STAT3参与Aβ寡聚体引起小胶质细胞的慢性激活和炎症因子的释放[15,18]。STATs是近年来研究细胞信号传导的热点,STAT3是该家族中重要的核转录因子,介导多种细胞因子向核内传导,影响靶基因的转录,调控细胞的功能。STAT3被证明参与多种炎症因子的转录调节[19],有研究表明STAT3在AD小鼠的脑组织中的表达增高,可能与AD的慢性炎性损伤有关[20]。
Huang等[21]研究表明用选择性JAK抑制剂AG490阻断下游信号转导和转录激活子 STAT3 活化后,激活的小胶质细胞释放的炎症因子TNF-α和NO的表达水平显著降低。Paris等[22]研究发现用新烟草碱抗炎药处理Tg /APPsw AD小鼠后,小鼠大脑中STAT3磷酸化水平以及炎症因子TNF-a 和 IL-6的浓度均明显降低。为了更直接明确Aβ寡聚体诱导的小胶质细胞炎症反应与STAT3之间的关系,本研究采用siRNA干扰技术沉默BV2 细胞中STAT3的表达,结果发现小胶质细胞释放的炎症因子的水平也随之显著降低。证明Aβ寡聚体诱导小胶质细胞产生炎症反应可通过STAT3调控炎症因子的释放。提示STAT3与Aβ寡聚体介导的炎症反应之间有密切的关系,可能参与了AD发病过程中Aβ的作用机制。
[1]Tejera D,Heneka M. Microglia in Alzheimer’s disease:the good,the bad and the ugly[J]. Current Alzheimer Res,2016,13(4):370-380.
[2]Birch AM,Katsouri L,Sastre M. Modulation of inflammation in transgenic models of Alzheimer’s disease[J]. J Neuroinflamm,2014,11(1):1-13.
[3]Zhang ZH,Yu LJ,Hui XC,et al. Hydroxy-safflor yellow A attenuates Aβ-induced inflammation by modulating the JAK2/STAT3/NF-κB pathway[J]. Brain Res,2014,1563:72-80.
[4]Prince MJ,Wimo A,Guerchet MM,et al. World Alzheimer Report 2015 - the Global Impact of Dementia[M]. London:Alzheimer’s Disease International,2015.
[5]Michael TH,Douglas TG,Eicke L. Innate immunity in Alzheimer’s disease[J]. Nature Immunology,2015,3:229-236.
[6]Rozemuller JM,der Valk PV,et al. Activated microglia and cerebral amyloid deposits in alzheimer’s disease[J]. Res Immunol,1992,143(6):646-649.
[7]Streit WJ,Mrak RE,Griffin WS. Microglia and neuroinflammation:a pathological perspective[J]. J Neuroinflamm,2004,1:14.
[8]Frank LH,Richard MR,Burkhard B. Immune attack:the role of inflammation in Alzheimer disease[J]. Nature Neurosci,2015,6:358-372.
[9]Bachstetter AD,Norris CM,Sompol P,et al. Early stage drug treatment that normalizes proinflammatory cytokine production attenuates synaptic dysfunction in a mouse model that exhibits age-dependent progression of Alzheimer’s[J]. Neurosci,2012,32:10201-10210.
[10]Alam Q,Alam MZ,Mushtaq G,et al. Inflammatory process in Alzheimer’s and Parkinson’s diseases:central role of cytokines[J]. Current Pharmaceut Design,2016,22:541-548.
[11]Parvathy S,Rajadas J,Ryan H,et al. Aβ peptide conformation determines uptake and interleukin-1α expression by primary microglial cells[J]. Neurobiol Aging,2009,30(11):1792-1804.
[12]Ferreira ST,Clarke JR,Bomfim TR,et al. Inflammation,defective insulin signaling,and neuronal dysfunction in Alzheimer’s disease[J]. Alzheimers Dement,2014,10(Suppl 1):76-83.
[13]Calsolaro V,Edison P. Neuroinflammation in Alzheimer’s disease:Current evidence and futuredirections[J]. Alzheimers Dement,2016,12(6):719-732.
[14]Delgado M,Varela N,Gonzalez-Rey E. Vasoactive intestinal peptide protects against β-amyloid-induced neurodegeneration by inhibiting microglia activation at multiple levels[J]. Glia,2008,56(10):1091-103.
[15]Mao J,Yang J,Yan Z,et al. Arsenic trioxide mediates HAPI microglia inflammatory response and subsequent neuron apoptosis through p38/JNK MAPK/STAT3 pathway[J]. Toxicol App Pharmacol,2016,303:79-89.
[16]Bodles AM,Barger SW. Secreted β-amyloid precursor protein activates microglia via JNK and p38-MAPK[J]. Neurobiol Aging,2005,26(1):9-16.
[17]Song SY,Yu YJ,Hwang CJ,et al. Inhibitory effect of ent -Sauchinone on amyloidogenesis via inhibition of STAT3-mediated NF-κB activation in cultured astrocytes and microglial BV-2 cells[J]. J Neuroinflamm,2014,11(1):1-14.
[18]Xiong J,Wang C,Chen H,et al. Aβ-induced microglial cell activation is inhibited by baicalin through the JAK2/STAT3 signaling pathway[J]. Inter J Neurosci,2014,124(8):609-620.
[19]Eufemi M,Cocchiola R,Romaniello D,et al. Acetylation and phosphorylation of STAT3 are involved in the responsiveness of microglia to beta amyloid[J]. Neurochemistry International,2015,81:48-56.
[20] Wan J,Fu AK,Hugon J,et ai. Tyk2/STAT3 signaling mediates b-amyloid-induced neuronal cell death:implication in Alzheimer’s disease[J]. Neurosci,2010,30:6873-6881.
[21]Huang CF,Ma R,Sun SG,et al. JAK2-STAT3 signaling pathway mediates thrombin-induced proinflammatory actions of microglia in vitro[J]. Journal of Neuroimmunology,2008,204:118-125.
[22]Paris D,Beaulieu-Abdelahad D,Abdullah L,et al. Anti-inflammatory activity of anatabine via inhibition of STAT3 phosphorylation[J]. European Journal of Pharmacology,2013,698:145-153.
The role of STAT3 in the inflammatory response of microglia induced by beta amyloid
GUO Xiumei,ZHANG Qifang,GUAN Zhizhong.
(The Department of Pathology of Guizhou Medical University,Guiyang 550004,China)
Objective To investigate the expression level and function of signal transducer and activator of transcription 3 (STAT3) in the inflammatory response of microglia induced by beta amyloid. Methods The expression level of STAT3 in the inflammatory responses of microglia induced by beta amyloid was detected by Western blotting;After the STAT3 was silent by siRNA,the experimental groups were divided into normal control,siRNA STAT3,Aβ group,Control siRNA+ Aβ,siRNA STAT3+ Aβ,then the mRNA and protein expression levels of IL1-β and TNF-α were measured by real-time fluorescence quantitative PCR and enzyme-linked immunosorbent assay (ELISA). Results The p-STAT3 expression increased in microglia treated with Aβ oligomers and was related to Aβ oligomers concentration and time. STAT3 siRNA marked its mRNA and protein expression decreased about 67% and 65% respectively;compared to the normal control group,the mRNA and protein expression levels of IL1-β and TNF-α of Aβ group increased;and compared to Aβ group,the mRNA and protein expression levels of IL1-β and TNF-α of siRNA STAT3+ Aβ group decreased. Conclusion STAT3 was involved in the regulation of the release of inflammatory cytokines in the inflammatory response of microglia induced by Aβ oligomers,playing a certain role in the pathogenesis of Aβ of Alzheimer’s disease(AD).
STAT3; Alzheimer’s disease; Beta amyloid ;Microglia; Inflammatory response
1003-2754(2016)11-0964-05
2016-09-25;
2016-10-16
国家自然科学基金(No. 81260173);教育部“长江学者和创新团队发展计划资助”(No. IRT13058);贵州省科技计划{黔科合重大专项字[2014]6008号};贵州省创新计划项目{黔教合协同创新中心[2014]06}
(1.贵州医科大学病理学教研室,贵州 贵阳 550004;2.贵州医科大学分子生物学重点实验室,贵州 贵阳 550004)
官志忠,E-mail:1457658298@qq.com
R361+. 3
A
